 © Куликова Дина Александровна, с.н.с., к.б.н. лаборатории МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИХ ПРОЦЕССОВ РАЗВИТИЯ
© Куликова Дина Александровна, с.н.с., к.б.н. лаборатории МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИХ ПРОЦЕССОВ РАЗВИТИЯОсновной причиной необратимой слепоты в мире является возрастная макулярная дегенерация. Это нейровоспалительное заболевание глаза может быть вызвано как генетическими, так и экологическими факторами. В процессе развития заболевания образуются нерастворимые внеклеточные отложения, называемые друзами, которые привлекают и активируют клетки иммунной системы: микроглию сетчатки и рекрутированные моноциты и макрофаги. Привлечение иммунных клеток запускает процесс воспаления, в конечном счете, приводящий к необратимой потере зрения у 80% пациентов и характеризуется аномальным ростом кровеносных сосудов из сосудистой оболочки под желтым пятном, известным как хориоидальная неоваскуляризация (ХНВ).
Исследование причин потери зрения показало, что ожирение является вторым по значимости фактором развития возрастной макулярной дегенерации после курения. Было выяснено, что у пациентов с более высоким индексом массы тела и увеличенным показателем абдоминального ожирения шанс возникновения поздней стадии возрастной макулярной дегенерации, приводящей к слепоте, увеличивается на 75%. Механизмы, посредством которых это происходит, остаются малопонятными. Были тщательно изучены последствия ожирения и выяснилось, что потеря веса у пациентов с ожирением снижает воспаление жировой ткани и восстанавливает гликемический индекс. Однако, оставалось неизвестным долгосрочное влияние ожирения на иммунный ответ в последующей жизни пациента после потери веса и возможности обратимости нейродегенеративных процессов. В работе авторы исследуют последствия ожирения в сетчатке глаза. Была изучена связь между прошлым ожирением и нейровоспалительными осложнениями на сетчатке.
Работа проводилась на мышах линии C57BL/6J. Самцов сажали на диету с высоким содержанием жиров на 11 недель, чтобы спровоцировать ожирение, а затем переводили на обычную диету, чтобы вызвать потерю веса. Мыши опытной группы на высокожировой диете весили в 3 раза больше, чем мыши контрольной группы, а потом их вес постепенно снижался и возвращался к весу контрольной группы. Системные метаболические параметры опытной группы тоже были нормализованы, о чем свидетельствовал тест на толерантность к инсулину и тест на провокацию глюкозой. Через 20 недель мышей опытной и контрольной группы подвергали лазерно-индуцированой фотокоагуляции глаза, чтобы вызвать хориоидальную неоваскуляризацию (ХНВ). Через две недели лечения очаги ХНВ и участки лазерного ожога были количественно оценены с помощью окрашивания высокомолекулярным FITC-декстраном и изолектином В4 (IB4) на препаратах сосудистой оболочки глаза. Было выявлено 40% увеличение ХВН у мышей опытной группы, причем остальные изменения, вызванные ожогом, оставались сопоставимы между опытной и контрольной группой. Таким образом, прошлое ожирение приводит к стойкому усилению неоваскуляризации в ткани сетчатки.
При ожирении макрофаги в жировой ткани претерпевают морфологические и функциональные изменения и становятся иммунологически активными, но было непонятно сохраняются ли эти свойства после похудения. Авторы проводили трансплантацию жировой ткани мышей, ранее страдавших ожирением, мышам с нормальным весом. Контрольной группе вводили жировую ткань мышей с нормальным весом. После полного заживления воспаления от хирургического вмешательства мышей подвергали ХВН, индуцированной лазером. Оказалось, что жировая ткань мышей, ранее страдавших ожирением, сохраняет свойства, способствующие патологической неоваскуляризации по сравнению с контрольной группой.
Авторы статьи сосредоточили свое внимание на гене dachsous, который является членом семейства трансмембранных рецепторов кадгеринов и частью важного сигнального пути под названием "Hippo". Этот ген хорошо изучен у дрозофилы, но раньше никогда не сообщалось, что он связан с человеческим ожирением. Авторы обнаружили, что нокдаун двух компонентов сигнального пути "Hippo", fat и fj, продукты которых непосредственно связанны с рецептором dachsous, тоже приводит к повышению уровня ТАГ.
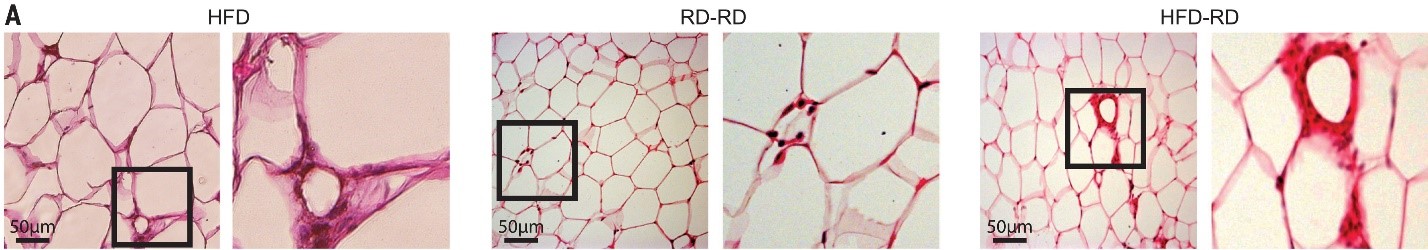
HFD – жировая ткань мышей с ожирением
RD-RD – жировая ткань в норме
HFD-RD – жировая ткань похудевших мышей
Были изучены особенности макрофагов жировой ткани мышей при ожирении и последующем похудении. Макрофаги после похудения сохраняли морфологию (рис.1) и физиологические особенности характерные для ожирения. Кроме того, при пересадке костного мозга от мышей с ожирением в прошлом у реципиентов наблюдалась усугубление ХВН.
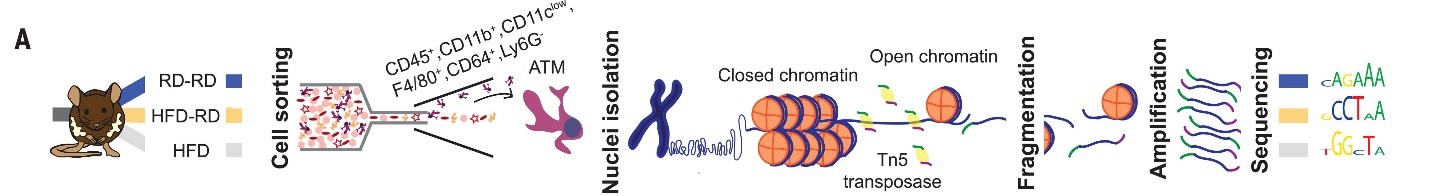

(А) Экспериментальная схема получения МЖТ для ATAC-seq. (G-H) Тепловые карты зон дифференциальной доступности хроматина при сравнении МЖТ контрольных мышей с похудевшими мышами в наборах генов ангиогенеза
(G) и воспалительной реакции
(Н) RD-RD – жировая ткань в норме, HFD-RD – жировая ткань похудевших мышей.
Было проведено сравнение эпигенетических профилей макрофагов жировой ткани, и выявлены различия, связанные с ожирением. Оказалось, что участки открытого хроматина, характерные для таких клеток, совпадают с генами, которые участвуют в биохимических путях, отвечающих за ангиогенез, продукцию цитокинов и воспалительную реакцию. Таким образом, ожирение приводит к перепрограммированию макрофагов жировой ткани, усиливая их способность к проангиогенным и провоспалительным реакциям. Эти особенности эпигенетических профилей сохраняются в макрофагах длительное время после похудения (рис.2).
Важный вопрос, на который нужно было получить ответ авторам: обнаруживается ли приобретенная иммунная память только в системных миелоидных клетках, только в локальной микроглии сетчатки или в обоих типах клеток. Были избирательно удалены отдельные популяции клеток посредством апоптоза и проведена их оценка. Обнаружено, что все миелоидные клетки вносят вклад в опосредованное ожирением изменение иммунитета. Полученные данные позволяют предположить, что пережитое ожирение может перепрограммировать как локальные, так и дистальные клетки врожденного иммунного ответа и влиять на индуцированные патологические события в тканях ЦНС, таких как сетчатка.
Ответы, которые авторы получили в своем исследовании открывают перспективы терапевтического воздействия на эпигенетическое перепрограммирование врожденной иммунной системы или устранения субпопуляций патологически перепрограмированных клеток, что может задержать или даже предотвратить возникновение возрастной макулярной дегенерации.
Новость подготовила © Куликова Д.А.
20.05.2024