


Клетки ретинального пигментного эпителия (РПЭ) принципиально важны для правильного развития и дальнейшего функционирования сетчатки глаза, и их нарушение активирует многие патологические процессы, зачастую приводящие к потере зрения. В представленной статье анализируются данные, свидетельствующие о гетерогенности морфологических и молекулярно- генетических свойств клеток РПЭ, об их пластичности и регенераторных возможностях у млекопитающих и человека. При внешнем сходстве клетки РПЭ очень различаются между собой по особенностям морфофизиологических и молекулярных свойств, которые стали приоткрываться современными методами лишь в последние годы.
В глазу взрослого человека монослой РПЭ включает 4-6 миллионов клеток. Морфометрию клеток проводили многие исследователи на протяжении не одного десятилетия, и только недавно в работе (Ortolan et al., 2022) была представлена первая полная морфометрическая карта РПЭ глаза человека с разрешением на уровне одной клетки. Авторы использовали программное обеспечение на основе искусственного интеллекта, REShAPE, сверхточная нейронная сеть U-net (CNN) способна распознавать и сегментировать границы клеток по флуоресцентным изображениям и проводить морфометрический анализ. Традиционно РПЭ разделяют на макулярный и периферический эпителий, в них Ortolan et al. выделили еще 5 топографических зон (Р1-Р5), клетки которых отличаются друг от друга по морфометрическим параметрам (рис.1 а). Самые правильные, ровные, гексагональные клетки с маленькой площадью и с 5-7 соседними клетками находятся в области фовеа и парафовеа. По направлению от центра к периферии постепенно увеличивается площадь клеток РПЭ, они удлиняются, нарушается правильная гексагональная форма, и уменьшается количество соседей. Результаты Ortolan et al. позволили детально и в полном масштабе увидеть клеточную мозаику слоя РПЭ. Например, различия в клетках в области фовеа и парафовеа видны только на тепловых картах, где эти области идентифицируются как темно-синее пятно шириной 3 мм (P1) в центре плоского препарата рядом со зрительным нервом (рис. 1 а). В дополнение, исследователи выявили ранее неизвестное кольцо мелких клеток РПЭ (P4) между радиусом 14 и 17 мм от центра на плоском препарате РПЭ, которые по характеристикам напоминали клетки перифовеа (рис. 1 а). Они обнаружили, что клетки этих областей имели одинаковое отношение палочек/колбочек к плотности РПЭ и предположили существование возможной связи между размером клеток РПЭ и соотношением палочек и колбочек. Схема распределения фоторецепторов в сетчатке глаза человека, представленная (Ahnelt,1998) замечательно ложится на морфометрическую карту клеток РПЭ по Ortolan et al., (рис.1).
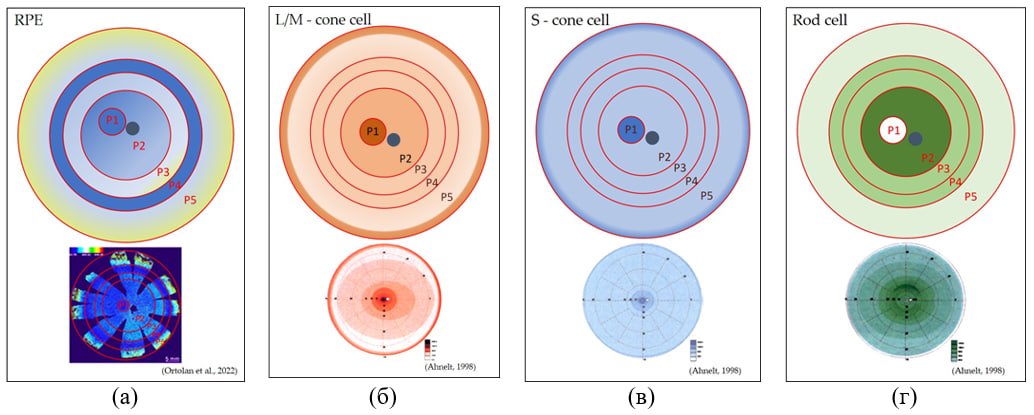
Рис. 1. Схематическое изображение тепловой карты ретинального пигментного эпителия (РПЭ) на основе данных работы Ortolan et al., 2022, и схема распределения фоторецепторов сетчатки глаза человека на основе работ Ahnelt, 1998 [1, 3]. (a) концентрические зоны РПЭ глаза взрослого человека на основе данных Ortolan et al., 2022 [1], P1 – фовеа и парафовеа, P2 – перифовеа, P3 – средняя периферия, P4 – впервые идентифицированное кольцо клеток РПЭ, напоминавшие клетки РПЭ зоны P1, P5 – дальняя периферия, заканчивающаяся ora serrata; Темно – синее окрашивание – это мелкие гексагональные правильной формы клетки RPE. Уменьшение насыщенности синего цвета с переходом в желтый цвет указывает на увеличение площади клеток, нарушения гексагональности и вытягиванию клеток RPE, а также уменьшение плотности клеток в монослое; (b) – интерпретация концентрических зон распределения M/L-колбочек в сетчатке взрослого человека по данным Ahnelt, по аналогии с концентрическими зонами РПЭ Ortolan et al. [1, 3]; чем насыщеннее цвет, тем более высокая плотность клеток; (c) – интерпретация концентрических зон распределения S-колбочек в сетчатке взрослого человека по данным Ahnelt, по аналогии с концентрическими зонами РПЭ Ortolan et al. [1, 3]; чем насыщеннее цвет, тем более высокая плотность клеток; (d) – интерпретация концентрических зон распределения палочек в сетчатке взрослого человека по данным Ahnelt по аналогии с концентрическими зонами РПЭ Ortolan et al. [1, 3]; чем насыщеннее цвет, тем более высокая клеточная плотность. RPE – ретинальный пигментный эпителий, L/M – cone cell - длинно- / средневолновые колбочки, S – cone cell -коротковолоновые колбочки.
В РПЭ человека находятся клетки с разным числом ядер, от одного до пяти, с неравномерным распределением в пределах клеточного слоя. Так, в области фовеа, где присутствуют только колбочки, РПЭ представлен одноядерными клетками, в то время как в области перифовеа, где преобладают палочки, доминируют многоядерные клетки RPE. Это указывает на корреляцию многоядерности клеток РПЭ с распределением и метаболизмом вышележащих фоторецепторных клеток.
В зависимости от топографии клетки РПЭ демонстрируют большую вариабельность по количеству гранул меланина и липофусцина. В фовеа, где преобладают колбочки, клетки РПЭ более темные из-за присутствия большого количества темно-коричневого меланина. Долее плотность меланина в клетках снижается от фовеа к парафовеа, а затем увеличивается к экватору (Różanowska et al., 2023). Меланин выполняет важную фотозащитную функцию за счет более эффективного поглощения света, нейтрализации активных форм кислорода и уменьшения повреждения свободными радикалами. Между содержанием липофусцина и меланина в РПЭ имеется отрицательная корреляция. Там, где плотность меланина максимальная, плотность липофусцина минимальна. Липофусцин в клетках РПЭ накапливается в процессе фагоцитоза внешних сегментов фоторецепторов. Его максимальная плотность наблюдается в клетках РПЭ перифовеа, где преобладают палочки с особенно удлиненными наружными сегментами. Существует прямая зависимость количества гранул меланина и липофусцина в клетках РПЭ от фоторецепторной мозаики сетчатки. Так с палочковыми фоторецепторами ассоциированы слабопигментированные, многоядерные клетки РПЭ, склонные к накоплению липофусцина, а с колбочками – сильнопигментированные, одноядерные клетки.
Раскрытие функций клеток, особенно в гетерогенных популяциях, представляется наиболее эффективным путем профилирования экспрессии генов. Методами секвенирования РНК было показано, что клетки РПЭ функционально различаются в зависимости от своего топографического положения. Выделяют 9 субпопуляций клеток РПЭ, которые отличаются по профилям экспрессии генов, что может указывать на их узкую специализацию (рис.2 а) (Xu et al., 2022).
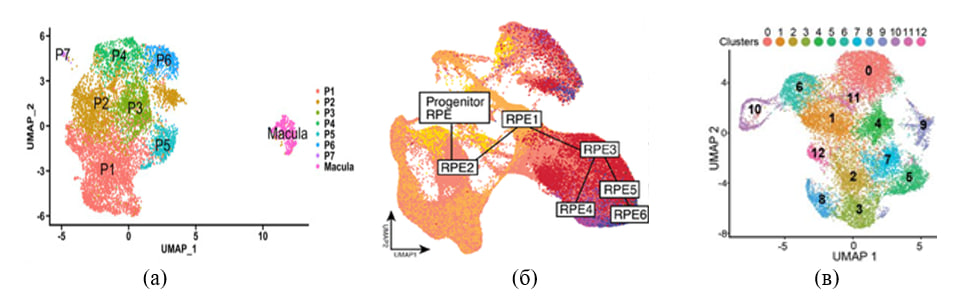
Рис. 2. Идентификация клеточных субпопуляций ретинального пигментного эпителия (РПЭ) человека. (а) Проекция UMAP для 9302 отдельных клеток из трех образцов ткани РПЭ человека показала в общей сложности популяции восьми типов клеток (Xu et al., 2022); (б) Проекция UMAP клеточных субпопуляций РПЭ, демонстрирующая две траектории развития РПЭ, полученного из ИПСК. Исследователи наблюдали раздвоенную траекторию от RPE3, образующую две ветви, которые заканчиваются RPE6 (траектория 1) и RPE4 (траектория 2) (Senabouth et al., 2021); (в) Секвенирование одноклеточной РНК выявило гетерогенность в культурах РПЭ, полученного из стволовых клеток самого РПЭ (РПЭСК). Проекция UMAP клеточных субпопуляций РПЭ-РПЭСК (Farjood et al., 2022). Каждая точка представляет собой клетку, и разные типы клеток различаются разными цветами.
Все исследования демонстрируют различный профиль экспрессии генов в клетках РПЭ разных топографических зон, что напрямую отражает специфические метаболические потребности сетчатки. Известно, что колбочки и палочки различаются по внутреннему метаболизму. Колбочки имеют в 3 раза больше поверхности мембранных дисков и потребляют больше энергии, чем палочки (Li et al., 2020). У колбочек в 2-10 раз больше митохондрий и именно митохондриальный метаболизм компенсирует дополнительную потребность в энергии. Восстановление зрительного пигмента в колбочках происходит как минимум в 100 раз быстрее, чем в палочках. Сами палочки макулярной области отличаются от палочек периферии тем, что им требуется большое количество энергии для поддержания высокой скорости обновления наружных сегментов фоторецепторов и поддержания процесса фототрансдукции. Несомненно, метаболизм самих колбочек, различающихся по длине волны и принадлежащих к разным топографическим зонам, имеет свои особенности и различия. Именно клетки РПЭ обеспечивают все эти разнообразные потребности фоторецепторов. Молекулярные и фенотипические различия между макулярным и периферическим РПЭ были идентифицированы многими группами исследователей. Клетки РПЭ макулы экспрессируют более высокие уровни генов, участвующих в синтезе липидов, метаболизме липидов, ангиогенезе и воспалении, там, где доминируют колбочки и метаболически активные палочки. В то время как периферические клетки РПЭ экспрессируют больше переносчиков монокарбоксилата, α- кетоглутарата, сахара, лейцина, пролина и холина и имеют более высокий уровень экспрессии генов, категории внеклеточного матрикса. Накопленные данные подтверждают представление о том, что фоторецепторы и РПЭ образуют взаимозависимую метаболическую экосистему. Это отражается на дифференциальном профиле экспрессии генов, белков и, соответственно, на морфологии клеток РПЭ.
Существует связь между усложнением функций клеток РПЭ и продолжительностью их дифференцировки в процессе онтогенетического развития. Функциональная гетерогенность заложена в генетической программе самих клеток, ее регуляторами являются эпигенетические процессы и факторы клеточного микроокружения. Кроме того, создается стойкое ощущение, что клетки макулярного и периферического РПЭ – это разные типы клеток одной ткани. Псевдовременной анализ данных секвенирования РНК показывает, что эти клетки развиваются независимо друг от друга, несмотря на схожесть генетического профиля. Подобную картину наблюдают при дифференцировки РПЭ из ИПСК (рис 2).
В активно развивающихся исследованиях полученния РПЭ из эмбриональных стволовых и индуцированных плюрипотентных клеток (ИПСК) встает вопрос о возникновении гетерогенности, подобной нативному РПЭ. Классификация клеток и анализ траекторий ясно указывали на эффективность дифференцировки ИПСК-РПЭ, где от стадии прогениторная клетка, клетки ИПСК- РПЭ расходятся в своей дифференцировке по двум траекториям (рис.2 б). Первая траектория отличалась по генам, участвующих в организации внеклеточного матрикса (TSPAN8), меланогенезе (TPH1) или развитии сетчатки (IRX6); и в траектории 2 экспрессируется гены, связанные с метаболизмом липидов (ADIRF, APOA1, CD36), связыванием железа (LCN2, MT1G), цитоскелетом (MYL7) или развитием сетчатки (PITX3) (Senabouth et al., 2021). Это расхождение в дифференцировке клеток ИПСК-РПЭ напоминает дифференцировку клеток РПЭ периферической и макулярной областей глаза человека in vivo. Подобную гетерогенность наблюдали в РПЭ, полученном из стволовых клеток самого РПЭ (РПЭСК-РПЭ) (рис. 2 в) (Farjood et al.,2022).
Среди субпопуляций РПЭ идентифицированы клетки, локализованные в макулярной области и на периферии монослоя, демонстрирующие свойства стволовых клеток (рис. 3). В ряде работ из РПЭ человека были выделены немногочисленные клетки, которые, согласно строгому клональному анализу и другим критериям стволовых клеток (самообновление и производство дифференциального потомства), были отнесены к взрослым стволовым клеткам РПЭ (РПЭСК). РПЭСК взрослого человека in vitro могут генерировать клетки, экспрессирующие маркеры клеток мезенхимного происхождения: мышечных, адипо-, остео- и хондрогенных клеток, нейральных стволовых клеток, глиальных клеток, фоторецепторов и РПЭ (Salero et al., 2012; Chen et. al.,2020; Shen et.al, 2020; Farjood et al.,2022). Исследования показывают, что при определенных условиях РПЭСК способны дифференцироваться в фоторецепторы, в частности в палочки. Почему они дифференцируются только в палочки, пока неизвестно. Этот вопрос требует отдельного исследования.
Гетерогенность РПЭСК-РПЭ проявляется не только в функциональной специализации клеток, но и в способности клеток РПЭСК-РПЭ к успешной трансплантации. Был выделен один кластер EZH2-позитивных РПЭСК-РПЭ, клетки которого способны интегрировать в монослой РПЭ хозяина при трансплантации. В качестве главного биомеркера эффективности трансплантации Farjood et al. рассматривают long noncoding RNA (lncRNA) Three Prime Repair Exonuclease 1 (TREX), который регулирует разные клеточные процессы, включая миграцию и выживаемость клеток. Эти данные позволят выделить из гетерогенных популяций РПЭСК-РПЭ, ИПСК-РПЭ, ЭСК-РПЭ, и РПЭ (из других возможных клеточных источников), отдельную субпопуляцию клеток, максимально подходящую для успешной трансплантации. На сегодняшний день, РПЭСК-РПЭ представляет собой потенциально неограниченный источник HLA-совместимых клеток, и неограниченный донорский источник с некоторыми качествами, благоприятными для пересадки, включая стабильность, повсеместность и стоимость. Кроме того, проходят активные клинические испытания 1 фазы у пациентов с сухой формой AMD (NCT04627428).
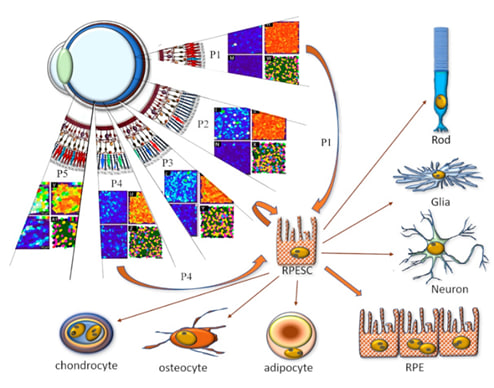
Рис. 3. Гетерогенность РПЭ в зависимости от топографического положения в слое. Стволовая клетка РПЭ (RPESC) и ее возможные дифференцировки.
Подводя итог, следует отметить, что необходимый для жизнеобеспечения сетчатки монослой клеток РПЭ, который метафорически сравнивают с булыжной мостовой, за кажущейся простотой скрывает удивительное разнообразие клеток, от терминально дифференцированных до высоко пластичных и стволовых. Сложно организованная структура глаза и видовая организация зрительного процесса предопределяют морфологические различия клеток РПЭ. В то же время, типы фоторецепторов и мозаика их распределения также диктуют различия функций РПЭ. Серьезный прорыв в изучении функции РПЭ дают методы RNA-seg и scRNA-seg, которые позволяют раскрыть специфику экспрессии генов в клетках РПЭ. При этом нужно отдавать себе отчет в том, что морфофункциональные и молекулярно-генетические особенности этих гетерогенных клеток еще предстоит детально изучить. Эти исследования позволят глубже понять роль клеток RPE в норме, в развитии патологических процессов в сетчатке, и будут, несомненно, важны для регенеративной офтальмопатологии.
Список литературы:
- Ortolan, D.; Sharma, R.; Volkov, A.; Maminishkis, A.; Hotaling, N.A.; Huryn, L.A.; Cukras, C.; Di Marco, S.; Bisti, S.; Bharti, K. Single-Cell–Resolution Map of Human Retinal Pigment Epithelium Helps Discover Subpopulations with Differential Disease Sensitivity. Proc Natl Acad Sci U S A 2022, 119, (19):e2117553119. DOI: 10.1073/PNAS.2117553119.
- Xu, Z.; Liao, X.; Li, N.; Zhou, H.; Li, H.; Zhang, Q.; Hu, K.; Yang, P.; Hou, S. A Single-Cell Transcriptome Atlas of the Human Retinal Pigment Epithelium. Front Cell Dev Biol 2021, 9, 3534, DOI: 10.3389/FCELL.2021.802457/BIBTEX.
- Ahnelt, P.K. The Photoreceptor Mosaic. Eye (Lond) 1998, 12 (Pt 3b), 531–540, DOI: 10.1038/EYE.1998.142.
- Różanowska M. B.; Lipofuscin, Its Origin, Properties, and Contribution to Retinal Fluorescence as a Potential Biomarker of Oxidative Damage to the Retina. Antioxidants (Basel) 2023, 12, 12, 2111, DOI: 10.3390/antiox12122111.
- Li, B.; Zhang, T.; Liu, W.; Wang, Y.; Xu, R.; Zeng, S.; Zhang, R.; Zhu, S.; Gillies, M.C.; Zhu, L.; et al. Metabolic Features of Mouse and Human Retinas: Rods versus Cones, Macula versus Periphery, Retina versus RPE. iScience 2020, 23, DOI: 10.1016/J.ISCI.2020.101672.
- Senabouth, A.; Daniszewski, M.; Lidgerwood, G.E.; Liang, H.H.; Hernández, D.; Mirzaei, M.; Zhang, R.; Han, X.; Neavin, D.; Rooney, L.; et al. Transcriptomic and Proteomic Retinal Pigment Epithelium Signatures of Age-Related Macular Degeneration. bioRxiv 2021, 2021.08.19.457044, DOI: 10.1101/2021.08.19.457044.
- Salero, E.; Blenkinsop, T.A.; Corneo, B.; Harris, A.; Rabin, D.; Stern, J.H.; Temple, S. Adult Human RPE Can Be Activated into a Multipotent Stem Cell That Produces Mesenchymal Derivatives; 2012; Vol. 10.
- Chen, F.; Liu, X.; Chen, Y.; Liu, J.Y.; Lu, H.; Wang, W.; Lu, X.; Dean, K.C.; Gao, L.; Kaplan, H.J.; et al. Sphere-Induced Reprogramming of RPE Cells into Dual-Potential RPE Stem-like Cells. EBioMedicine 2020, 52, DOI: 10.1016/J.EBIOM.2019.102618.
- Shen, H.; Ding, C.; Yuan, S.; Pan, T.; Li, D.; Li, H.; Huang, B.; Liu, Q. Vitamin C- and Valproic Acid-Induced Fetal RPE Stem-like Cells Recover Retinal Degeneration via Regulating SOX2. 2020.
- Farjood, F.; Manos, J.D.; Wang, Y.; Williams, A.L.; Zhao, C.; Borden, S.; Alam, N.; Prusky, G.; Temple, S.; Stern, J.H.; et al. Identifying Biomarkers of Retinal Pigment Epithelial Cell Stem Cell-Derived RPE Cell Heterogeneity and Transplantation Efficacy. bioRxiv 2022, 2022.11.22.517447, DOI: 10.1101/2022.11.22.517447.
Новость подготовили
© Л.А. Ржанова, Ю.В. Маркитантова и М.А. Александрова
20.03.2024