© Мун Валерий Владимирович. Аспирант 1 года обучения ИБР РАН. Лаборатория Эволюционной биологии развития.
© Мун Валерий Владимирович. Аспирант 1 года обучения ИБР РАН. Лаборатория Эволюционной биологии развития.
Резюме. После оплодотворения в эмбрионе происходит глобальное деметилирование генома, но сохраняются области, избегающие этой участи - родительские импринтированные регионы. Почему именно в них сохраняется родительский профиль метилирования - неясно. Считается, что модификация 5-гидроксиметилцитозином (5гмЦ) является предвестником деметилирования. И действительно, в анализируемой работе, методами секвенирования ДНК с учетом эпигенетических модификаций было показано, что в эмбриональном геноме на ранних этапах развития формируется волна генерации 5гмЦ, после которой происходит глобальное деметилирование. Но импринтированные регионы также модифицируются 5гмЦ, что не дает деметилироваться им? Было установлено, что за деметилирование генома может отвечать выход ДНК-метилтрансферазы Dnmt1 из пронуклеусов, а в случае ее задержки в ядре происходит аберрантное усиление метилирование генома. Как оказалось, области родительских импринтов богаты сайтами связывания транскрипционного фактора Zfp57, для которого показана способность участвовать в поддержании метилирования импринтированных регионов и привлечении ДНК-метилтрансфераз к своим целевым сайтам. Кроме того, установлено, что около трети этих областей в женском пронуклеусе были эпигенетически модифицированы по гистону H3 в ооцитах меткой, защищающей от деметилирования. Вероятно, репликация ДНК участвует в разбавлении и распределении этих меток по геному, регулируя процессы деметилирования.
Эпигенетические модификации часто определяют как функционально значимые изменения в геноме, которые не связаны с изменением последовательности нуклеотидов, например, метилирование ДНК или модификация гистонов. Эти изменения влияют на доступность ДНК для связывания с белками, что может активировать, или репрессировать транскрипцию генов. Обычно гиперметилирование промоторов генов приводит к их низкой экспрессии, в то время как гипометилированние, наоборот, активирует экспрессию гена (1). В клетках взрослого организма большинство генов метилировано и только часть - нет, причем в разных типах клеток паттерн метилирования разный, что является основой дифференциальной экспрессии генов и формирования различных типов клеток.
Метилированию подвергаются азотистые основания, в основном цитозин (5-метилцитозин 5мЦ), представленный в динуклеотидах CpG. При репликации ДНК узор метильных групп передается с материнской цепи ДНК на вновь синтезированную (дочернюю). Таким образом профиль метилирования сохраняется во время деления клеток. Это так называемое поддерживающее метилирование у млекопитающих осуществляется специальными ферментами метилтрансферазами DNMT (2).
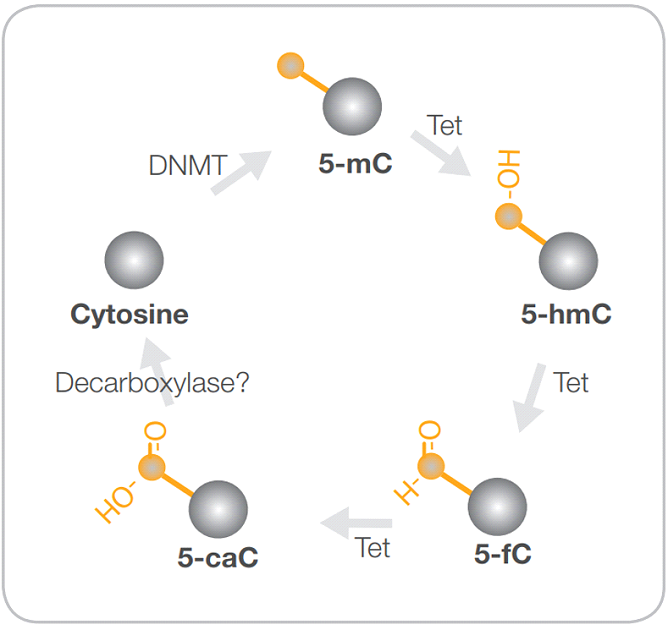
Интересно, что профиль метилирования генома, передающийся и от родителей к потомству через половые клетки. Однако он подвергается глобальному репрограммированию на ранних этапах эмбрионального развития, что проявляется в деметилировании практически всего генома. Считается, что это необходимо для включения ранее неактивных из-за метилирования генов и формирования состояния плюрипотентности эмбриональных клеток (3). Плюрипотентность - присущее ранним эмбриональным клеткам свойство дифференцироваться во все типы клеток организма. Деметилирование может происходить как пассивно, за счет блокирования поддерживающего метилирования в процессе репликации, так и активно, при участии ферментов семейства TET с образованием 5-гидроксиметилцитозина (5гмЦ) в качестве промежуточного продукта деметилирования (4) (Рис. 1; подробнее см. приложение).
За стадией деметилирования следует стадия метилирования de novo. По мере того, как разные группы эмбриональных клеток дифференцируются в различных направлениях, например, в эктодерму или энтодерму, формируется новый профиль метилирования. Это приводит к ограничению потенциала к дифференцировке в другие типы клеток. Интересно, что помимо ранних эмбриональных клеток, свойство плюрипотентности характерно и для предшественников половых клеток, т.н. первичных половых клеток (ППК). У млекопитающих ППК возникают в эмбриональном развитии из соматических клеток на стадии, когда те уже потеряли свою плюрипотентоность. Ее восстановление в них во многом определяется второй волной деметилирования генома, которая происходит только в половых клетках (5). За фазой деметилирования снова следует фаза метилирования de novo. Эта вторая фаза репрограммирования приводит к установлению уникального эпигенома в ППК и делает возможной дифференцировку зрелых гамет. При этом, образующийся характер метилирования различается в предшественниках мужских и женских половых клеток. В результате у потомков две аутосомные копии генов, унаследованные от каждого родителя в процессе оплодотворения, могут обладать разным профилем метилирования. Это явление называется родительским импринтингом (5).
Интересно, что в процессе эпигенетического репрограммирования такие дифференциально метилированные регионы (ДМР) сохраняют метилирование, что может влиять на аллель-специфическую экспрессию генов, играя весомую роль в раннем эмбриональном развитии.
В анализируемой статье Yan и соавторы (6) попытались ответить на вопрос, как импринтированные регионы ДНК сохраняют родительское метилирование во время эпигенетического репрограммирования в раннем эмбриональном развитии и какую роль в этом может играть 5-гидроксиметилцитозин.
Динамика гидроксиметилирования генома и установление роли 5гмЦ в деметилировании ДНК
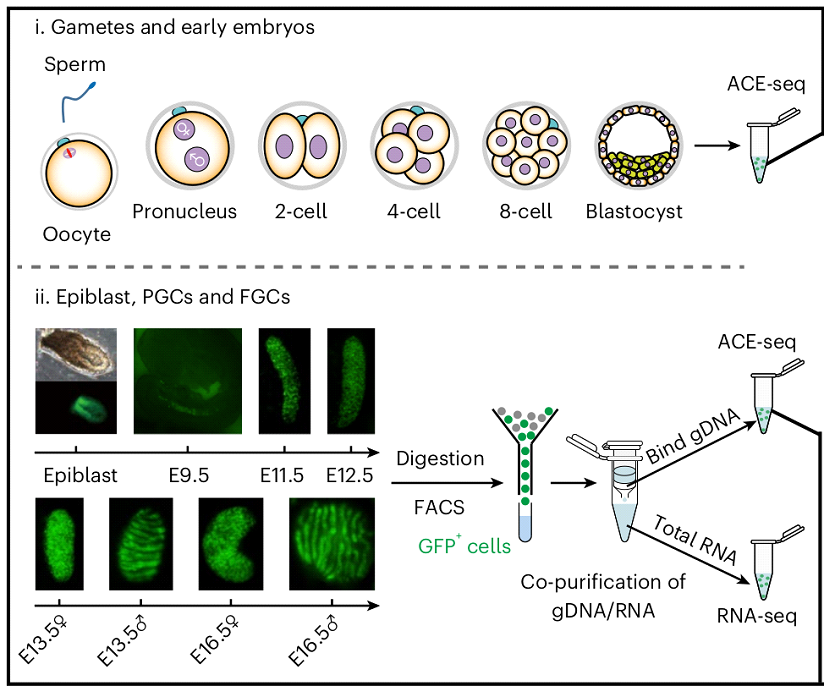
Чтобы понять как 5-гидроксиметилцитозин принимает участие в процессах реметилирования генома, исследователи установили профиль гидроксиметилирования отцовского и материнского геномов мыши во время раннего эмбрионального развития и развития половой линии, после чего сравнили его с динамикой метилирования. Это было сделано с помощью метода секвенирования ДНК с учетом эпигенетических модификаций, позволяющего картировать богатые 5гмЦ области в геноме (Рис. 2).
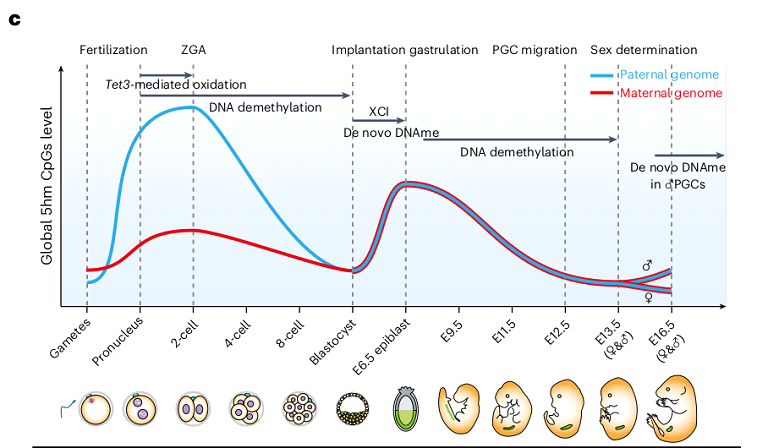
Общая картина модификации генома 5гмЦ заключается в том, что его генерация проходит в 2 волны (Рис. 3) и соотносится с волнами деметилирования (их границы на рисунке обозначены стрелочками). Первая генерация 5гмЦ начинается на стадии зиготы и первых делений дробления, вторая - на этапе появления половых клеток (стадия эпибласта). При этом, отслеживание эпигенетических модификаций отдельно в материнском и отцовском геномах показало, что в течение преимплантационного развития отцовский геном имеет больший уровень 5гмЦ по сравнению с материнским (Рис. 3). Установлено также, что деметилированные регионы в зиготе демонстрируют повышение уровня 5гмЦ по сравнению с гаметами, при этом уровень 5гмЦ в деметилированных локусах оказывается намного выше, чем в метилированных de novo или сохранивших метилирование локусах. Подобные закономерности позволяют принять роль окисления 5-метилцитозина до 5гмЦ как предвестника деметилирования генома.
Динамика 5гмЦ в импринтированных регионах ДНК
Для дальнейшего понимания роли 5гмЦ и его связи с деметилированием ДНК исследователи провели анализ гидроксиметилирования в дифференциально метилированных регионах гамет (ДМР), а также мужском или женском пронуклеусах (гаплоидные ядра гамет в составе зиготы). Оказалось, что во время раннего эмбрионального развития ДМР также подвергаются TET-зависимому окислению в зиготах, но последующего деметилирования этих областей не происходит. Это противоречие с выше сделанным выводом о роли 5гмЦ в процессе деметилирования генома потребовало дальнейшего исследования гидрокси-метилирования в раннем развитии.
Формирование 5гмЦ в геноме зародыша
Из предыдущих исследований известно, что в мужском пронуклеусе преимущественно происходит Tet3-зависимое окисление 5-метилцитозина до 5гмЦ (7). Текущее исследование подтвердило наличие Tet3-зависимой генерации 5гмЦ в обоих родительских геномах, но оказалось неожиданностью, что ингибирование репликации ДНК сильно замедляет накопление 5гмЦ в женском пронуклеусе. Это позволяет предположить активную роль репликации в регуляции данного процесса. Таким образом для понимания механизмов поддержания родительских импринтов требуется акцентировать внимание на этих двух процессах, участвующих в формировании 5гмЦ.
Модель деметилирования генома зародыша и её роль в понимании динамики метилирования родительских импринтов
Известно, что мутации генов семейства NLRP с материнским эффектом (т.е. мутации по одному из аллелей, материнскому или отцовскому) были связаны с аномальным усилением метилирования ДНК у людей. Поскольку пассивное деметилирование ДНК, вероятно, связано с перемещением метилтрансферазы Dnmt1 из пронуклеусов в цитоплазму, то, возможно, действие этих белков связано с ее транслокацией обратно в ядро. Однако понимание непосредственной связи генов NLRP с аберрантным метилированием ДНК было слабо изучено (8-10). Авторы изучили уровень гидроксиметилирования ДНК на ранних этапах развития у нокаутов по гену Nlrp14 по материнской линии.
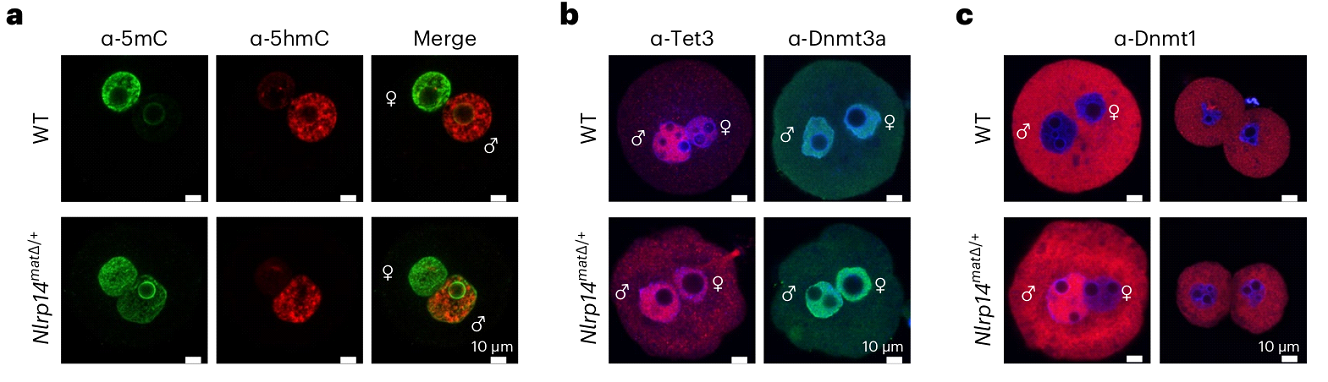
Было установлено, что в нокаутных эмбрионах на стадии зиготы деметилирование проявляется слабее, чем у нормальных эмбрионов, и высокий уровень метилирования наблюдается даже в мужском пронуклеусе. При этом уровень 5гмЦ не возрастал (Рис. 4а). Дальнейшую динамику метилирования генома отследить не удалось, поскольку нокаутные эмбрионы гибли на стадии двух бластомеров. Примечательно, что сигналы Dnmt1 были обнаружены не только в цитозоле, но и в пронуклеусе материнских нокаутных зигот и были явно сильнее обогащены в мужском пронуклеусе (Рис. 4б, в). Эти результаты свидетельствуют о наличии нарушений метилирования ДНК в зиготах Nlrp14 нокаутов.
Исходя из этих результатов, авторы сделали вывод, что материнский нокаут Nlrp14 способствует сохранению метилтрансферазы Dnmt1 в пронуклеусах зиготы и приводит к сохранению высокого уровня метилирования родительских геномов.
Деметилирование родительских импринтов не зависит от механизмов, вовлеченных в деметилирование остального генома
Важно отметить, что хотя уровень метилирования ДНК в масштабах всего генома был резко изменен при нокауте материнской аллели Nlrp14, ДМР остались незатронутыми в обоих родительских геномах. Эти наблюдения нуждаются в дополнительных объяснениях.
С помощью motif enrichment анализа, позволяющего определить какие транскрипционные факторы связываются с данной областью ДНК, авторы выявили группу транскрипционных факторов, связанных с ДМР, таких как, например, Zfp57 и Arntl. Известно, что белок Zfp57 принимает участие в поддержании родительских импринтов в ранних эмбрионах мыши и привлечении ДНК-метилтрансфераз (DNMTs) к своим целевым сайтам (11). Экспрессия этого фактора в раннем развитии эмбрионов млекопитающих может объяснить независимость метилирования ДМР от общего механизма деметилирования генома зародыша.
Репликация ДНК может регулировать формирование 5гмЦ в материнском геноме
5гмЦ генерируется в геномах обоих родителей, но его уровень в отцовском геноме выше (Рис. 2). Это позволяет предположить, что в женском пронуклеусе могут существовать защитные метки, происходящие из ооцитов и противостоящие Tet3-зависимому окислению. Интересно отметить, что 37,3% ДМР подвергшихся Tet3-зависимому окислению 5-метилцитозина до 5гмЦ, идентифицированных в женском пронуклеусе, были метилированы по гистону H3 в ооцитах. Модификация гистонов - это еще один вид эпигенетических меток, узнаваемых специальными белками, которые влияют на хроматин и могут усиливать или ослаблять транскрипцию генов. Метилирование гистона H3 является известной защитной меткой материнского генома от Tet3-зависимого формирования 5гмЦ (12, 13). Вероятно, репликация ДНК участвует в разбавлении и распределении этих меток по геному, что объясняет, почему ее блокирование приводит к ослаблению 5-гидроксиметилирования в женском пронуклеусе. В то же время остается не ясным, участвует ли этот механизм в селективном распределении 5гмЦ по определенным локусам, таким как ДМР.
Заключение
Представленная в обозреваемой работе комбинация современных методов секвенирования и анализ деметилирования ДНК на основе нокаутных моделей проливают свет на роль эпигенетических меток и позволяют установить механизмы динамики метилирования в ходе раннего эмбрионального развития. Так показана роль гена Nlrp14 в выведении метилтрансферазы Dnmt1 из пронуклеусов, что способствует деметилированию генома, за исключением родительских импринтных областей или дифференциально метилированных регионов. ДМР обогащены сайтами связывания белка Zfp57, для которого показано участие в поддержании родительского импринтинга путем привлечения ДНК-метилтрансфераз к своим целевым сайтам. Кроме того, установлено, что около трети Tet3-зависимых дифференциально метилированных регионов в женском пронуклеусе были эпигенетически модифицированы по гистону H3 в ооцитах меткой, защищающей от Tet3-опосредованного деметилирования.
Приложение
DNMT1 метилирует гемиметилированные CpG, сохраняя паттерны метилирования во время репликации ДНК.
DNMT3a и DNMT3b, метилтрансферазы de novo, устанавливают паттерны метилирования ДНК на ранних стадиях развития; могут метилировать неметилированную и метилированную ДНК.
DNMT3L способствует активности метилтрансферазы de novo.
Ферменты TET (Ten eleven translocation) участвуют в окислении метильной группы с образованием 5-гидроксиметилцитозина в качестве промежуточного продукта, приводящего к деметилированию (Рис. 1).
Список использованной литературы
- Bird, Adrian. “DNA methylation patterns and epigenetic memory.” Genes & development vol. 16,1 (2002): 6-21. doi:10.1101/gad.947102
- Hackett, Jamie A, and M Azim Surani. “DNA methylation dynamics during the mammalian life cycle.” Philosophical transactions of the Royal Society of London. Series B, Biological sciences vol. 368,1609 (2013): 20110328. doi:10.1098/rstb.2011.0328
- Seisenberger, Stefanie et al. “Conceptual links between DNA methylation reprogramming in the early embryo and primordial germ cells.” Current opinion in cell biology vol. 25,3 (2013): 281-8. doi:10.1016/j.ceb.2013.02.013
- Hackett, Jamie A, and M Azim Surani. “DNA methylation dynamics during the mammalian life cycle.” Philosophical transactions of the Royal Society of London. Series B, Biological sciences vol. 368,1609 (2013): 20110328. doi:10.1098/rstb.2011.0328
- Hackett, Jamie A et al. “Parallel mechanisms of epigenetic reprogramming in the germline.” Trends in genetics : TIG vol. 28,4 (2012): 164-74. doi:10.1016/j.tig.2012.01.005
- Yan, Rui et al. “Dynamics of DNA hydroxymethylation and methylation during mouse embryonic and germline development.” Nature genetics vol. 55,1 (2023): 130-143. doi:10.1038/s41588-022-01258-x
- Guo, Fan et al. “Active and passive demethylation of male and female pronuclear DNA in the mammalian zygote.” Cell stem cell vol. 15,4 (2014): 447-459. doi:10.1016/j.stem.2014.08.003
- Begemann, Matthias et al. “Maternal variants in NLRP and other maternal effect proteins are associated with multilocus imprinting disturbance in offspring.” Journal of medical genetics vol. 55,7 (2018): 497-504. doi:10.1136/jmedgenet-2017-105190
- Docherty, Louise E et al. “Mutations in NLRP5 are associated with reproductive wastage and multilocus imprinting disorders in humans.” Nature communications vol. 6 8086. 1 Sep. 2015, doi:10.1038/ncomms9086
- Murdoch, Sharlene et al. “Mutations in NALP7 cause recurrent hydatidiform moles and reproductive wastage in humans.” Nature genetics vol. 38,3 (2006): 300-2. doi:10.1038/ng1740
- Li, Xiajun et al. “A maternal-zygotic effect gene, Zfp57, maintains both maternal and paternal imprints.” Developmental cell vol. 15,4 (2008): 547-57. doi:10.1016/j.devcel.2008.08.014
- Nakamura, Toshinobu et al. “PGC7 binds histone H3K9me2 to protect against conversion of 5mC to 5hmC in early embryos.” Nature vol. 486,7403 415-9. 3 Jun. 2012, doi:10.1038/nature11093
- Zeng, Tie-Bo et al. “EHMT2 and SETDB1 protect the maternal pronucleus from 5mC oxidation.” Proceedings of the National Academy of Sciences of the United States of America vol. 116,22 (2019): 10834-10841. doi:10.1073/pnas.1819946116
Новость подготовил
© Мун В.В.
20.02.2023