 © Борисов Михаил Александрович, аспирант лаборатории клеточной биологии ИБР РАН.
Области научных интересов: клеточная терапия, тканевая инженерия, прямое перепрограммирование клеток
© Борисов Михаил Александрович, аспирант лаборатории клеточной биологии ИБР РАН.
Области научных интересов: клеточная терапия, тканевая инженерия, прямое перепрограммирование клеток
На данный момент фактически единственным методом лечения сахарного диабета I типа является аллогенная трансплантация поджелудочной железы или изолированных островков Лангерганса. До недавнего времени последним прорывом в этой области была разработка Эдмонтоновского протокола в 2000 году. Использование этого протокола, составленного Shapiro et al., позволяет снизить иммунную реакцию и улучшить уровень выживаемости пересаженных островков. Основными ограничениями данного вида терапии продолжают оставаться необходимость длительной иммуносупрессии и острый недостаток донорского материала.
Над преодолением этих ограничений работает группа ученых Токийского Университета под руководством Nakauchi и Hirabayashi. В январе 2017 года в журнале Nature была опубликована статья, показывающая возможность межвидового органогенеза поджелудочной железы.
С помощью методов редактирования генома учеными были получены крысы с мутацией в гене Pdx1, круциального для развития поджелудочной железы. Для дальнейшей работы были выбраны две группы гетерозиготных животных: со стоп-кодонами на 28 и 30 аминокислотах. Полученные от них гомозиготные мутантные крысы обладали апанкреатическим фенотипом и погибали на 3-ий день после рождения. Возможность использования гомозиготных бластоцист для дальнейших исследований была показана введением в них эмбриональных стволовых клеток от крыс дикого типа. Клетки были окрашены EGFP. Результатом стало развитие здоровой поджелудочной железы, полностью образованной из донорских ЭСк.
Для создания межвидовых химер, меченые EGFP индуцированные плюрипотентные или эмбриональные стволовые клетки мышей дикого типа инъецировали в бластоцисты, полученные при скрещивании гетерозиготных мутантных крыс. В результате, в группе с инъекцией ИПСК, животные с генотипом Pdx1mu/mu составляли 10% потомства, а в группе с инъекцией ЭСк 20%. Макроскопические исследования показали, что формирующиеся поджелудочные железы соответствовали размерам желез крыс дикого типа. Были проведены тесты толерантности к глюкозе. Хотя ответ химерных животных был медленнее, в итоге концентрация глюкозы постепенно возвращалась к нормальному уровню.
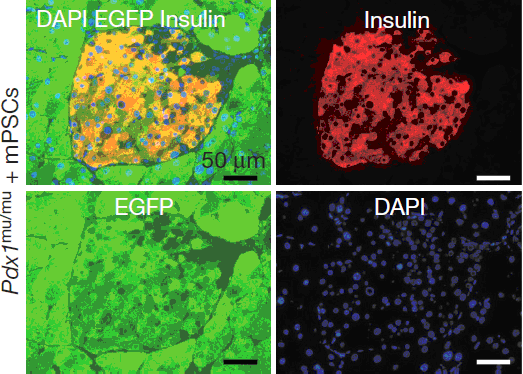 |
Рис.1
Создание поджелудочной железы мыши в крысе, с помощью межвидового дополнения бластоцисты. Иммунофлуоресцентное представление островка Лангерганса. (Pdx1mu/mu c мышиными ИПСк).
Для изучения терапевтического потенциала выращенного межвидового органа, выделенные островки Лангерганса были инъецированы мышам с индуцированным стрептозотоциновым диабетом. Мыши реципиенты были сингенны животным, которые служили донорами плюрипотентных клеток. Было выделено порядка 600 островков, гомогенно экспрессирующих EGFP. Флуоресцентный сортинг суспензии из отдельных клеток, однако, показал, что существенная часть окружающих тканей, включая клетки эндотелия, имеет крысиное происхождение. Соответственно, для предотвращения отторжения трансплантата, в течение пяти дней после инъецирования применялась иммуносупрессирующая терапия. Каждой мыши с индуцированным диабетом под капсулу почки было единовременно подсажено 100 островков.
Животные, участвовавшие в эксперименте, поддерживали нормальный уровень глюкозы в течение 370 дней после трансплантации, без необходимости проведения дальнейшей иммуносупрессии. После удаления почки, под капсулу которой проводилась трансплантация, уровень глюкозы в крови животных существенно повышался. Это подтверждает, что пересаженные островки играли роль в обеспечении нормогликемии.
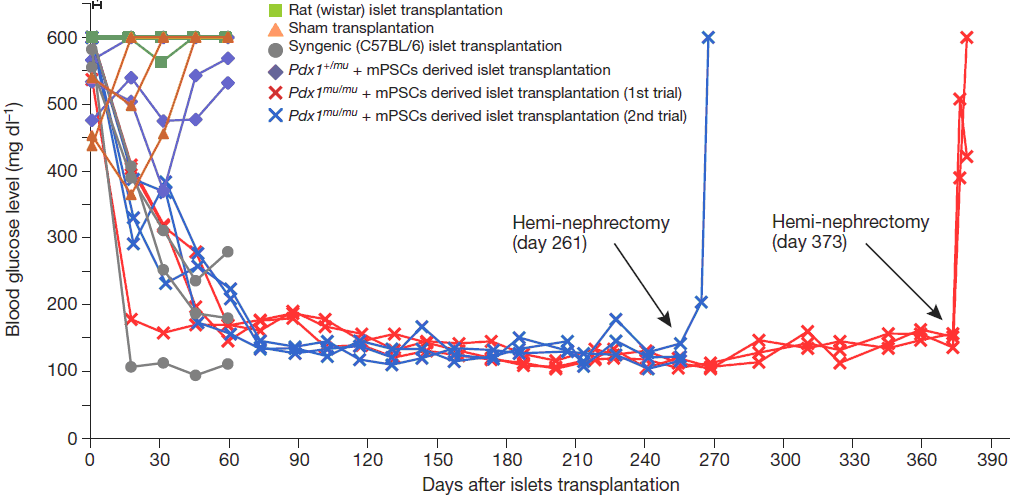 |
Рис.2
Концентрация глюкозы в крови животных при трансплантации островков Лангерганса из межвидовой поджелудочной железы мышам со стрептозотоциновым диабетом.
Таким образом, авторы показывают функциональность поджелудочной железы, полученной с помощью межвидового дополнения бластоцист. Выделенные из такой поджелудочной железы островки Лангерганса позволяют нормализовать уровень глюкозы у сингенных мышей со стрептозотоциновой моделью диабета в течение продолжительного времени без иммуносупрессии.
Основные ограничения трансплантации островков Лангерганса: недостаток донорского материала, сложность долговременного поддержания нормального уровня глюкозы, побочные эффекты иммуносуперссии, могут быть преодолены, в теории, с помощью создания поджелудочной железы из пациент-специфичных ИПСк. Нерешенными остаются вопросы, связанные с контаминацией донорского материала остаточными клетками от другого вида. В исследовании, однако, такого замечено не было. Вероятно, пятидневный режим иммуносупрессии позволил уничтожить донорские (крысиные) клетки, без запуска острого иммунного ответа.
Выводы, полученные в обеих работах, не только имеют фундаментальную ценность, проясняя происходящие события на ключевых этапах мейоза, но и могут помочь в понимании причин нарушений образования половых клеток, вызывающих бесплодие и генетические патологии плода и у людей, поскольку происходящие события эволюционно достаточно консервативны.
При рассмотрении возможности клинического применения, разумеется, будут необходимы исследования на животных эволюционно или габаритно более близких человеку: овцах, свиньях или приматах. Также, безусловно, потребуется сравнение островковых клеток полученных описанным выше образом, с клетками полученными, например, методами тканевой инженерии и/или прямым перепрограммированием. В любом случае, такое исследование открывает дорогу новому способу исследования внешних и внутренних факторов, влияющих на регуляцию развития органа в норме и при патологиях.
Новость подготовил © 20.02.2017 Борисов М.А.