 © Дашинимаев Эрдем Баирович
научный сотрудник лаборатории клеточной биологии, кандидат биологических наук.
© Дашинимаев Эрдем Баирович
научный сотрудник лаборатории клеточной биологии, кандидат биологических наук.
После революционных работ Синъе Яманаки 2006-2007г. по репрограммированию соматических клеток в плюрипотентное состояние, и последовавшем за ними «цунами» научных работ (более 10 000 публикаций в одном только 2012 году), изучавших это явление вдоль и поперек, могло показаться, что изучать в этой области уже нечего. Однако это не так. Ведь подавляющее большинство исследователей работали на моделях in vitro, когда культуры клеток находятся в искусственной, «не природной» среде, поэтому многие интересные моменты, связанные с феноменом клеточного репрограммирования in vivo, для нас все еще скрыты.
25 ноября 2016 г в журнале Science была опубликована статья группы исследователей под руководством Serrano M, выполненная в Spanish National Cancer Research Centre, в Мадриде, Испания. В рассматриваемой работе использована любопытная модель – трансгенные мыши (i4F) c введенной полицистронной кассетой, содержащей все четыре фактора Яманаки: Oct4, Sox2, Klf4, c-Myc, под диоксициклиновым промотером с регулируемой экспрессией (M.Abad et al. Nature 2013). При добавлении в питьевую воду диоксициклина, в клетках этих мышей начинают экспрессироваться репрограммирующие факторы, что приводит в итоге к массовому появлению в организме животного тератом – злокачественных опухолей, происходящих от индуцированных in vivo плюрипотентных стволовых клеток. Исследователи решили проверить роль генов - опухолевых супрессоров p53 и Ink4a/Arf локуса в этом процессе, поскольку эти два гена являются наиболее изученными в связи с репрограммированием in vitro. Хорошо известно, что их инактивация или нокаут увеличивают эффективность репрограммирования клеток в плюрипотентные стволовые клетки in vitro.
Скрещивая i4F мышей с другими, нокаутными по гену p53 и Ink4a/Arf локусу, авторам статьи удалось получить потомство, в котором одновременно с введенным i4F трансгеном отсутствовал либо p53, либо Ink4a/Arf. Согласно представлениям, полученным из экспериментов in vitro, оба этих варианта должны были увеличивать эффективность образования тератом. Однако (!) оказалось, что нокаут Ink4a/Arf наоборот, успешно репрессировал образование тератом, в отличие от нокаута p53, который ожидаемо повысил эффективность репрограммирования (Рис.1А). Анализ содержания плюрипотентных клеток (NANOG+) в разных тканях также показал, что в мышах нокаутных по Ink4a/Arf ингибируется процесс репрограммирования (Рис.1С).
Авторы предположили, что данный феномен связан с ингибированием процесса клеточного старения (т.к. экспрессия Ink4a/Arf необходима для «правильного» старения клеток) и невозможностью образования корректной клеточной ниши для репрограммирующихся клеток. Известно, что стареющие клетки помимо остановки пролиферации и изменения фенотипа, также начинают секретировать ряд характерных цитокинов, в основном связываемых с воспалительными процессами. Чтобы подтвердить эту гипотезу, исследователи провели ряд экспериментов с ингибированием (использовали вещество Navitoclax) и стимулированием (использовали вещество Palbociclib) процесса клеточного старения, которые вызвали понижение и повышение эффективности репрограммирования соответственно. Ингибирование NFkB - ключевого фактора продукции цитокинов, понизило эффективность репрограммирования, что подтвердило гипотезу об именно цитокиновом воздействии ниши. После анализа списка цитокинов, выделяющихся стареющими клетками, авторы пришли к выводу о том, что интерлейкин-6 (IL-6) является ключевым фактором исследуемого феномена. Блокирование IL-6 и его эффектора PIM-киназы, показали ожидаемые результаты в уменьшении эффективности репрограммирования.
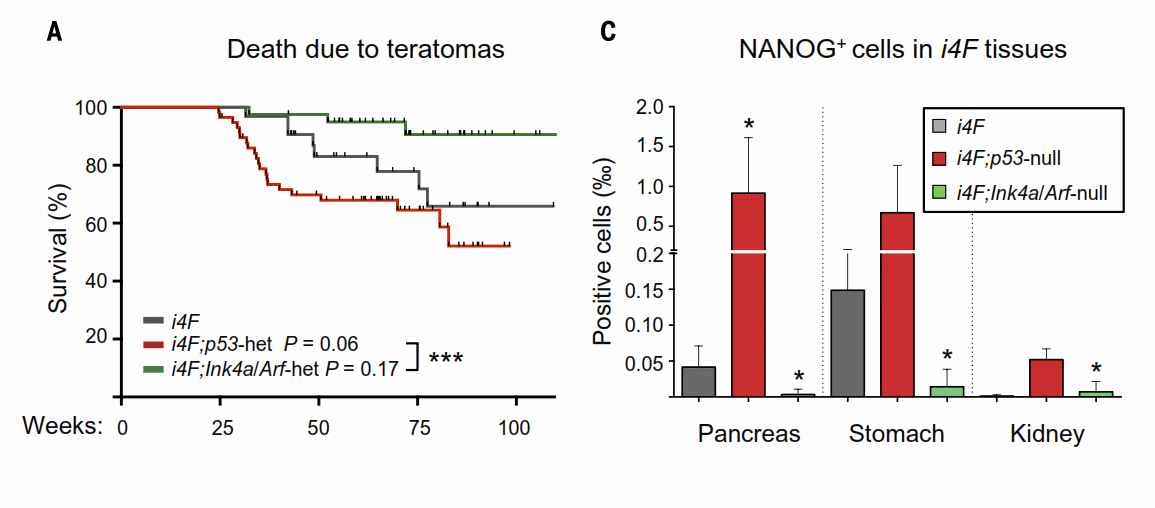 |
Рис.1.
А – Образование тератом в различных мышиных линиях. i4F – исходная линия с индуцируемой кассетой OSKM; i4F,p53-het – линия с дополнительным нокаутом p53; i4F, Ink4a/Arf – линия с дополнительным нокаутом Ink4a/Arf.
C – Доля плюрипотентных клеток NANOG+, в тканях в различных мышиных линиях.
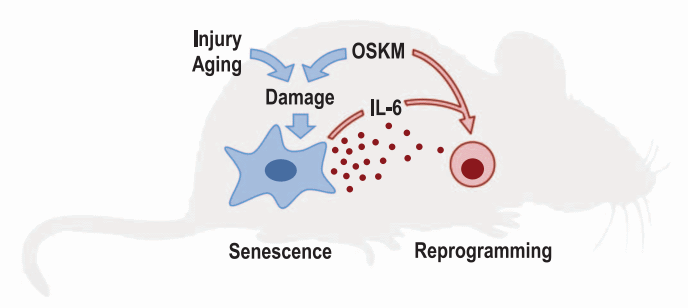 |
Рис.2. Повреждение и старение тканей ведет к стимуляции репрограммирования, по пути секреции цитокинов, в частности IL-6.
Таким образом, авторы делают вывод о том, что эктопическая экспрессия репрограммирующих факторов OSKM в клетках in vivo, приводит к двум разнонаправленным эффектам: репрограммирование в плюрипотентные клетки (малая доля клеток) и повреждение с последующим клеточным старением (бОльшая доля клеток). Данные процессы находятся в тесной взаимосвязи, выражающейся в образовании клеточной ниши из стареющих клеток, позитивно воздействующих на репрограммирование соседних клеток при помощи секреции цитокинов, ключевым фактором из которых является IL-6 (Рис.2). Учитывая все вышесказанное, можно предположить, что данный эффект возможно является частью природного физиологического механизма «рекрутинга» стволовых клеток, когда в ответ на повреждение ткани происходит дедифференцировка и активация тканевых стволовых клеток для последующей репарации. Также, что немаловажно, возможно данный эффект может отчасти объяснять механизм злокачественного перерождения клеток, под воздействием воспалительных факторов. Если рассматривать ситуацию в этом ключе, данную работу можно считать логичным продолжением статьи Darren J с соавт. (Darren J.et al. «Naturally occurring p16Ink4a-positive cells shorten healthy lifespan» Nature 530, 184–189) разбор которой был опубликован на сайте ИБР РАН в апреле 2016 года. Напомню, что в упоминаемой работе исследователи получили достоверное уменьшение случаев злокачественных опухолей у мышей, из организма которых своевременно удалялись все стареющие клетки.
К каким практическим выводам могут привести все эти результаты? Во-первых, появится еще один пул методов увеличения эффективности репрограммирования и дедифференцировки клеток in vitro, что немаловажно, т.к. это бурно развивающаяся область клеточных технологий в регенеративной биомедицине. Во-вторых, это еще один шаг к пониманию механизмов репарации и регенерации тканей взрослого организма, который может привести к появлению новых методов стимуляции данных процессов. В-третьих, возможно появление новых методик лечения и предупреждения онкологических заболеваний. Значение всех этих выводов невозможно переоценить, также, как и ценность рассматриваемой статьи.
Новость подготовил © 2016 Дашинимаев Э.Б.
19.12.2016