Направленное редактирование метилирования ДНК позволило получить жизнеспособное партеногенетическое потомство у мышей


© Ермаков Александр Сергеевич, с.н.с. кафедры эмбриологии МГУ им. М.В. Ломоносова
Область научных интересов: морфогенез, генетика развития, регенеративная медицина.
© Никишин Денис Александрович, к.б.н., доцент кафедры эмбриологии МГУ им. М.В. Ломоносова, с.н.с. лаборатории проблем регенерации (группа эмбриофизиологии) ИБР РАН.
Область научных интересов: раннее эмбриональное развитие, оогенез, нейробиология развития.
Возможность получать партеногенетическое потомство имеет большие перспективы для исследований и практических разработок в сельском хозяйстве и медицине. Группе ученых из Китайской Народной Республики удалось получить жизнеспособное потомство из неоплодотворенного ооцита млекопитающего (мышь) без участия самца. Авторы использовали методы эпигенетического редактирования хромосомного материала, имитировав типичные «отцовские» паттерны метилирования на одной из хромосом, оставив при этом «материнские» на альтернативной хромосоме.
Партеногенез – явление, в результате которого потомство появляется из женских гамет, без оплодотворения. Получение млекопитающих с помощью партеногенеза – чрезвычайно сложная задача в связи с тем, что для их раннего развития необходимо участие отцовского генома. Для нормального развития эмбриона млекопитающего необходима тонкая координация в работе материнского и отцовского геномов, осуществляющаяся в результате геномного импринтинга. Во время гаметогенеза, как в мужских, так и в женских половых клетках, происходит зависимое от пола метилирование участков ДНК, определяющее экспрессию множества генов, в зависимости от материнского или отцовского происхождения. В данном процессе ключевую роль играют участки контроля импринтинга ICR (imprinting control regions), влияющие на экспрессию сразу нескольких генов в своем кластере. Так, при нормальном оплодотворении участки ICR H19 и Gtl2 метилированы на отцовских хромосомах и деметилированы на материнских, тогда как Igf2r, Snrpn, Kcnq1ot1, Peg10 и Nespas – наоборот, метилированы только на хромосомах, доставшихся от матери. При партеногенезе оба набора хромосом зародыша происходят от одной женской половой клетки и все ICR метилированы по материнскому типу, что приводит к дисбалансу экспрессии генов и аномальному развитию. Янчхан Вей из Школы Медицины Университета Цзяо Тун (Шанхай), Цхай Жун-Ян из Шанхайского Центра Репродукции и Репродуктивной Генетики (Шанхай) и Чжен Ао Чжао из Института Зоологии АН КНР (Пекин) использовали системы на основе метода редактирования генома CRISPR-Cas для эпигенетического изменения статуса метилирования хромосом ооцитов мыши и получения партеногенетических зародышей. Для того, чтобы иметь возможность изменять только один набор хромосом в диплоидном GV-ооците, авторы использовали гибридных самок B6CASTF1, полученных при скрещивании мышей C57BL/6 и CAST. Геномы этих линий имеют довольно много различий в сайтах однонуклеотидного полиморфизма (SNP, single nucleotide polymorphism), в том числе в участках ICR. Это позволило китайским исследователям создать генетические конструкции для направленного изменения эпигенетического статуса отцовских сайтов ICR H19 и Gtl2 на хромосомах, унаследованных только от одной родительской линии (Рис. 1). В GV-ооциты вводили мРНК мутантного каталитически неактивного белка dCas9, сшитого с ДНК-метилтрансферазой Dnmt3a, и гидовые РНК (gRNA) для сайтов двух отцовских ICR, специфичные только одной из двух родительских линий – C57BL/6 или CAST. Таким образом, в ооците происходило метилирование участков ICR только одной хромосомы, которая приобретала статус отцовской. Модифицированные ооциты были стимулированы к партеногенетическому развитию – после первого деления созревания выделившееся первое редукционное тельце микроинъецировали в обработанные цитохалазином MII ооциты и искусственно активировали к развитию обработкой ионами Sr2+. Полученные партеногенетические зиготы, которые отделили два вторых редукционных тельца и сформировали 2 пронуклеуса, культивировали in vitro до стадии бластоцисты, после чего подсаживали в матку псевдобеременных мышей. Анализ полученных бластоцист методом бисульфитного секвенирования подтвердил, что участки ICR H19 и Gtl2 метилированы только в одной из двух хромосом, следовательно эпигенетическая модификация эффективна и стабильна в течение доимплантационного развития. Тем не менее, ни один из подсаженных эмбрионов не дожил до рождения, прекратив развитие до 12,5 дня внутриутробного развития. Дальнейший анализ установил, что в модифицированных эмбрионах сохраняется аномальный уровень экспрессии генов, подконтрольных материнским ICR.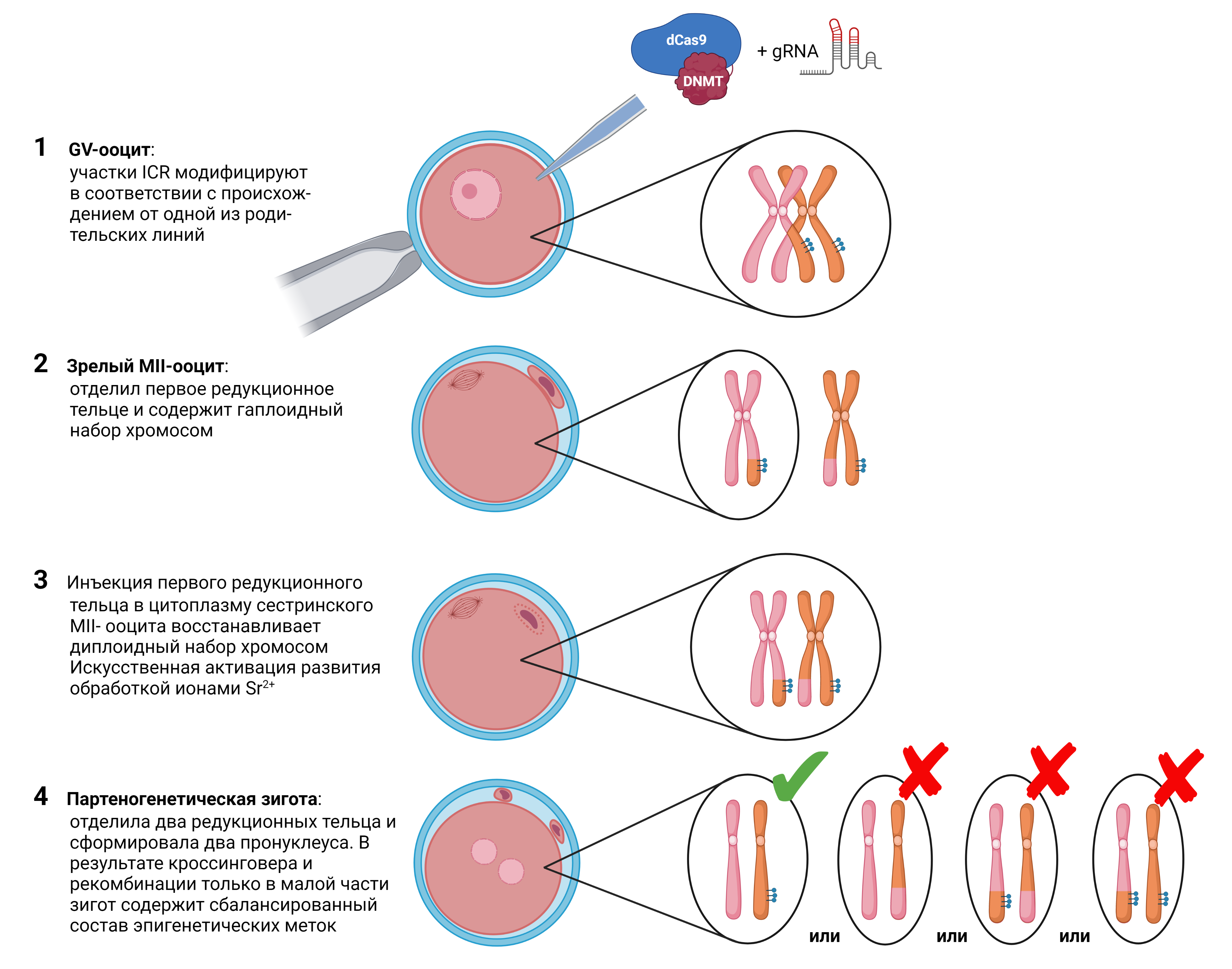
Рис. 1. Методический подход, примененный в статье. В GV-ооцит инъецировали мРНК каталитически неактивного белка dCas9, сшитого с ДНК-метилтрансферазой, и гидовые РНК (gRNA) для сайтов ICR, специфичные только одной из двух родительских линий. Первое редукционное тельце инъецировали в MII-ооцит и активировали его к развитию. Модификация проходила только в половине хромосом, но в результате кроссинговера, только малая часть партеногенетических зигот имела сбалансированный по метилированию набор хромосом.
Очевидно, исправления метилирования двух отцовских кластеров ICR недостаточно для нормального развития, поэтому авторы дополнили протокол еще одной системой редактирования – мРНК инактивированного белка dCpf1, сшитого с белком Tet1, осуществляющего деметилирование ДНК, в комбинации с гидовыми РНК для пяти материнских ICR (Igf2r, Snrpn, Kcnq1ot1, Nespas, и Peg10), специфичных для одной из двух родительских линий. В результате в ооците произошло метилирование двух отцовских и деметилирование пяти материнских ICR, причем в каждой паре гомологичных хромосом модификация произошла только в одной из них, что подтверждают результаты бисульфитного секвенирования. Эффективность данного подхода оказалась существенно выше предыдущего (Рис. 2), и из 389 модифицированных ооцитов до стадии бластоцисты развились 192 эмбриона, а до перинатальных сроков развилось 3 партеногенетических мышонка, один из которых выжил и достиг половозрелости. Эта партеногенетическая самка, в отличие от погибших сиблингов, родилась без отставания в весе, имела правильный паттерн метилирования во всех семи ICR и впоследствии дала собственное потомство. Однако, отставание в весе наблюдалось у нее на постнатальных сроках развития. Авторы предположили, что это может быть связано с оставшимся немодифицированным еще одним отцовским ICR Rasgrf1, контролирующим секрецию гормона роста. Дополнительный эксперимент, в котором аналогичным образом модифицировали уже 8 участков ICR завершился рождением 2 партеногенетических мышат нормального веса, которые достигли взрослого возраста.
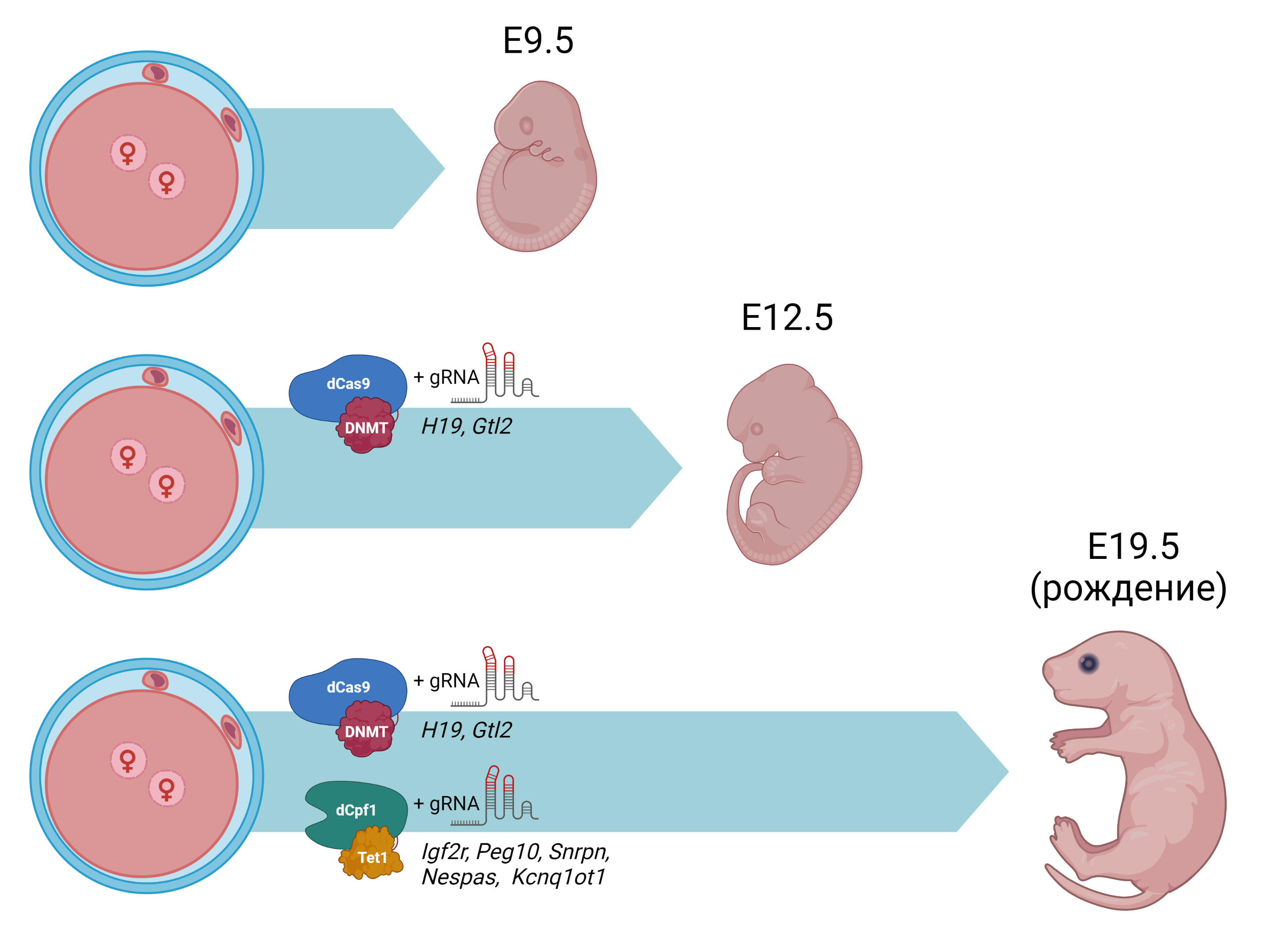
Рис. 2. Схема результатов модификации нескольких ICR. Партеногенетические эмбрионы мыши без модификации могут развиваться только до срока Е9.5. Модифицированные партеногенетические эмбрионы с двумя отцовскими ICR (H19 и Gtl2), метилированными в одном из аллелей, могут развиваться до срока E12.5. Модифицированные партеногенетические эмбрионы с двумя отцовскими ICR (H19 и Gtl2), метилированными в одном из аллелей, и пятью материнскими ICR (Snrpn, Igf2r, Kcnq1ot1, Peg10 и Nespas), деметилированными в одном из аллелей, могут развиваться до рождения.
Несмотря на успешное получение партеногенетических особей, авторы сами указывают на недостаток примененного подхода, который заключается в очень низкой эффективности, недостаточной для какого-либо практического применения. Одной из причин могут быть многочисленные ICR, оставшиеся немодифицированными, которые могут быть необходимы для нормального развития. Однако, даже в случае успешной модификации исчерпывающего набора ICR, остается самый существенный недостаток метода, не позволяющий предотвратить высокую вероятность разбалансировки геномного импринтинга вследствие кроссинговера (Рис. 1). Дело в том, что в GV-ооцитах только небольшая часть хромосом остается отцовской или материнской, тогда как остальные частично рекомбинируют. Соответственно, при расхождении хромосом во время мейотических делений, модифицированные метки распределяются не в соответствии с принадлежностью к разным предковым линиям (как это было бы в отсутствие кроссинговера), а в значительной степени случайным образом. По всей видимости, это и является причиной неполного набора модификаций, наблюдаемого у подавляющего большинства полученных в работе эмбрионов. Несмотря на это, авторам удалось применить оригинальный методический подход и разработать эффективный протокол эпигенетического редактирования ДНК ооцитов, который в дальнейшем может быть применен в других исследованиях. При этом для успешного решения проблемы партеногенеза млекопитающих, по всей видимости, необходимо применять иные подходы.
Новость представили ©Ермаков А.С. и Никишин Д.А.
19.09.2022