Sierra-Fonseca J.A., Bracamontes C., Saldecke J., Das S., Roychowdhury S. Activation of β- and α2-adrenergic receptors stimulate tubulin polymerization and promote the association of Gβγ with microtubules in cultured NIH3T3 cells. Biochem Biophys Res Commun. 2018 Sep 3; 503(1):102-108. doi: 10.1016/j.bbrc.2018.05.188.
 © Шмуклер Юрий Борисович, ведущий научный сотрудник лаборатории ПРОБЛЕМ РЕГЕНЕРАЦИИ.
© Шмуклер Юрий Борисович, ведущий научный сотрудник лаборатории ПРОБЛЕМ РЕГЕНЕРАЦИИ.Доктор биологических наук.
Как раньше все было просто на схемах сигнальных путей нейротрансмиттерных рецепторов: рецептор - G-белок и последующее взаимодействие с аденилатциклазой и протеинкиназой А. Ныне же картина внутриклеточной передачи сигнала от G-белок связанных рецепторов неизмеримо усложнилась.
Гетеротримерные G-белки являются одним из ключевых элементов в передаче сигналов от рецепторов клеточной поверхности (G protein-coupled receptors, GPCRs) к внутриклеточным эффекторным молекулам. Гетеротример G белка, состоящий из связывающей гуанин-нуклеотид α-субъединицы и субъединицы βγ, неактивен, но связывание агониста с GPCRs запускает в G-белке структурные перестройки, так что внутриклеточный домен катализирует обмен нуклеотида в α-субъединице. В результате активированная субъединица Gα диссоциирует с Gβγ, и, таким образом, они обе оказываются способными принимать участие в регуляции внутриклеточных эффекторных молекул.
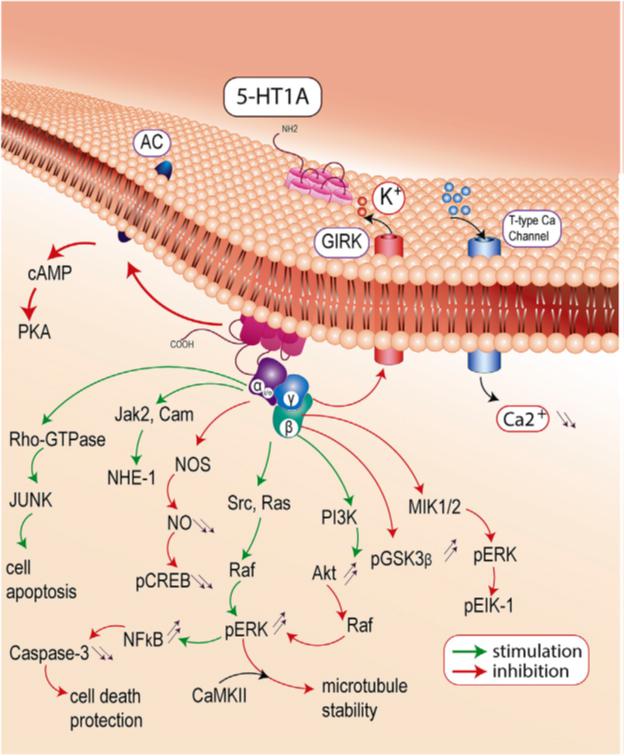
Наряду α-субъединицей G-белка, активирующей аденилатциклазу или фосфолипазу С, самостоятельными эффектами обладает и субъединица βγ. Первая обнаруженная в литературе по этому вопросу работа (Logothetis et al., 1987) показала, что βγ-, а не α-субъединицы ответственны за активацию мускариновых калиевых каналов в клетках предсердия куриного зародыша. Мишенями субъединиц βγ, оказались также белки SNARE-комплекса (Yim et al., 2018), в частности, серотонинергический механизм с участием Gβγ-субъединицы, опосредующий регуляцию слияния синаптических пузырьков с клеточной мембраной (Photowala et al., 2006).
Хотя G-белки, взаимодействующие с рецепторами, являются мембранно-связанными, данные из различных лабораторий в последнее время дают основание предполагать, что субъединицы G-белка могут связываться и с элементами цитоскелета, которые в ходе, например, дифференцировки нейронов претерпевают быструю перестройку. В процессе формирования аксона микротрубочки (MTs) выстраиваются в параллельные селективно стабилизированные пучки, а конус роста обогащен актиновыми филаментами (AFs), участвующими в формировании филоподий и ламеллоподий. Координация между MTs и AFs критична для направления роста аксона и продвижения конуса роста.
Впервые влияние субъединиц G-белка на цитоскелет было показано в отношении микротрубочек (MTs): субъединицы Gsα, Gi1α и Gqα ингибировали сборку и активировали динамику MT in vitro (Roychowdhury et al., 1997), при том, что восстановленный гетеротример Gαβγ в отношении модулирования сборки МТ был неактивен (Roychowdhury et al., 2006). Напротив, Gβγ сборку MT активировал [Roychowdhury et al., 1999].
Первая из рассматриваемых в данном комментарии работа Sierra-Fonseca et al., 2018 существенно уточнила знания о механизмах клеточной регуляции и взаимодействия субъединицы Gβγ с тубулиновым цитоскелетом. Известно, что введение агониста β-адренорецепторов изопротеренола приводит к активации в клетках NIH3T3 гетеротримера Gs (Gsαβγ), за которой следует диссоциация субъединиц α и βγ с последующей активацией аденилатциклазы [см. Roychowdhury, Rasenick, 2008; Roychowdhury, Sierra-Fonseca, 2017]. Поскольку β-адренорецепторы активируют Gs-белки, что ведет к повышению уровня цАМФ, а α2-адренорецептор, напротив, активирует Gi белки, в результате чего продукция цАМФ ингибируется, возможное участие в этом процессе α-субъединиц G-белков и цАМФ, а также последующих за ним эффекторов исключено.
В данной работе клетки NIH3T3 обрабатывали 50 μM изопротеренола, а сборку MT оценивали путем определения иммунореактивности тубулина во фракции MT и растворимой фракции тубулина с помощью специфических антител к α-тубулину. В присутствии изопротеренола сборка MT стимулировалась на 37%. Соответственно, иммуноблот анализ с помощью антител к Gβ, показал, что после обработки изопротеренолом ассоциация Gβγ с MTs возрастала на 57%. Повторное исследование блотов с антителами к актину показало отсутствие существенных изменений полимеризации актина в присутствии изопротеренола.
В отличие от изопротеренола агонист α2-адренорецептора UK14,304 также стимулировал сборку MT на 37% и ассоциацию Gβγ с MTs на 74%. Так же, как и в случае с изопротеренолом, отсутствовало воздействие на актиновые филаменты и взаимодействие с ними Gβγ-субъединиц.
Однако, во второй из рассматриваемых работе Sierra-Fonseca et al., 2021 показано, что, помимо MTs, в клетках PC12 под действием фактора роста нервов (NGF) субъединица Gβγ также взаимодействует с актиновыми филаментами, и ее координированные взаимодействия с двумя основными элементами цитоскелета критичны для роста аксонов и дифференцировки. Хотя известно, что NGF вызывает свой эффект через рецептор тирозин киназы TrkA, авторы предполагают возможное участие в этом процессе GPCRs.
В работе, используя тройное иммунофлуоресцентное окрашивание, оценивали колокализацию анти-Gβ (зеленое окрашивание) с антителами к актину (голубое) и с антителами к тубулину (красное) в дифференцированных NGF клетках PC12.
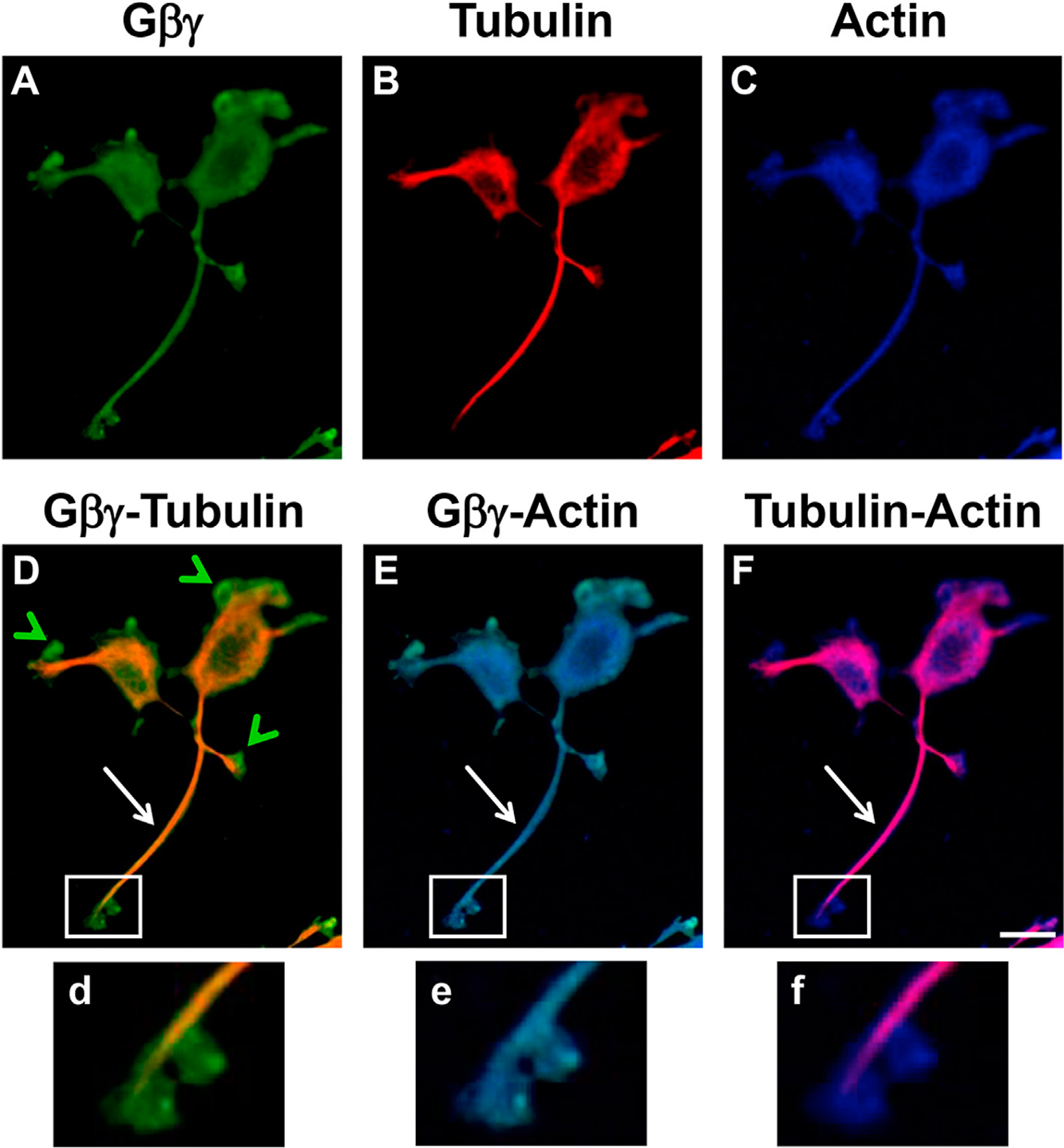
В обработанных NGF клетках Gβγ обнаруживаются вдоль отростков нейрона, где они колокализуются со структурами, содержащими актин и тубулин (фрагменты D-F на рисунке вверху). Важно, что окончания этих аксонов демонстрируют низкое иммуноокрашивание тубулина, и в дистальных окончаниях Gβγ колокализуется только с актином.
Взаимодействие Gβγ-актин в цитоскелетной фракции существенно увеличивалось с 25 ± 3.3% в контрольных клетках до 52.4 ± 10.1% в присутствии NGF (p < 0.05). Предобработка клеток нокодазолом, деполимеризующим тубулин, не влияла на взаимодействие Gβγ-AF, и полагают, что взаимодействие между актином и Gβγ происходит не через MTs.
Основываясь на результатах данной работы, авторами предложена модель, которая описывает взаимодействие Gβγ с MTs и AFs в ходе роста аксона и его роль в формировании конусов роста. Предполагается, что субъединица Gβγ, которая связывается с тубулином и стимулирует сборку MT, направляет MTs в конус роста и позволяет им взаимодействовать с AFs. Gβγ, которая предпочтительно ассоциируется с MTs, вероятно, в конусе роста взаимодействует исключительно с актиновыми филаментами.
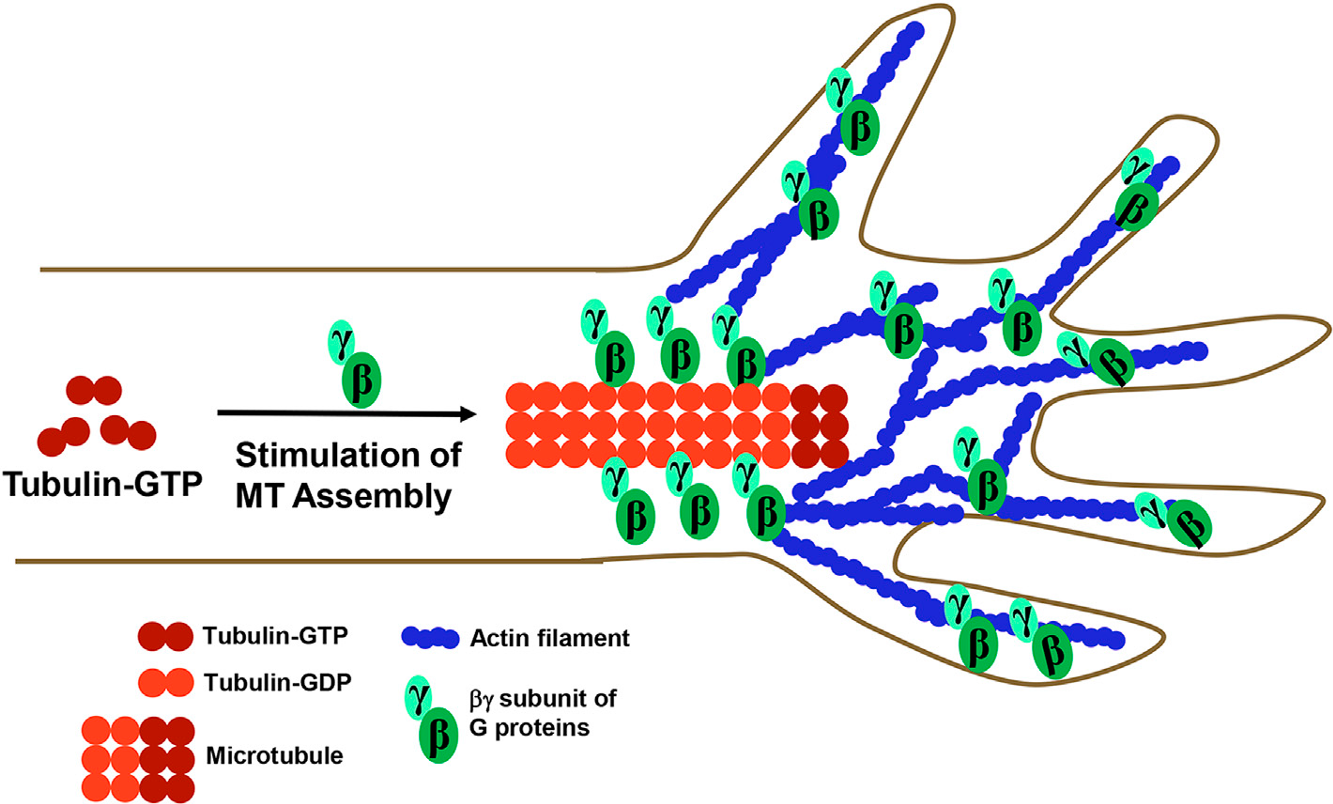
Авторы предположили, что взаимодействие Gβγ и с MTs, и с AFs определяет значение Gβγ как ключевой трансмембранной сигнальной молекулы, которая опосредует таким образом рост аксона, и, можно предположить, другие процессы, реализуемые цитоскелетом.
Сравнительный анализ данных двух рассматриваемых работ ставит важный вопрос: чем объясняется такая существенная разница между эффектами агонистов адренорецепторов и NGF? Поскольку субъединица Gβγ является достаточно неспецифическим сигнальным агентом, в чем-то подобным ионам кальция, который Rasmussen называл «рискованным мессенджером», способным влиять на массу процессов, каким образом при действии адренолигандов они взаимодействуют исключительно с тубулиновым цитоскелетом, а NGF затрагивает и актиновый? Напрашиваются два варианта объяснений. Либо субъединица Gβγ является столь же короткодистантным сигнальным агентом, как и ионы Са2+, при том, что в окончаниях аксонов клеток РС12 сосредоточены исключительно актиновые элементы цитоскелета, а в самом аксоне, напротив, только или в основном – тубулиновые. Тогда решающим фактором становится место локализации GPCR, и, если адренорецепторы отсутствуют в окончаниях аксона, то и присутствующие там актиновые филаменты не затрагиваются. Напротив, предполагаемые авторами рассматриваемых работ GPCR к NGF, очевидно, в соответствии с этой гипотезой, должны быть сосредоточены именно в окончаниях аксона. Альтернативное объяснение может состоять в том, что при действии лигандов различных рецепторов в каждом случае формируются специфические наборы субъединиц в составе Gβγ, разнообразие которых насчитывает 5 Gβ и 12 Gγ (см. Yim et al., 2018).
В любом случае, данные рассмотренных работ могут существенным образом сказаться на трактовке уже известных фактов, касающихся функционирования цитоскелета и его регуляции, и планировании новых экспериментов.
Новость подготовил вед.н.с., д.б.н. © Ю.Б. Шмуклер
19.04.2021