
Область научных интересов: нейроэтология, нейробиология, нейротрансмиттеры, поведение.
Рассеянный склероз (РС) традиционно считается аутоиммунным заболеванием, при котором CD4+ Т-клетки поражают миелин, что приводит к воспалению, вызывающему демиелинизацию и поражение белого вещества по всей нервной системе. РС имеет более высокую распространенность в более холодном климате и в более северных широтах, и такое географическое распространение предполагает влияние фактора окружающей среды (1). Ранние наблюдения за заболеванием указывали на инфекционную причину, например, на отсутствие рассеянного склероза на Фарерских островах к северу от Шотландии до прибытия британских солдат во время Второй мировой войны (2). Есть убедительные доказательства связи вирусов Эпштейна-Барра и герпеса человека-6 (HHV-6) с рассеянным склерозом (3, 4). Независимо от исходного события, аутоиммунное воспаление разрушает миелиновую оболочку , при этом активация микроглии и макрофагов приводит к нейродегенерации при прогрессирующем РС (5). Наследственность РС оценивается в 50% (6,7), а крупномасштабные полногеномные исследования РС выявили множество генетических вариантов в некодирующих областях генов иммунной системы, которые также связаны с другими аутоиммунными заболеваниями (8).
Поскольку аутоиммунитет является предполагаемой патофизиологией рассеянного склероза, разработка методов лечения была сосредоточена на модуляции иммунной системы. Альтернативная патофизиологическая гипотеза заключается в том, что рассеянный склероз в первую очередь или изначально является нейродегенеративным заболеванием, при котором гибель нейронов высвобождает миелин, который, в свою очередь, запускает вторичную аутоиммунную реакцию (9). Таким образом, нейропротекторные стратегии могут действовать выше аутоиммунных механизмов, приводящих к демиелинизации. Независимо от того, какая модель верна, нейропротекторное лечение может быть эффективным против нейродегенерации при прогрессирующем РС и снижать аутоиммунитет за счет уменьшения количества миелина, высвобождаемого умирающими нейронами. Учитывая эту стратегию, воздействие на процессы, которые приводят к гибели нейронов, становится многообещающей перспективой для разработки методов лечения. В частности, нейропротекция против эксайтотоксичности глутамата является потенциальным путем, который может привести к созданию эффективных методов лечения.
Появляется все больше доказательств роли глутамат-опосредованной эксайтотоксичности при РС. Избыток глутамата был обнаружен в мозге и спинномозговой жидкости пациентов с РС (10, 11), а также повышенная активность АМРА [2-амино-3-(3-гидрокси-5-метилизоксазол-4-ил) пропановая кислота], NMDA (N-метил-d-аспартат) и каинатных ионотропных рецепторов глутамата (12). Ингибиторы AMPA и NMDA устраняли неврологический дефицит и снижали уровень воспалительных цитокинов в экспериментальной модели аутоиммунного энцефалита (EAE) на грызунах при РС (13, 14). Белковые взаимодействия с субъединицей GluA2 рецепторов AMPA участвуют в регуляции эксайтотоксической гибели клеток (15), а нарушение этих взаимодействий снижает неврологический дефицит, демиелинизацию и повреждение аксонов у мышей с EAE (16).
Эти данные указывали на ионотропные рецепторы глутамата как на мишень нейропротекции при рассеянном склерозе. Однако, ингибиторы АМРА- и NMDA-рецепторов имеют побочные эффекты из-за повсеместного распространения этих рецепторов в центральной нервной системе (ЦНС) и их критической роли в функционировании мозга (17, 18). К счастью, структура АМРА-рецепторов хорошо изучена, что позволяет детально моделировать на молекулярном уровне сайты связывания потенциальных аллостерических модуляторов функции АМРА, которые могут обеспечивать нейропротекцию, одновременно ограничивая потенциальные нецелевые эффекты. Ранее был идентифицировали сайт связывания за пределами канонического лиганд- связывающего домена внутри субъединицы AMPA GluA2 (15). Этот сайт может иметь решающее значение для регуляции эксайтотоксичности, опосредованной AMPA, и служить потенциальной мишенью для низкомолекулярного лечения рассеянного склероза.
В новой работе (Zhai et al., 2023) сообщается об открытии небольшой молекулы ZCAN262, которая предотвращает эксайтотоксичность, опосредованную АМРА, путем воздействия на аллостерический сайт связывания. Это вещество способствовало ощутимому восстановлению неврологических функций и миелинизации, одновременно снижая иммунный ответ в экспериментальных моделях аутоиммунного энцефалита и купризона на мышах, не влияя при этом на базальную нейротрансмиссию, обучение и память.
Сначала с помощью нейросетевого скрининга in silico нашли небольшие молекулы, которые могут связываться с аллостерическим сайтом связывания GluA2. 50 кандидатов, выявленных в ходе скрининга in silico, были протестированы на способность блокировать глутамат-опосредованную эксайтотоксичность в клетках эмбриональной почки человека (HEK), стабильно экспрессирующих GluA1 и GluA2. Эффективность молекул в предотвращении гибели клеток определяли по кривым концентрации. Были идентифицированы три многообещающих молекулы, каждая из которых основана на необычном пирроло-пиразольном скелете. Все три молекулы-кандидата улучшали неврологические функции у мышей с EAE. Добавление второго фтора к соединению (Рис. 1) дало еще более очевидное улучшение, и это соединение (ZCAN262) было выбрано для дальнейшей характеристики in vivo.
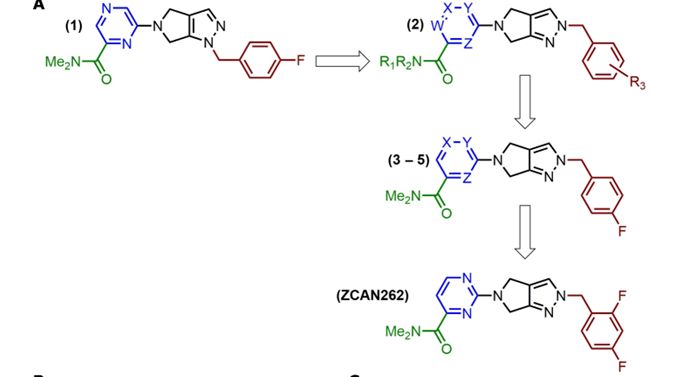
Рис. 1.
Следует отметить, что ни одна модель на животных не отражает всех особенностей рассеянного склероза: ни у одной мыши спонтанно не развивается рассеянный склероз, требуется искусственный индуктор. Поэтому влияние ZCAN262 было проверено на модели, основанной на аутоиммунитете, и на модели с применением нейротоксина, а именно купризона, который является наиболее широко используемой моделью токсина при рассеянном склерозе. Было показано, что ZCAN262 восстанавливает миелинизацию, целостность аксонов и олигодендроцитов в мышиной модели рассеянного склероза на купризоновой диете (Рис.2, Ctr+Veh, контроль, Cup + Veh, токсин купризон, Cup + ZCAN262 купризон на фоне + ZCAN262). Значительные, хотя и менее выраженные эффекты наблюдаются при лечении ZCAN262 по восстановлению количества олигодендроцитов в мозолистом теле мышей, что визуализируется окрашиванием антителами olig2.
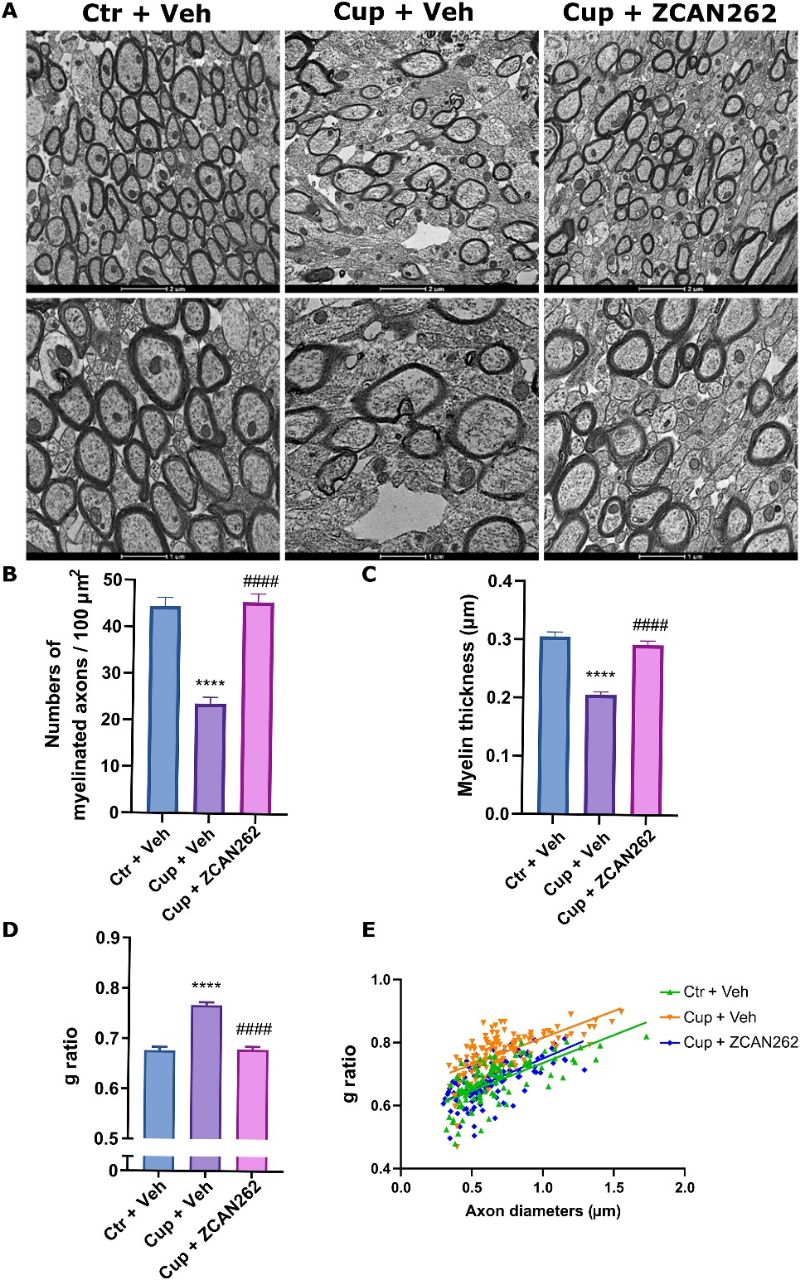
Рис. 2.
Также найдены выраженные терапевтические эффекты в поведении. Был использован довольно широкий спектр неврологических тестов, включая локомоцию в открытом поле и вращающийся стержень.
На последнем этапе была проверена серьезность возможных побочных эффектов, связанных с нарушением функционирования АМРА рецептора. Провели электрофизиологические записи в коллатералях Шаффера гиппокампа, чтобы изучить влияние ZCAN262 на базальную синаптическую передачу и облегчение парных импульсов. В целом, с учетом интенсивности стимула, не было обнаружено никаких доказательств того, что обработка ZCAN262 изменяла базальную синаптическую передачу. Также ZCAN262 не повлиял на память, распознавание или пространственное обучение в поведенческих тестах.
В заключении авторы указывают еще раз на то, что рассеянный склероз остается серьезной терапевтической проблемой, особенно при прогрессирующих формах заболевания, для которых существуют весьма ограниченные методы лечения. Решением может стать переход от иммуномодулирующих препаратов к другой стратегии: сосредоточение внимания на защите нейронов и миелинизированных аксонов. Полученные авторами результаты согласуются с этой идеей. Конечно, они обеспечивают лишь отправную точку для разработки лекарств и, в дополнение к экспериментам, обсуждаемым выше, потребуют значительных инвестиций для сбора основных данных о токсичности, абсорбции, распределении, метаболизме и выведении с одновременным созданием клинически применимых составов, прежде чем можно будет провести клинические испытания на людях. Тем не менее, представленные данные предполагают возможность лечения рассеянного склероза, направленного на АМРА-опосредованную эксайтотоксичность, с помощью низкомолекулярных аллостерических модуляторов.
Список литературы:
- R. A. Marrie, Environmental risk factors in multiple sclerosis aetiology. Lancet Neurol. 3, 709–718 (2004)
- J. F. Kurtzke, A. Heltberg, Multiple sclerosis in the Faroe islands. J. Clin. Epidemiol. 54, 1–22 (2001).
- K. Bjornevik, M. Cortese, B. C. Healy, J. Kuhle, M. J. Mina, Y. Leng, S. J. Elledge, D. W. Niebuhr, A.I. Scher, K. L. Munger, A. Ascherio, Longitudinal analysis reveals high prevalence of Epstein-Barr virus associated with multiple sclerosis. Science 375, 296–301 (2022).
- E. C. Leibovitch, S. Jacobson, Evidence linking HHV-6 with multiple sclerosis: An update. Curr. Opin. Virol. 9, 127–133 (2014).
- M. Torabi, C. Green, N. Yu, R. A. Marrie, Application of three focused cluster detection methods to study geographic variation in the incidence of multiple sclerosis in Manitoba, Canada. Neuroepidemiology 43, 38–48 (2014).
- E. Kamma, W. Lasisi, C. Libner, H. S. Ng, J. R. Plemel, Central nervous system macrophages in progressive multiple sclerosis: Relationship to neurodegeneration and therapeutics. J. Neuroinflammation 19, 45 (2022).
- N. A. Patsopoulos, Genetics of multiple sclerosis: An overview and new directions. Cold Spring Harb. Perspect. Med. 8, (2018).
- S. Sawcer, R. J. M. Franklin, M. Ban, Multiple sclerosis genetics. Lancet Neurol. 13, 700–709 (2014).
- B. D. Trapp, K.-A. Nave, Multiple sclerosis: An immune or neurodegenerative disorder? Neuroepidemiology 31, 247–269 (2008).
- A. Cianfoni, S. Niku, S. G. Imbesi, Metabolite findings in tumefactive demyelinating lesions utilizing short echo time proton magnetic resonance spectroscopy. AJNR Am. J. Neuroradiol. 28, 272–277 (2007).
- P. Sarchielli, L. Greco, A. Floridi, A. Floridi, V. Gallai, Excitatory amino acids and multiple sclerosis: Evidence from cerebrospinal fluid. Arc. Neurol. 60, 1082–1088 (2003).
- J. Newcombe, A. Uddin, R. Dove, B. Patel, L. Turski, Y. Nishizawa, T. Smith, Glutamate re-ceptor expression in multiple sclerosis lesions. Brain Pathol. 18, 52–61 (2008).
- D. Centonze, L. Muzio, S. Rossi, F. Cavasinni, V. D. Chiara, A. Bergami, A. Musella, M. D’Amelio, V. Cavallucci, A. Martorana, A. Bergamaschi, M. T. Cencioni, A. Diamantini, E. Butti, G. Comi, G. Bernardi, F. Cecconi, L. Battistini, R. Furlan, G. Martino, Inflammation triggers synaptic alteration and degeneration in experimental autoimmune encephalo-myelitis. J. Neurosci. 29, 3442–3452 (2009).
- G. Sulkowski, B. Dąbrowska-Bouta, M. Chalimoniuk, L. Strużyńska, Effects of antagonists of glutamate receptors on pro-inflammatory cytokines in the brain cortex of rats subjected to experimental autoimmune encephalomyelitis. J. Neuroimmunol. 261, 67–76 (2013).
- M. Wang, S. Li, H. Zhang, L. Pei, S. Zou, F. J. S. Lee, Y. T. Wang, F. Liu, Direct interaction between GluR2 and GAPDH regulates AMPAR-mediated excitotoxicity. Mol. Brain 5, 13 (2012).
- D. Zhai, F. H. F. Lee, C. D’Souza, P. Su, S. Zhang, Z. Jia, L. Zhang, A. H. C. Wong, F. Liu, Blocking GluR2-GAPDH ameliorates experimental autoimmune encephalomyelitis. Ann. Clin. Transl. Neurol. 2, 388–400 (2015).
- R. Roesler, J. Quevedo, N. Schröder, Is it time to conclude that NMDA antagonists have failed? Lancet Neurol. 2, 13; discussion 13 (2003).
- T. Reuillon, S. E. Ward, P. Beswick. Modulating AMPA receptors for the treatment of CNS disorders, in Comprehensive Medicinal Chemistry III (Elsevier Ltd., 2017), pp. 447–480
Новость подготовила
© В.Е.Дьяконова
18.12.2023