Комментарий к статье: Chen H., Xia K., Huang W., et al. Autologous transplantation of thecal stem cells restores ovarian function in nonhuman primates // Cell Discov. 2021. V. 7.,. № 1. - P. 75. DOI: 10.1038/s41421-021-00291-0
 © Никишин Денис Александрович, к.б.н., доцент кафедры эмбриологии МГУ им. М.В. Ломоносова, с.н.с. лаборатории проблем регенерации (группа эмбриофизиологии) ИБР РАН.
© Никишин Денис Александрович, к.б.н., доцент кафедры эмбриологии МГУ им. М.В. Ломоносова, с.н.с. лаборатории проблем регенерации (группа эмбриофизиологии) ИБР РАН.
Область научных интересов: раннее эмбриональное развитие, оогенез, нейробиология развития.
Преждевременная недостаточность яичников (или синдром истощения яичников), при которой функциональная активность яичников прекращается в возрасте до 40 лет, по современным данным, поражает около 1% женщин. Синдром характеризуется нарушением менструального цикла (гипо- или аменорея) и снижением секреции эстрогенов на фоне повышения концентрации гонадотропных гормонов. Причины этого состояния репродуктивного старения могут быть разными – эндокринными, генетическими, метаболическими, инфекционными, ятрогенными. Учитывая современную тенденцию к увеличению возраста первой беременности, данное заболевание приобретает все большую социальную значимость.
В большинстве экспериментальных моделей преждевременного истощения яичников применяют химическую индукцию для имитации состояния истощения овариального пула, вызванного химиотерапевтическим лечением. В данном методическом подходе крайне важное значение для успеха моделирования имеют дозы и время действия веществ. Кроме того, в зависимости от времени прекращения воздействия, химическое повреждение яичников может спонтанно восстанавливаться у животных. Эти недостатки приводят к вариативности патологических характеристик в этой модели, что ограничивает ее применение для имитации спонтанного преждевременной недостаточности яичников, которое вызвано ускоренным репродуктивным старением. Альтернативным подходом является применение многократных циклов суперовуляции, которые успешно моделируют синдром истощения яичников у грызунов. Среди экспериментальных модельных организмов для изучения женской репродуктивной функции, особое место занимают нечеловекообразные приматы, занимающие близкое к человеку филогенетическое положение. Схожесть их репродуктивных органов и циклов с человеческими делает их идеальной моделью для изучения старения и дисфункции яичника. Макаки-крабоеды (Macaca fascicularis), в лабораторной практике называемые циномолгусами, имеют очень схожие с человеческими генетические и физиологические свойства женской репродуктивной системы, в том числе схожий менструальный цикл и паттерны секреции половых гормонов.
При использовании макак в экспериментах по редактированию генома было обнаружено, что последовательные циклы суперовуляции у самок-доноров ооцитов приводят к появлению признаков преждевременной недостаточности яичников. Уровни гормонов, пул фолликулов и функция яичников у этих обезьян изменяется аналогично патологическим характеристикам пациенток с клиническим синдромом истощения яичников. Это обеспечило авторов статьи удобной моделью для изучения синдрома и позволило с их помощью исследовать эффективность клеточных подходов для возможной терапии.
На сегодняшний день основным подходом к лечению остается заместительная гормональная терапия. Она компенсирует сопутствующие риски, связанные с гипоэстрогенией, однако повышает риск тромбоза и рака, а также имеет незначительную эффективность для восстановления фертильности. Клеточная терапия в отношении преждевременной недостаточности яичника имеет большой терапевтический потенциал. Для восстановления функции яичника в экспериментах на мышах применяли самые разнообразные стволовые клетки от мезенхимных стволовых клеток (МСК) мыши до стволовых клеток менструальной крови человека. В большинстве случаев происходила нормализация гормонального уровня, возобновление фолликулогенеза, восстановление полового цикла, однако терапия слабо влияла на репродуктивный потенциал. Более эффективным терапевтическим подходом в экспериментах по химическому моделированию истощения яичников крыс оказалось применение стволовых клеток стромы яичника. Это свидетельствует о более высоком терапевтическом потенциале резидентных стволовых клеток яичника.
В этом отношении большой интерес вызывают текальные стволовые клетки (TSC), являющиеся предшественниками клеток теки – важного соматического компонента яичника, обеспечивающего поддержку фолликулогенеза и синтез андрогенов. У женщин с преждевременной недостаточностью яичников снижен уровень андростендиона и инсулин-подобного белка 3, продуцируемыми клетками теки. В то же время, при синдроме поликистозных яичников наоборот наблюдается патологический рост фолликулов и гиперпролиферация клеток теки. Таким образом, есть взаимосвязь между функциональной активностью клеток теки и репродуктивным потенциалом яичника.
TSC выделены из стромы яичников свиней, овец, людей, но пока не применялись в доклинических исследованиях с целью репарации овариальной функции in vivo. Авторы данной статьи впервые выделили и охарактеризовали TSC макак-циномолгусов, и показали, что их аутотрансплантация частично восстанавливает проявления преждевременной недостаточности яичника.
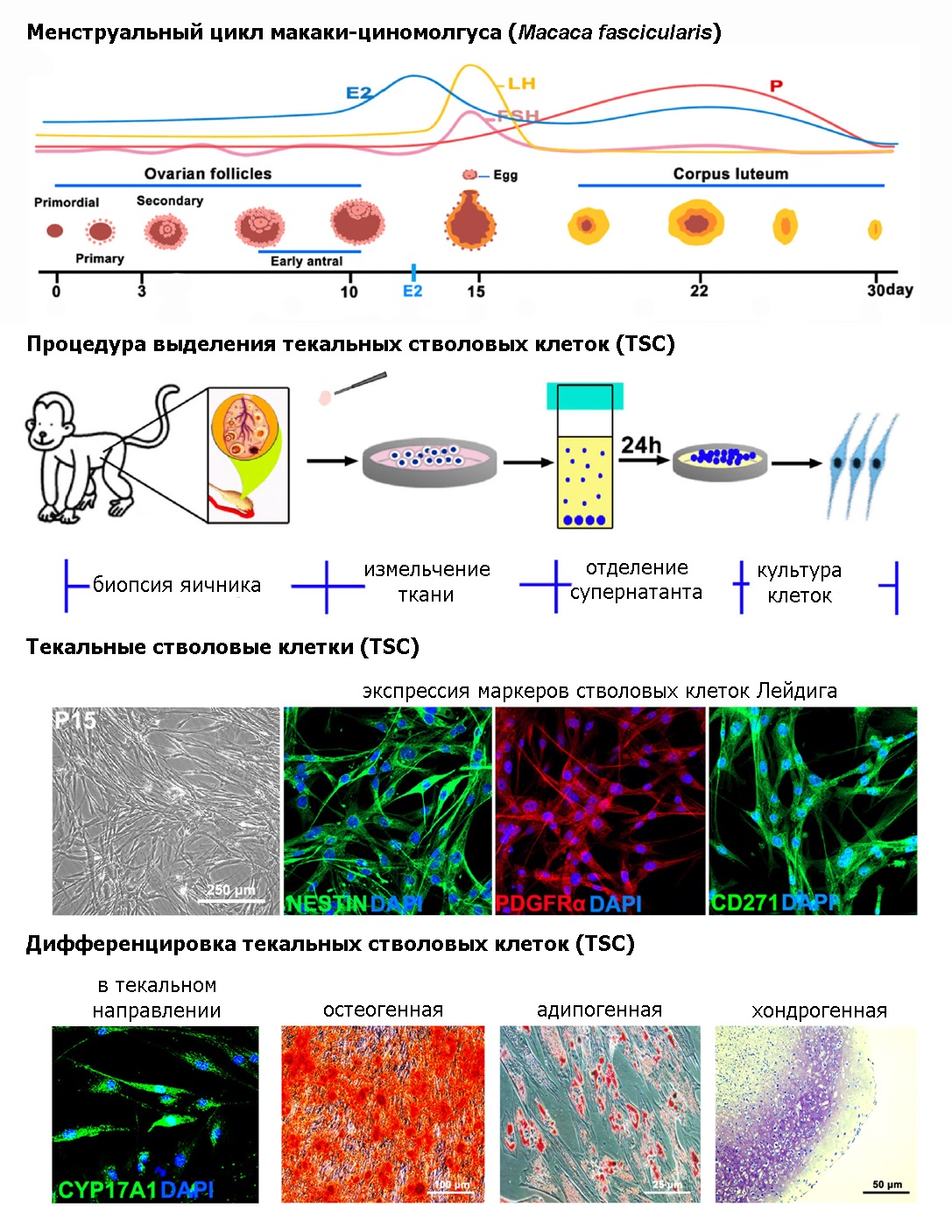
Опубликованные ранее протоколы выделения TSC из целых яичников, по понятным причинам, невозможно применить для аутотрансплантационной терапии. В данной работе, прежде всего, авторы разработали эффективный метод выделения TSC из небольшого фрагмента коркового слоя яичника циномолгусов, используя для этого неферментативный протокол механической изоляции, позволяющий получить в три раза больше колониеобразующих единиц стромальных клеток. Клетки наращивали в культуре до большого количества, достаточного для трансплантации (более 100 млрд. клеток к 10 пассажу). Полученные TSC в течение по крайней мере 15 пассажей сохраняли нормальный кариотип и способность к адипо-, остео- и хондрогенной дифференцировке. Клетки экспрессировали маркеры NESTIN, CD271 и PDGFRα, характерные для стволовых клеток Лейдига и, по всей видимости, являющиеся также маркерами TSC. Транскриптомный анализ полученных культур и иммуногистохимическая верификация, продемонстрировали, что клетки экспрессируют мезенхимальные маркеры VIMENTIN, NG2, PDGFRβ и не экспрессируют маркеры ооцитов (SCYP3, ZP3), клеток гранулезы (NTF4, FSHR) и клеток эндотелия (CD31, CDH5). При сокультивировании TSC с клетками гранулезы в среде с индукторами дифференцировки, они в течение 10 дней дифференцируются в зрелые клетки теки. Полученные клетки экспрессируют текальные маркеры CYP11A1, CYP17A1, StAR, 3β-HSD, SF1 и LHR и продуцируют дегидроэпиандростерон и андростендион.
Для тестирования клеточных подходов к терапии преждевременной недостаточности яичника использовали самок после нескольких циклов суперовуляции, у которых наблюдается существенное снижение эстрадиола и антимюллеровского гормона (AMH), а уровень фолликулостимулирующего гормона (ФСГ) повышен. У таких самок описаны значительное снижение количества антральных фолликулов, нарушения менструального цикла и ранняя менопауза. TSC выделяли из фрагмента яичника таких самок, культивировали и использовали для исследования репаративного потенциала в экспериментах по аутотрансплантации. Ввиду того, что TSC демонстрируют характеристики мезенхимных стромальных клеток, в качестве контроля в экспериментах по трансплантации использовали МСК жировой ткани (ADSC). После трансплантации TSC, в крови самок увеличивалось содержание эстрадиола, AMH, ингибина B и прогестерона, а содержание ФСГ снижалось. Кроме того, в яичнике активировался фолликулогенез, и значительно увеличивалось количество антральных фолликулов. Важно, что при длительном наблюдении после трансплантации TSC у животных не наблюдалось иммунного отторжения или опухолей. В экспериментах по суперовуляции и искусственному оплодотворению, у самок, которым ввели TSC, увеличивались показатели качества ооцитов – возрастали доля морфологически нормальных зрелых ооцитов, процент оплодотворения и развития до стадии бластоцисты.
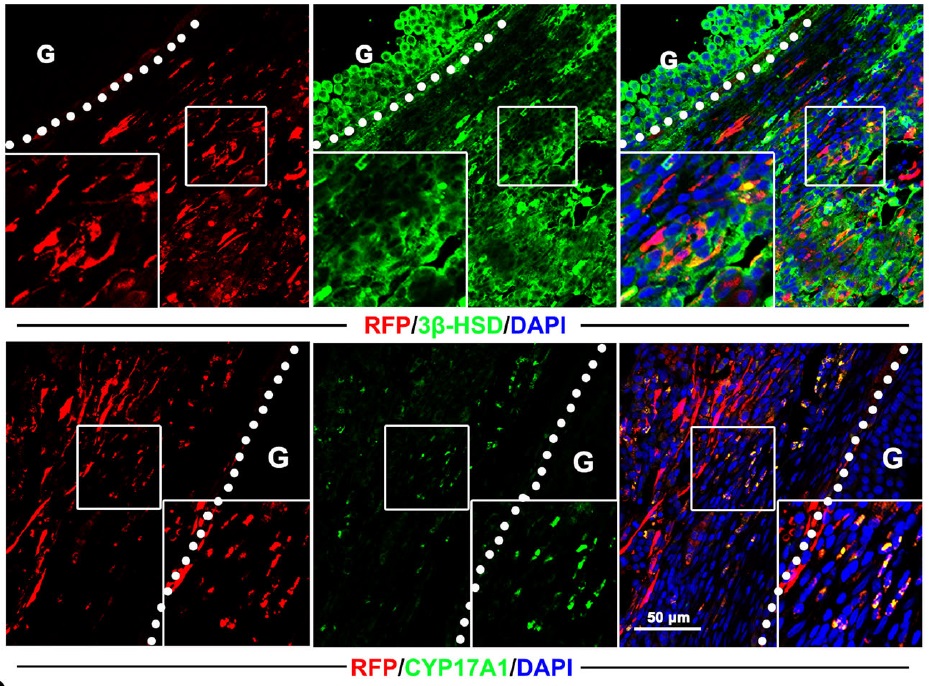
Морфологический анализ распределения введенных TSC предварительно были генетически мечены красным флуоресцентным белком. После трансплантации, в отличие от случайно расселившихся ADSC, большинство клеток теки, происходящих из донорских TSC, оказывались в составе растущего фолликула. Однако лишь небольшая часть флуоресцентно меченых клеток окрашивалась на текальные маркеры CYP11A1, 3β-HSD и CYP17A1. Кроме того, после овуляции потомки трансплантированных клеток занимали в желтом теле краевое положение, что соответствует нормальной дифференцировке клеток теки в малые лютеоциты. Таким образом, аутотрансплантация TSC потенциально может не только восстановить оогенез в истощенном яичнике, но и в последующем влиять позитивно на поддержание беременности. Тем не менее, данные результаты оставляют открытым вопрос о механизме наблюдаемых репаративных эффектов. Рекрутинг клеток теки из стромы яичника зависит от активности растущего овариального фолликула – именно поэтому потомки TSC, в отличие от ADSC, оказывались в составе растущего доминантного фолликула. При этом в эксперименте только небольшая часть потомков трансплантированных TSC оказывалась в составе текальных оболочек и экспрессировала маркеры клеток теки. По всей видимости, основной вклад в реактивацию функции яичника вносит общий стимулирующий эффект, наблюдаемый и при трансплантации других типов стволовых клеток в аналогичных экспериментах.
Резюмируя все вышесказанное, можно заключить, что аутотрансплантация TSC способствует восстановлению нормального уровня гормонов и реактивации развития фолликулов у обезьян с преждевременной недостаточностью яичников и является потенциальным средством восстановления фертильности при синдроме истощения яичников. Данные результаты представляют большой научный интерес, демонстрируя важную роль резидентных TSC в восстановлении функции яичника и перспективы их клинического применения. В то же время, описанная модель преждевременной недостаточности яичников у макак-циномолгусов имеет большие перспективы для оценки эффективности клеточной терапии для лечения женского бесплодия.
Новость подготовил © Никишин Д.А.
18.10.2021