 © Риппа Александра Леонидовна, кандидат биологических наук, научный сотрудник лаборатории клеточной биологии ИБР им. Н.К. Кольцова РАН,
© Риппа Александра Леонидовна, кандидат биологических наук, научный сотрудник лаборатории клеточной биологии ИБР им. Н.К. Кольцова РАН,
Область научных интересов: биология кожи, ранозаживление, клеточная пластичность, механизмы клеточной пролиферации и дифференцировки
Острое заживление ран в коже включает в себя взаимодействие нескольких типов клеток для координации репарации дермы и эпидермиса. Многие исследования были сосредоточены на взаимодействии между клетками крови, кератиноцитами и фибробластами во время заживления кожных ран, однако возможная роль других типов клеток, таких как дермальные адипоциты, во время этого процесса не изучалась.
Ранее в работе Schmidt и Horsley было показано, что клетки адипоцитарной линии активируются и функционируют во время заживления острой кожной раны. Авторы обнаружили, что клетки-предшественники адипоцитов пролиферируют, а зрелые адипоциты вновь заселяют кожные раны после фазы воспаления параллельно с миграцией фибробластов (Schmidt, Horsley 2013). В недавней работе Franz и соавторов на дрозофиле было показано, что клетки жирового тела (эквивалент адипоцитов у насекомого) активно мигрируют в эпидермальную рану и способствуют ранозаживлению (Franz et al., 2018).
Зрелые адипоциты накапливают жирные кислоты и являются распространенным компонентом стромы тканей, например костного мозга, кожи, мышц и молочных желез. До настоящего времени было мало данных о роли липидов, производимых адипоцитами, в гомеостазе и репарации тканей. Shook и соавторы определили существенную роль липолиза адипоцитов в регуляции фазы воспаления и репарации в заживлении кожной раны. Классически заживление острой кожной раны проходит следующие фазы: гемостаз (формирование фибринового сгустка), воспаление (инфильтрация иммунных клеток), формирование новой ткани (ангиогенез, реэпителизация) и реконструкция (осаждение коллагена мигрирующими фибробластами).
Авторы получили линию мышей, у которых с помощью индуцируемой Cre-рекомбиназы можно удалять адипоциты кожи. Чтобы проверить, является ли заживление раны дефектным в коже без зрелых адипоцитов, авторы исследовали воспалительную фазу ранозаживления у мышей с адипоцитами и без. Удаление кожных адипоцитов до нанесения раны привело к снижению количества макрофагов на 65% в ранах через 1,5-суток после ранения (рисунки 1В и 1С). Однако, при этом удаление адипоцитов не влияло на количество или активацию других иммунных клеток. Сокращенное количество макрофагов в раневом ложе сохранялось в ранах без адипоцитов кожи через 3 дня после травмы (рис. 1D).
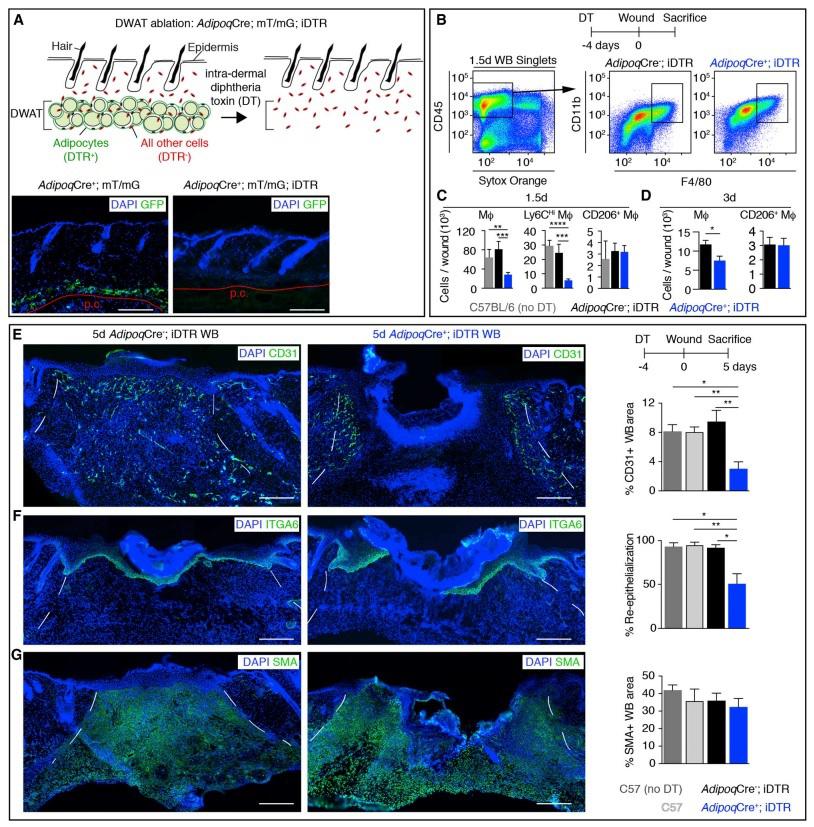
Рисунок 1.
(A) Схематическое изображение удаления адипоцитов и изображение с иммуноокрашиванием GFP неповрежденной кожи.
(B – D) Графики проточной цитометрии (B) и количественное определение макрофагов через 1,5 дня (C) и 3 дня (D) после повреждения.
(E – G) изображения раны, иммунофлуорисценция и количественное определение (E ) CD31 (реваскуляризация), (F) ITGA6 (реэпителизация) и (G) SMA (репопуляция фибробластов) на 5-й день в раневых ложах (WBs). Пунктирная белая линия очерчивает края раны.
Затем авторы изучили восстановление кожи путем анализа пролиферативной фазы заживления. Удаление дермальных адипоцитов приводило к снижению реваскуляризации на 66% и реэпителизации на 50% в ранах на 5 день после нанесения ран без видимых изменений в репопуляции фибробластами или контракции раны (Рисунки1E-1G). Задержка реваскуляризации и реэпителизации в ранах кожи без адипоцитов восстанавливалась через 7 дней после травмы, что совпадает по времени с моментом, когда макрофаги удаляются во время фазы воспаления при заживлении ран. Эти данные предполагают, что кожные адипоциты необходимы для эффективной активации воспалительной реакции, которая влияет на эффективность на ранних стадиях ранозаживления.
С помощью окрашивания перилипином 1 (PLIN1) авторы обнаружили, что травма стимулирует липолиз дермальных адипоцитов и выброс содержимого жировых капель в раневое ложе.
Авторы исследовали, вносит ли вклад липолиз адипоцитов в стадию воспаления при ранозаживлении. Генетическое торможение дермального липолиза адипоцитов перед травмой приводило к снижению общего числа макрофагов и макрофагов, производных моноцитов в ране на 50% в ранах через 1,5 суток после повреждения. При этом через 3 дня после травмы этот эффект нивелировался. Торможение дермального липолиза адипоцитов незначительно влияло на репопуляцию раны фибробластами и реэпителизацию, однако приводило к снижение реваскуляризации на 50% на 5-й день ранозаживления, но на 7 день реваскуляризация приходила в норму.
Подавление липолиза через 2 дня после травмы не вызывало изменений в реваскуляризации ран. Эти данные предполагают, что нарушение липолиза адипоцитов в ране приводит к уменьшению числа макрофагов во время фазы воспаления, а сниженное количество макрофагов в раневых ложах вызывает отсроченную реваскуляризацию.
Чтобы изучить вклад зрелых адипоцитов в ранозаживление кожи на поздних стадиях, авторы произвели генетическое отслеживание адипоцитов (Adipoq-меченные клетки). Полученные данные указывали на то, что зрелые адипоциты после повреждение кожи теряют запасы липидов, что позволяет клеткам мигрировать в ложе раны. Адипоциты на краях раны теряют специфичные маркеры адипоцитов вскоре после повреждения. Происходящие из адипоцитов клетки в раневых ложах являются долгоживущими, но не заполняются липидами.
Авторы сравнили профиль экспрессии генов отслеживаемых по Adipoq клеток с профилем миофибробластов и зрелых адипоцитов. Происходящие из адипоцитов отслеживаемые клетки в ранах были более схожи с миофибробластами. Более глубокий анализ показал, что эти клетки, были обогащены генами, связанными с миофибробластами и заживлением ран, в том числе a-SMA, Acta2 и множественные коллагены. Миофибробласты, образованные из адипоцитов, имели отличительный профиль экспрессии генов, не схожий с профилем экспрессии клеток-предшественников адипоцитов, которые становятся миофибробластами во время репарации раны и другим подмножеством миофибробластов (Shook et al., 2018). Возможно, миофибробласты, образованные из зрелых адипоцитов, имеют уникальную функцию. Эти клетки могут повторно вступать в клеточный цикл в ответ на сигнальные события, индуцированные ранозаживлением.
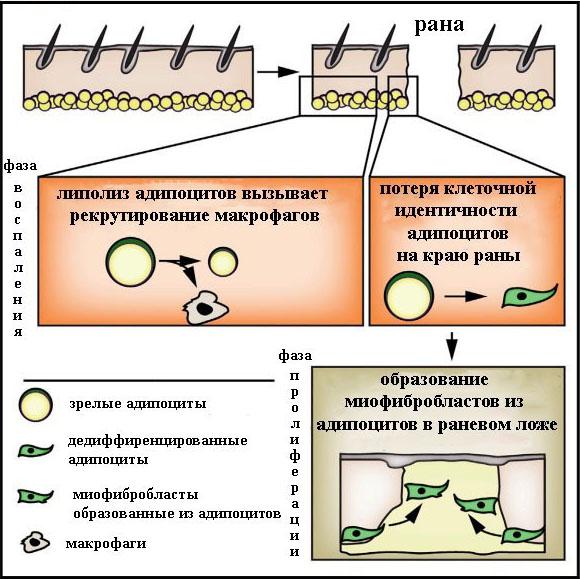
В целом, можно заключить, что после липолиза адипоциты теряют свою адипогенную идентичность и становятся миофибробластами, которые поддерживают восстановление кожи при ранозаживлении путем генерации молекул внеклеточного матрикса.
Стоит отметить, что выводы этой работы были сделаны с учетом данных, полученных на ранах размером 2 мм. Авторы пробовали увеличить размер ран и обнаружили, что Adipoq-меченные клетки не заселяют раневое ложе в ранах большого объема, которые у мыши способствуют формированию волосяных фолликулов и адипоцитов.
Будущие направления исследований, посвященных липолизу адипоцитов и идентичности адипоцитов в условиях воспаления кожи и атрофии жировой ткани, например, при онкогенезе и фиброзе, могут привести к появлению новых перспективных подходов в лечении этих болезней.
1) Schmidt BA, Horsley V. Intradermal adipocytes mediate fibroblast recruitment during skin wound healing. Development. 2013 Apr;140(7):1517-27. doi: 10.1242/dev.087593.
2) Franz A, Wood W, Martin P. Fat Body Cells Are Motile and Actively Migrate to Wounds to Drive Repair and Prevent Infection. Dev Cell. 2018;44(4):460-470.e3. doi: 10.1016/j.devcel.2018.01.026.
3) Shook BA, Wasko RR, Rivera-Gonzalez GC, Salazar-Gatzimas E, López-Giráldez F, Dash BC, Muñoz-Rojas AR, Aultman KD, Zwick RK, Lei V, Arbiser JL, Miller-Jensen K, Clark DA, Hsia HC, Horsley V. Myofibroblast proliferation and heterogeneity are supported by macrophages during skin repair. Science. 2018 Nov 23;362(6417). pii: eaar2971. doi: 10.1126/science.aar2971.
Новость подготовила © Риппа А.Л.
18.05.2020