 © Шевелева Ольга Николаевна, к.б.н., н.с. лаборатории Клеточных и молекулярных основ гистогенеза
© Шевелева Ольга Николаевна, к.б.н., н.с. лаборатории Клеточных и молекулярных основ гистогенеза
Научные интересы: клеточная биология, гемопоэтические стволовые клетки, внеклеточные везикулы, клетки-супрессоры миелоидного происхождения (МДСК), макрофаги, индуцированные плюрипотентные стволовые клетки

© Шевалье Дмитрий Александрович, ст. лаборант, аспирант лаборатории Клеточных и молекулярных основ гистогенеза
Научные интересы: кроветворение, иммунология, первичный иммунитет
Известно, что гемопоэтические стволовые клетки возникают у позвоночных в третью, дефинитивную, волну гемопоэза и образуются из гемогенного эндотелия в результате эндотелиально-кроветворного перехода (Lange et al., 2021). Новый всплеск интереса к гемопоэзу в последние годы и применение методов анализа на уровне единичных клеток привели к появлению множества экспериментальных доказательств гетерогенности гемопоэтических стволовых и прогениторных клеток (ГСПК) (Eaves et al., 2015, Haas et al., 2018, Zhang et al., 2022). Вопрос о том, когда и на какой стадии дифференцировки возникает эта гетерогенность и насколько она обусловлена внутриклеточной или внеклеточной регуляцией, остается в настоящее время открытым. Одно из возможных предположений заключается в том, что гетерогенность ГСПК обусловлена гетерогенностью гемогенного эндотелия, из которого они образуются. В работе Xia и соавторов, 2023 года, с помощью современных экспериментальных подходов (scRNA-seq, scATAC-seq и др.) в комбинации с функциональными анализами показано, что ГСПК в пренатальном развитии Danio rerio происходят из гетерогенных клеток гемогенного эндотелия (ГЭ). При этом клетки ГЭ, экспрессирующие транскрипционный фактор spi2 (или его гомолог SPI1 у млекопитающих), дают праймированные в лимфоидном и миелоидном направлении ГСПК (Л/М-ГСПК) (см.рис 1).
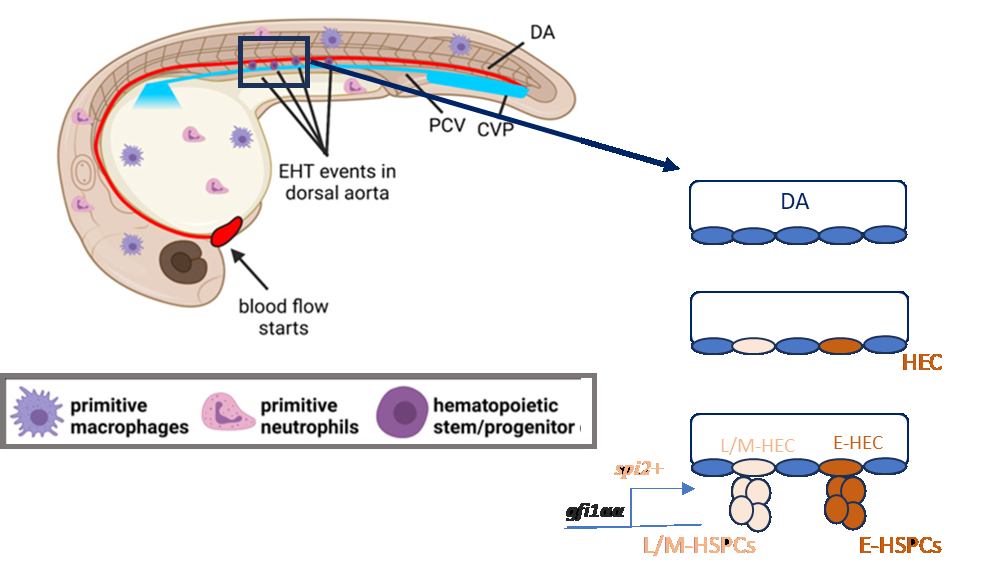
Рис. 1. Гетерогенность гемопоэтических стволовых и прогениторных клеток обусловлена гемогенным эндотелием. EHT-эндотелиально-гемопоэтический переход в клетках дорсальной аорты. CVP – хвостовое венозное сплетение. PCV – задняя кардиальная вена. HEC – клетки гемогенного эндотелия. DA – дорсальная аорта. HSPC – гемопоэтические стволовые и прогениторные клетки (в основе рисунка лежит фрагмент рисунка из статьи Sugden, North «Making Blood from the Vessel: Extrinsic and Environmental Cues Guiding the Endothelial-to-Hematopoietic Transition», Life (Basel). 2021, 11(10): 1027. doi: 10.3390/life11101027)
На первом этапе авторы провели исследования на трансгенной линии Danio rerio – Tg (kdrl:mCherry/runx1:enGFP), которая позволяет визуализировать и отсортировать эндотелиальные клетки (kdrl+runx1–), клетки ГЭ (kdrl+runx1+) и гемопоэтические клетки (kdrl–runx1+) в области аорто-гонадо-мезонефроса (АГМ) (рис 2А). Проведя транскриптомной анализ (scRNA-seq) и анализ доступности хроматина (scATAC-seq) на уровне единичных клеток, авторы обнаружили существенную неоднородность зарождающихся ГСПК в области АГМ (рис 2Б). При этом в клетках ГЭ подтипа «pre-ГЭ» наблюдается высокая экспрессия pecam1, характерная для эндотелия сосудов, и генов, экспрессирующих белки, участвующие в пролиферации и процессах метаболизма ДНК; клетки подтипа L/M-ГЭ (клетки ГЭ с лимфоид-миелоидной направленностью) показали экспрессию «лимфоидных» и «миелоидных» генов (например, coro1a и snrpg), а «эритроидные» клетки ГЭ (подтип E-ГЭ, с эритроидной направленностью) высоко экспрессировали гены, связанные с регуляцией процесса биосинтеза гема, дифференцировкой эритроцитов и гены, связанные с биогенезом гемоглобина (gata1 и hbbe2) (рис 2В,Г). Исследуя наиболее заметные мотивы транскрипционных факторов в высоко доступных областях генома, авторы обнаружили мотив SPI, который показал наибольшую доступность, как в ГЭ, так и в Л/М-ГСПК (рис 2 Д). Корреляционный анализ данных RNA-seq и ATAC-seq подтвердил, что spi2 (транскрипционный фактор семейства SPI1) был одним из самых высокоэкспрессированных генов транскрипционных факторов в L/M-ГЭ, но не в E-ГЭ.
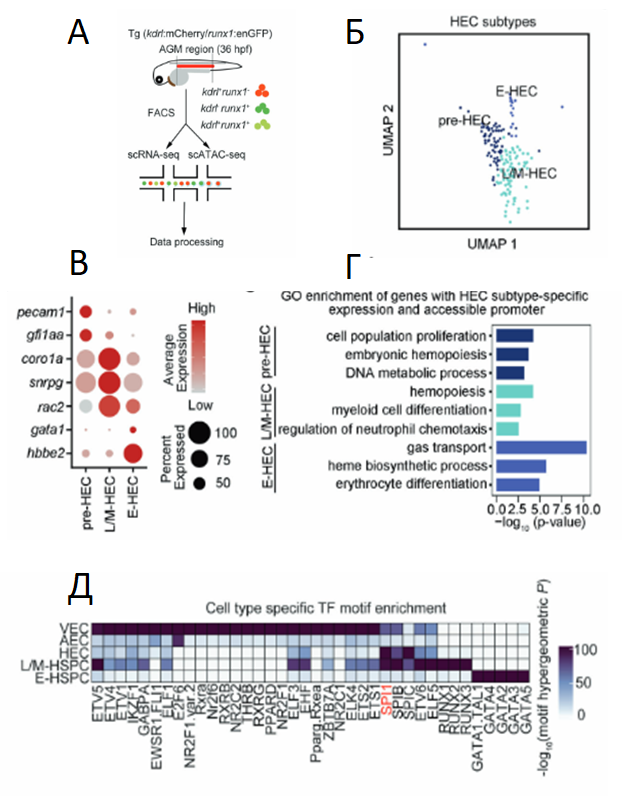
Рис. 2. Транскриптомный и эпигенетический анализ гетерогенности ГЭ и ГСПК. А – схематическое изображение стратегий, используемых для подготовки клеток Danio rerio к scRNA-seq и scATAC-seq. Б – субпопуляции ГЭ, полученные на основе scRNA-seq. В – точечные диаграммы, показывающие среднюю и процентную экспрессию репрезентативных эндотелиальных и гемопоэтических генов в субпопуляциях pre-ГЭ(pre-HEC), L/M-ГЭ(L/M-HEC) и E-ГЭ(E-HEC). Г – основные категории GO для генов с экспрессией, специфичной для разных подтипов ГЭ. Д – тепловая карта, показывающая наиболее выраженные мотивы транскрипционных факторов в различных популяциях ГЭ и ГСПК
С помощью количественной ПЦР, гибридизации нуклеиновых кислот in situ (WMISH), применяемой для визуализации экспрессии генов в тканях, и флуоресцентной гибридизации in situ (FISH) авторы подтвердили экспрессию spi2 в клетках ГЭ. Затем с помощью репортерной линии Tg(spi2:Gal4), созданной с применением CRISPR/Cas9 системы, были визуализированы spi+ клетки в основных кроветворных областях у Danio rerio: вентральной стенке дорсальной аорты (VDA), каудальной кроветворной ткани (CHT), тимусе и почках через 28 часов, 3 дня и 5 дней после оплодотворения, соответственно (рис 3А). При этом методом покадровой визуализации было убедительно показано происхождение spi2:GFP+ ГСПК из клеток дорзальной аорты с помощью эндотелиально-кроветворного перехода (рис 3Б). Удаление spi2+ клеток метронидазолом приводило к почти полному отсутствию spi2+ гемопоэтических клеток в CHT и существенному уменьшению размеров тимусов у эмбрионов (рис 3В, Г). Гибридизация нуклеиновых кислот показала, что у таких эмбрионов происходит снижение количества именно Л/М-ГСПК, но не Э-ГСПК. У полученных авторами spi2–/– мутантов количество клеток ГЭ в дорсальной аорте и количество ГСПК в CHT было значительно снижено (рис 3Д, Е) и существенно подавлена экспрессия в ГЭ и ГСПК миелоидных и лимфоидных, но не эритроидных генов. Все эти данные хорошо согласуются с литературными данными, показывающими, что уровень экспрессии SPI1 у млекопитающих выше в ГСК, праймированных в миелоидном направлении (Chaves et al., 2022). Кроме того, результаты, приведенные в статье, свидетельствуют о том, что образование двух субпопуляций ГСПК («Л/М» и «Э»), по-видимому, регулируются отдельно уже при формировании ГСПК.
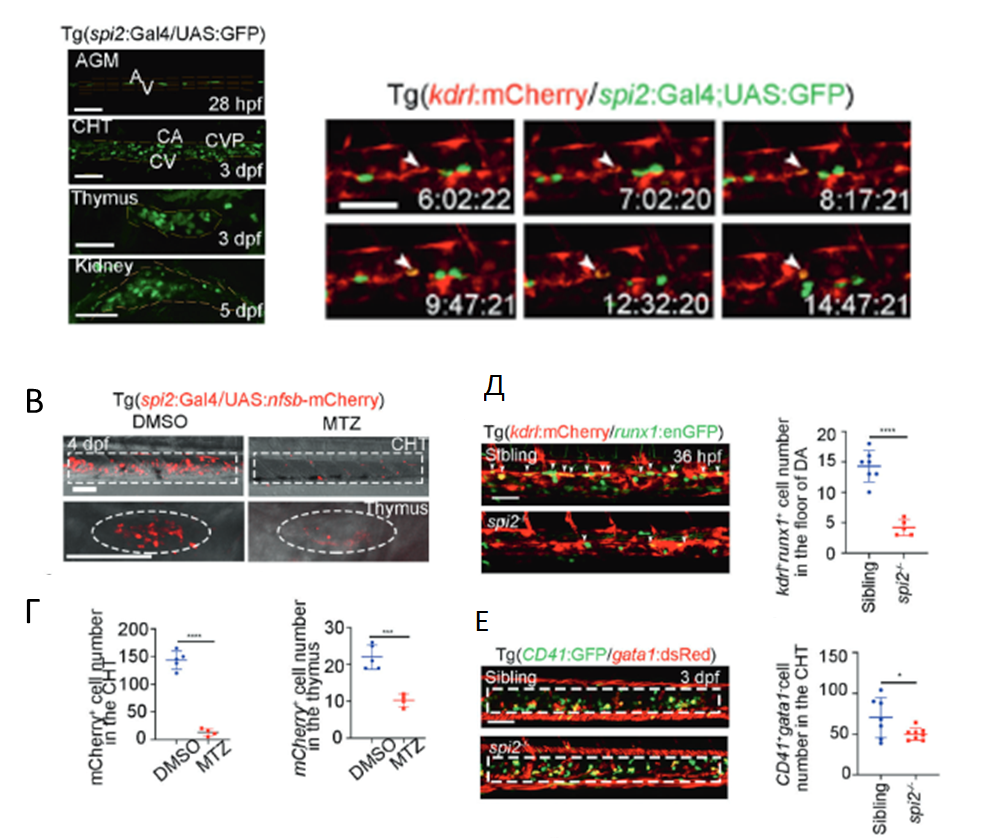
Рис. 3. Отслеживание клонов spi2+ в кроветворных областях Danio rerio и участие spi2 в спецификации Л/М-ГСПК. А- GFP+ клетки в области АГМ, СНТ, тимуса и почек зародышей репортерной линии через 28 часов, 3 дня и 5 дней после оплодотворения. Б – Интервальная визуализация, показывающая образование кроветворных клеток в дорсальной аорте с помощью эндотелиально-кроветворного перехода. В,Г – визуализация (В) и статистические данные (Г), показывающие количество клеток mCherry+ (красные) в CHT и тимусе Tg (spi2: Gal4/UAS: nfsb-mCherry) эмбрионов, обработанных ДМСО и метронидазолом (MTZ). Д – визуализация и статистические данные, показывающие количество клеток ГЭ (kdrl+runx1) в АГМ (стрелки) у spi2–/– эмбрионов. Е – визуализация и статистические данные, показывающие количество ГСПК (CD41+gata1-) в CHT (стрелки) у spi2–/– эмбрионов.
Дальнейший транскриптомный анализ на уровне одиночных клеток ГЭ в контрольных и нокаутных по spi2 эмбрионах показал активацию 232 генов и ингибирование 850 генов в последних. Биоинформатический анализ показал, что у мутантов снижалась экспрессия генов, связанных с кроветворением и регуляцией хемотаксиса нейтрофилов, и повышалась экспрессия генов, связанных с дорсальной аортой (рис 4 А,Б). Используя модификацию ChIP-seq анализа (CUT&Tag), авторы обнаружили, что между генами, связанными с spi2 и демонстрирующими повышенную экспрессию в spi2–/– мутантах, и генами, участвующими в развитии сосудов эндотелия, передаче сигналов Notch, наблюдается существенное перекрытие. Напротив, гены, участвующие в детерминации ГСК и миелоидных клеток были обнаружены в перекрывающихся областях между генами, связанными со spi2, и генами cо сниженной экспрессией в spi2–/– мутантах (рис 4 В). Одним из таких связанных генов с подавленной экспрессией был gfi1αα, гомолог Gfi1, который может восстанавливать нарушения ГСПК у spi2-/- эмбрионов, что доказывает, что он является прямой мишенью spi2 и важен для детерминации ГСПК в ГЭ.
Наконец, авторы доказали, что по аналогии со spi2, его гомолог SPI1 может играть важную роль в формировании ГСПК у млекопитающих. Для SPI1+ клеток ГЭ была характерна экспрессия генов, связанных с функцией гемопоэтических клеток, для SPI1- клеток – генов, связанных с развитием эндотелия (рис 4 Г,Д). На модели получения ГЭ и ГСПК из человеческих индуцированных стволовых клеток (иПСК) обнаружено, что клетки ГЭ и ГСПК экспрессируют более высокие уровни SPI1 по сравнению с эндотелиальными клетками, а нокдаун SPI1 уменьшает количество ГСПК (рис 4Е) и приводит к уменьшению количества образующихся гранулоцитарно-макрофагальных, но не эритроидных колоний (рис 4Ж).
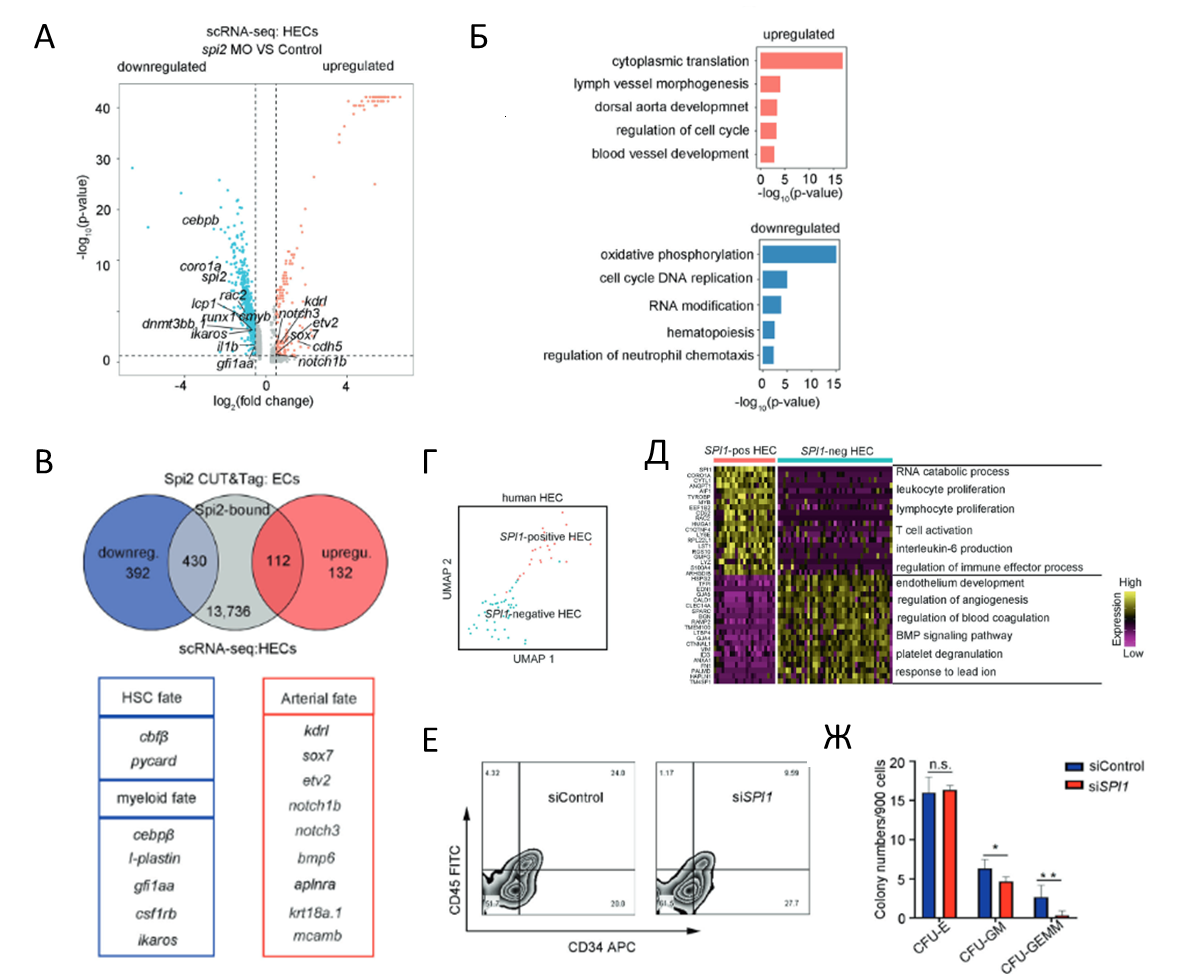
Рис. 4. Spi2 регулирует образование Л/М-ГСПК у Danio rerio и у млекопитающих. А – DEG между клетками ГЭ в транскриптомах одиночных клеток в контроле и spi2-/- мутантах. Б – анализ GO, показывающий группы генов с повышенной и пониженной экспрессией в ГЭ spi2-/- мутантов. В – диаграмма, показывающая перекрытие между генами, связанными со Spi2, и генами с повышенной или пониженной экспрессией. Г– кластеры клеток, экспрессирующих и неэкспрессирующих SPI1 в ГЭ человека, полученные на основе транскриптомного анализа. Д – категории GO, обогащенные в SPI1-положительных и -отрицательных клетках ГЭ соответственно. Е – результаты проточной цитометрии показывающие, что нокдаун SPI1 снижает количество CD34+CD45+ клеток на 12-й день культивирования. Ж – анализ КОЕ, показывающий колониеобразующую способность человеческих ГСПК после обработки siRNA к SPI1.
В целом, приведенные в работе данные представляют большой общебиологический интерес и позволяют по-новому взглянуть на формирование ГСПК из гемогенного эндотелия и на детерминацию судьбы гемопоэтических предшественников. Было бы так же интересно исследовать в дальнейшем и другие транскрипционные факторы, участвующие в дифференцировке гемопоэтических предшественников в разных направлениях, и подробнее изучить дифференцировку клеток эритроидного ряда.
Список литературы:
- Lange L., Morgan M., Schambach A. The hemogenic endothelium: a critical source for the generation of PSC-derived hematopoietic stem and progenitor cells// 2021. Cell Mol Life Sci. 78(9):4143-4160. doi: 10.1007/s00018-021-03777-y
- Eaves C. Hematopoietic stem cells: concepts, definitions, and the new reality//2015. Blood. 125(17):2605-13. doi: 10.1182/blood-2014-12-570200
- Haas S., Trumpp A., Milsom M.D. Causes and Consequences of Hematopoietic Stem Cell Heterogeneity // 2018. Cell Stem Cell.22(5):627638. doi:10.1016/j.stem.2018.04.003
- Zhang P. et al. Single-cell RNA sequencing to track novel perspectives in HSC heterogeneity // 2022. Stem Cell Res Ther. 13(1):39. doi: 10.1186/s13287-022-02718-1
- Chaves J. S. et al. PU.1 Expression Defines Distinct Functional Activities in the Phenotypic HSC Compartment of a Murine Inflammatory Stress Model // 2022. 11(4):680. doi: 10.3390/cells11040680.
Новость подготовили
© Шевелева О.Н. и Шевалье Д.А.
17.07.2023