 © Станислав Кремнев, кандидат биологических наук. Cтарший научный сотрудник, ИБР РАН.
© Станислав Кремнев, кандидат биологических наук. Cтарший научный сотрудник, ИБР РАН.Cтарший научный сотрудник, МГУ им. М.В. Ломоносова, Биологический ф-т, каф. эмбриологии, лаборатория биофизики развития.
Научные интересы: морфогенез, эволюция эмбрионального развития.
Как правило, в большинстве современных научных исследований развитие эмбриона и экстраэмбриональных тканей рассматривают отдельно друг от друга. Даже самые передовые модели изучения раннего эмбриогенеза млекопитающих до последнего времени основывались преимущественно на различных способах культивирования эмбриональных стволовых клеток (ESC) in vitro. Эти системы, к сожалению, не отражают реальные изменения, которые происходят в процессе имплантации эмбриона в матку, что приводит к ограничениям в исследовании механизмов морфогенеза и дифференцировки клеток во время становления первичного плана тела млекопитающих. Исследование группы ученых под руководством Magdalena Zernicka-Goetz показывает, что сокультивирование ESC c экстраэмбриональными стволовыми клетками трофобласта (TSC) может приводить к формированию структур, в которых с удивительным правдоподобием воспроизводится эмбриональный морфогенез, наблюдаемый на стадиях имплантации (Harrison, S.E. et al. 2017). Данный подход открывает широкие возможности для подробного исследования молекулярных процессов, определяющих переход к критическим стадиям развития млекопитающих.
Спецификация эмбриональных тканей происходит в первые дни эмбрионального развития. Эпибласт, из которого формируются все ткани тела, дифференцируется параллельно с трофэктодермой и первичной энтодермой: внезародышевыми тканями, дающими начало плаценте и желточному мешку. В развитии мыши взаимодействие между этими тремя тканями в процессе имплантации, приводит к формированию полостей в эпибласте и трофэктодерме, которые в дальнейшем объединяются, в результате чего формируется зародышевый цилиндр.
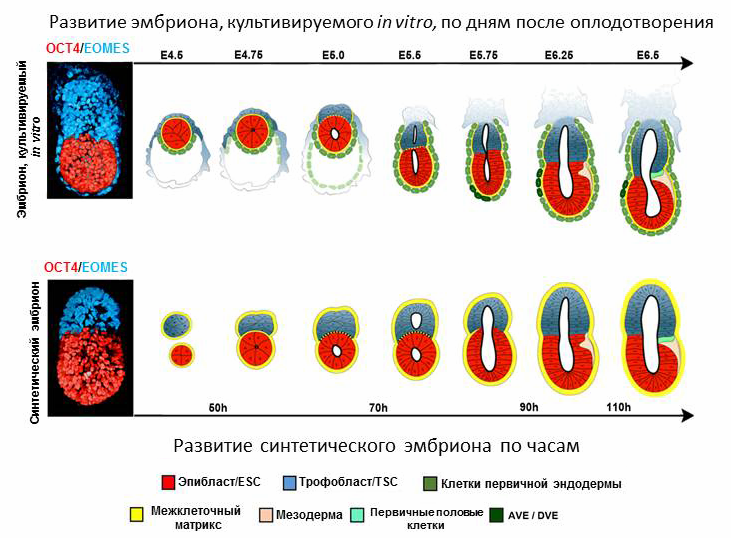
Исследование этих процессов в эмбриогенезе млекопитающих было крайне затруднительным. Во время имплантации, ткани матки окружают эмбрион, скрывая все морфогенетические изменения в архитектуре зародыша и препятствуя их анализу in vivo. Культивирование эмбрионов мыши in vitro, методика которого также была предложена Zernicka-Goetz (Bedzhov et al., 2014), позволило визуализировать клеточные перегруппировки, однако этот метод имеет существенные ограничения в исследовании молекулярно-генетических механизмов этих процессов. С другой стороны, культивирование ESC в органоидах, позволяло приметить все необходимые методики, но никак не отражало процессы, происходящие в зародышевом цилиндре.
Для имитации естественных процессов эмбрионального развития мыши in vitro исследователи сокультивировали ESC и TSC в трехмерном окружении Матригеля. Было показано, что 22% сформировавшихся структур содержали два типа клеток, а 92% из них имели характерную удлинённую цилиндрическую форму постимплатационного эмбриона. Подробное исследование морфологии, размера и количества клеток, а также экспрессии специфических маркеров клеток трофобласта (Eomes) и эмбриональных стволовых клеток (Oct4) выявило компартментализацию производных TSC и ESC. При этом, формирование таких эмбриоподобных структур происходило без участия первичной эндодермы, что подтверждается отсутствием в них экспрессии Gata4.
Первым критическим морфогенетическим событием в постимплатационный период развития является формирование проамниотической полости. В ходе нормального развития наблюдается автономное формирование полостей в каждом из компартментов, после чего они сливаются, образуя общую проамниотическую полость. Было установлено, что полости в нормальном развитии образуются не за счет клеточной гибели, как предполагали раньше, а основным механизмом является сокращение апикальных поверхностей клеток в одну точку и дальнейшее формирование люмена. Для исследования этого процесса в искусственных эмбрионах анализировали динамику и локализацию маркера клеточной адгезии Е-кадгерина, трансмембранного белка Подокаликсина и маркера клеточной полярности aPKC. Установлено, что формирование проамниотической полости полностью повторяет нормальное развитие. В ходе этой работы было сделано важное наблюдение, что формирование полостей начинается именно с ECS компартмента, и уже только после этого полости начинают образовываться в экстраэмбриональном компартменте.
В этой работе впервые удалось подробно исследовать роль Nodal/Activin сигнального пути в постимплатационный период развития. Ученые предположили, что именно ESC продуцирует лиганды этого каскада для поддержания развития TSC компартмента. Основанием для этого послужили известные данные о том, что для отдельно культивируемых клеток TSC среду обязательно дополняют Nodal лигандами, а также результаты полученные в этом исследовании, о том что кавитация в TSC начинается только после начала формирования полостей в ESC. Однако исследование этого сигнального пути в постимплатацинный период с применением нокаутных мышей было затруднено из-за наличия молекул Nodal в половых путях. В первом эксперименте исследователи ингибировали Activin/TGF-beta рецепторы специфическим блокатором SB431542. Оказалось, что в 90% случаев при таком воздействии не происходит образования полостей в TSC компартменте. Для более тонкого исследования Nodal/Activin сигнального пути была сконструирована тамоксимфен-индуцируемая нокаутная линия ESC.
Подобно результатам с применением ингибитора, в искусственных эмбрионах с Nodal-/-ESC клетками не наблюдалось формирование полостей в экстраэмбриональном компартменте. Аналогичные результаты были получены с эмбрионами культивируемыми in vitro в присутствии SB431542. В ходе этой части работы были не только получены важные результаты о ведущей роли ESC в развитии экстраэмбрионального компатртмента, но также были продемонстрированы преимущества разработанной модели.
Далее сотрудники лаборатории Zernicka-Goetz задались вопросом о том, насколько точно воспроизводится регионализация зародышевых листков в искусственных эмбрионах. Для этого были использованы методики с применением репортерных клеточных линий ESC. Исследователи сконструировали линию T:GFP, которая позволила детектировать паттерн экспрессии мезодермального маркера T/Brahyury. Оказалось, что в искусственных эмбрионах ген Т экспрессируется ассиметрично, что полностью соответствует паттерну экспрессии в нормальном развитии. Более того, удалось показать, что такой ассиметричный паттерн является следствием взаимодействия ESC и TSC, так как в клеточных конгломератах состоящих только из ESC ассиметризации экспрессии не наблюдалось. Также, в клетках искусственных эмбрионов экспрессирующих T:GFP наблюдали экспрессию генов Snail и Vimentin. Это говорит о том, что происходит не только дифференцировка мезодермы, но также эти клетки проходят морфологические изменения сопровождающие морфогенез данного зародышевого листка.
Важным этапом эмбриогенеза является спецификация первичных половых клеток (ППК). in vivo ППК дифференцируются на границе эмбрионального и экстраэмбрионального компартментов в проксимальной части мезодермального домена. Для анализа дифференцировки и локализации ППК в искусственных эмбрионах анализировали экспрессию генов-маркеров ППК. В области, где формируются ППК в нормальном развитии и были обнаружены клетки экспрессирующие гены Tfap2C совместно с Oct4, а также Stella. Для идентификации Stella была сконструирована репортерная клеточная линия Stella:GFP. Надо отметить, что в ESC культивируемых отдельно экспрессия Stella была дезорганизована. Для более подробного исследования экспрессии генов-маркеров ППК, клетки эмбрионального компартмента были разделены на экспрессирующие T:GFP и не экспрессируещие. Далее, методом пцр в реальном времени анализировали уровень экспрессии маркеров ППК. Исследователи выявили повышение экспрессии генов Tfap2c, Stella, Prdm14, Nanos3, Ddx4 и понижение экспрессии Dnmt3b в T:GFP положительных клетках, что соответствует известным представлениям о дифференцировке ППК. Таким образом, показано, что в искусственных эмбрионах возможна спецификация ППК как в нормальном развитии.
Полученные в работе результаты ставят вопрос: будет ли работать такой подход с клетками человека. Несомненно, дальнейшие исследования столкнутся с необходимостью решения этических вопросов, но, несмотря на это, полученные данные, имеют большое значение как для дальнейших фундаментальных исследований механизмов раннего развития млекопитающих, так и для возможных биомедицинских разработок.
Harrison, S.E. et al. Assembly of embryonic and extra-embryonic stem cells to mimic embryogenesis in vitro. Science, (2017).
Bedzhov, I. et al. in vitro culture of mouse blastocysts beyond the implantation stages. Nat.Protoc. 9, 2732–2739 (2014).
Новость подготовил © 17.05.2017 Станислав Кремнев