
Область научных интересов: нейрофизиология, исследование нейродегенеративных заболеваний, морфология нервной ткани.
Болезнь Паркинсона (БП) – нейродегенеративное заболевание, характеризующиеся прогрессирующий деградацией дофаминергической системы нигростриатного пути. Основным маркером заболевания у людей служит наличие телец Леви в дофаминергических нейронах черной субстанции, образованных из агрегатов α-синуклеина. В 96% случаев заболевание диагностировано у людей в возрасте более 50 лет, в связи с чем болезнь принято считать «возрастной». Однако может ли естественное старение организма способствовать прогрессированию заболевания? Как отмечают авторы данной работы, цитируя мировые данные, клеточное старение играет одну из ключевых ролей в патологии БП. Например, на материале компактной части черной субстанции пациентов БП, полученной после аутопсии, отмечается повышенный уровень экспрессии мРНК p16INK4a, ответственного за ингибирование пролиферации клеток. Также было показано, что старение самих дофаминергических нейронов способствует выработке веществ, чей фенотип связан со старением клетки, впоследствии чего может развиться α-синуклеинопатия. Однако фокус интереса авторов пал не на страдающие при БП нейроны, а окружающие их глиальные клетки. Это связано с недавними данными, где показано, что в глиальных клетках, подверженных старению, наблюдается митохондриальная дисфункция, способствующая прогрессированию БП за счет выделения активных форм кислорода. Еще одной причиной такого интереса к изучению глиальных клеток обусловлена их возможностью разрушать внеклеточный α-синуклеин, посредством селективной аутофагии. Поэтому в работе сосредоточились на понимании клиренса агрегатов данного токсического фактора глиальными клеткам у молодых и старых мышей после моделирования БП. В работе была использована модель α-синуклеинопатии, полученная путем стереотаксического введения предварительно свернутых фибрилл (ПСФ) человеческого α-синуклеина (hu-α-syn) в стриатум мышей. Для более глубокого понимания деталей механизма деградации глиальными клетками, авторами была создана модель стареющей глии, на которую так же воздействовали ПСФ hu-α-syn.
Первым этапом оценки клиренса агрегатов α-синуклеина необходимо было определить разницу в распределении целевого белка у молодых (8 недель) и взрослых животных (85 недель). Для этого оценивали интегральную плотность сигнала против hu-α-syn после проведения иммуногистохимии. Через 1 месяц у взрослых мышей регистрировали сигнал как в интактной части стриатума, так и в коре головного мозга, чего не наблюдалось у молодых животных. Тем самым авторы показали, что распространение агрегатов α-синуклеина в мозге взрослых животных развивается в большей степени (рис.1).
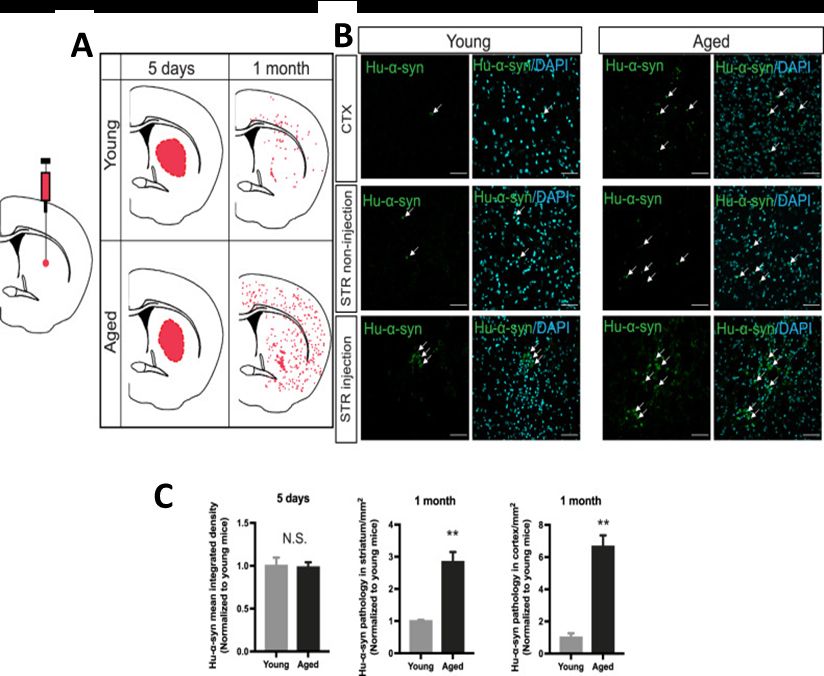
Рис. 1. Оценка распространения агрегатов α-синуклеина после стереотаксического введения предварительно свернутых фибрилл человеческого α-синуклеина в стриатум молодых и взрослых мышей. (А-В) Распределение агрегатов α-синуклеина через 5 дней и 1 месяц после введения предварительно свернутых фибрилл человеческого α-синуклеина в стриатум молодых и взрослых мышей. (С) Интегральный показатель распространения агрегатов α-синуклеина в мозге через 5 дней и 1 месяц после введения предварительно свернутых фибрилл человеческого α-синуклеина в стриатум молодых и взрослых мышей.
Следующим этапом исследования стало понимание: может ли глия играть ключевую роль деградации агрегатов α-синуклеина. Для этого была создана культура стареющей глии, материал для которой отбирался из коры головного мозга мышей на первый постнатальный день. Все время культивирования заняло 45 дней, культуру пересаживали 3 раза (Рис.2А). Молодая и стареющая глия состояла в основном из астроцитов и микроглии, что доказывалось иммуноцитохимической окраской на маркеры глиального фибриллярного кислого белка и молекулы-адаптера 1, связывающего ионизированный кальций (Рис.2В-С). Развитие программы клеточного старения оценивали по уровню бета-галоксидазы, накопление которой наблюдалось в большей степени в стареющей глии. Так же в сравнении с молодой глией, у стареющей глии наблюдалось снижение уровня экспрессии мРНК ламина B1 и Ki-67, как и доли Ki-67-позитивных клеток. В то же время наблюдалось увеличение экспрессии мРНК р16 и содержание его белка, а также экспрессии мРНК интерлейкина-6 и фактора некроза опухоли (Рис.2D-K).
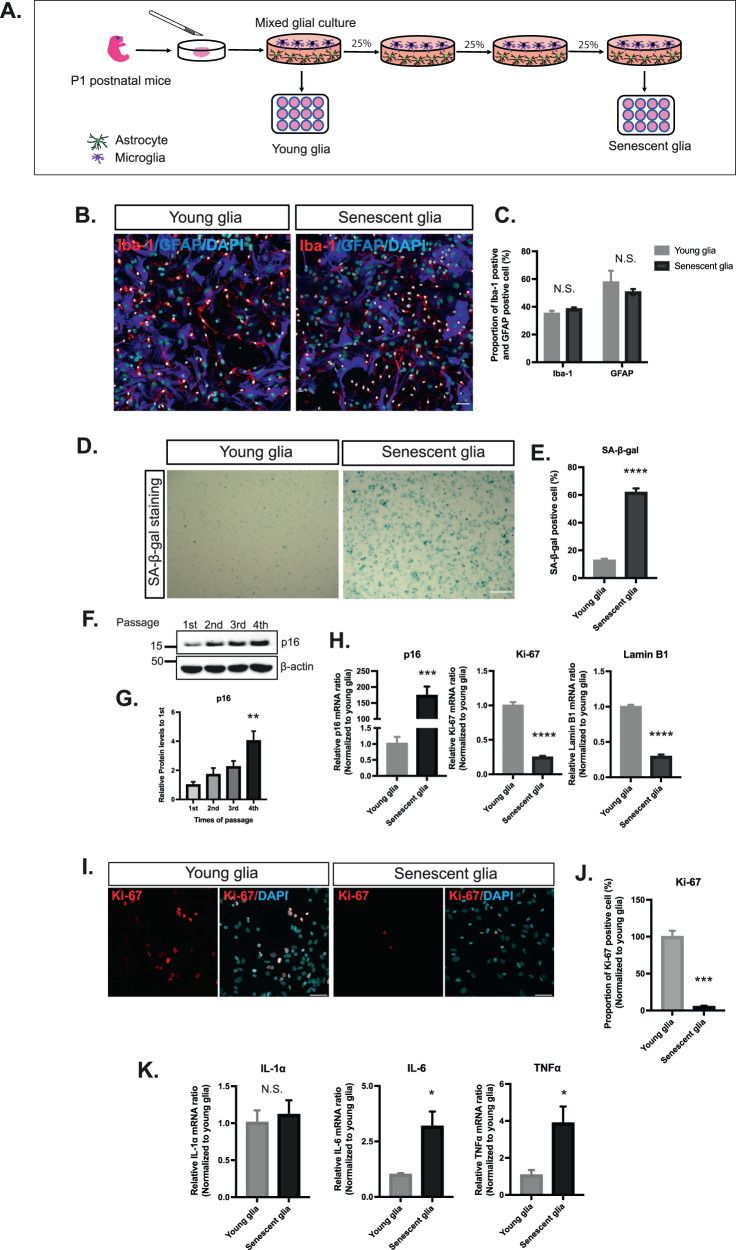
Рис. 2. Характеристика созданной культуры клеток молодой и стареющей глии. (А) Схема культивации клеток. (В-С) Определение популяции культивируемых клеток. (D-K) Показатели характеристики молодой и стареющей глии.
После того, как культура была охарактеризована, к ней так же добавляли ПСФ hu-α-syn для оценки клиренса α-синуклеина клетками (Рис. 3А). Оценку содержания белка hu-α-syn оценивали методом вестерн-блот через 0, 1, 2, 6 и 24 часа после часовой инкубации с ПСФ hu-α-syn и последующей отмывкой в чистой культуральной среде. Полученные данные дают ясное представление о возможности глиальных клеток к поглощению и перерабатыванию агрегатов α- синуклеина. Очевидно данный процесс в стареющих глиальных клетках происходит медленнее. Об этом говорит снижение белка hu-α-syn через 2 часа на 84% в молодой глии, в то время как данный показатель в стареющей глии достиг всего 46%, хотя данный показатель через 24 часа в обеих культурах достиг более 98% (Рис. 3B-E).
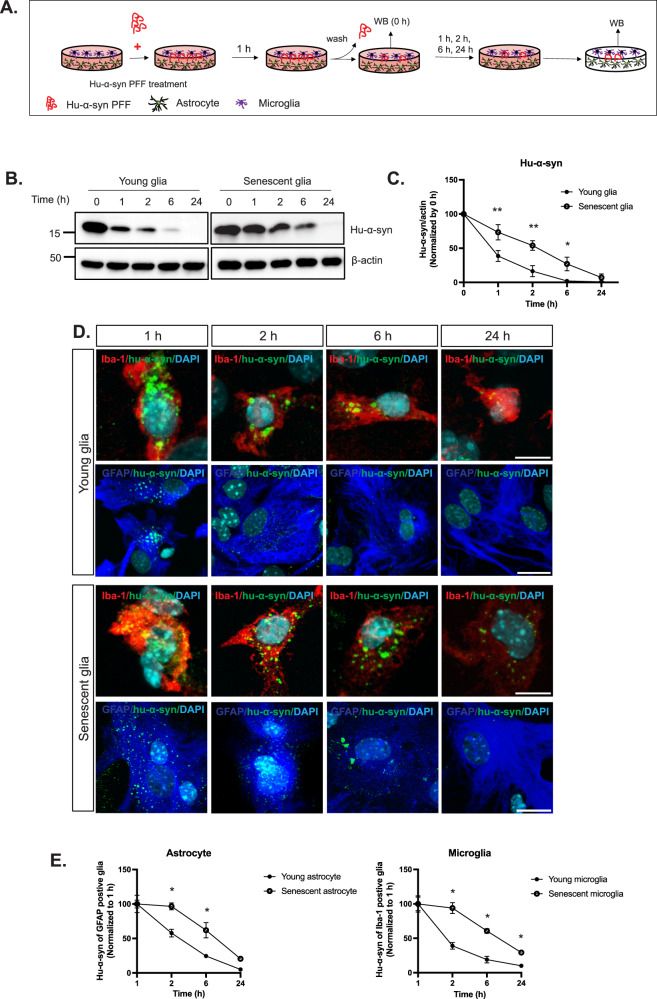
Рис. 3. Определение клиренса агрегатов α-синуклеина в культуре клеток молодой и стареющей глии. (А) Схема эксперимента. (В-С) Оценка содержания белка человеческого α- синуклеина через 0, 1, 2, 6 и 24 часа после часового воздействия предварительно свернутых фибрилл α-синуклеина человека. (D-E) Оценка клиренса агрегатов α-синуклеина через 0, 1, 2, 6 и 24 часа после часового воздействия предварительно свернутых фибрилл α-синуклеина человека в астроцитах и клетках микроглии.
После этого авторы поставили перед собой задачу понять через какой путь происходит клиренс α-синуклеина: убиквинтин-протеосомную систему (УПС) или аутофагию. Для этого на культурах молодой и стареющей глии применяли ингибиторы УПС - MG132 и бафиломицин 1А, как ингибитор системы аутофагия-лизосома. Благодаря полученным данным удалось понять, что ингибирование УПС хоть и снижает клиренс α-синуклеина в обеих культурах глии, но основной путь деградации лежит через систему аутофагия-лизосома. Об этом говорят данные после ингибирования системы бафиломицином 1А, когда наблюдалось отсутствие снижение уровня белка hu-α-syn на протяжении всего наблюдения (через 0, 1, 2, 6 и 24 часа) как в молодой, так и в стареющей глии; в отличии от ингибитора MG132, который снижал деградацию агрегатов α- синуклеина в молодой глии только через 2 часа наблюдения, а в стареющей глии только через 24 часа (рис.4).
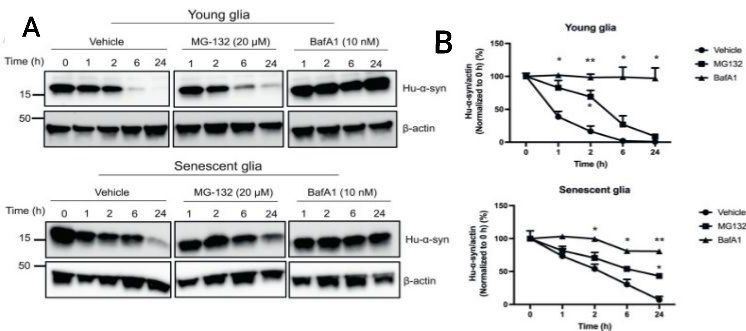
Рис. 4. Оценка убиквинтин-протеосомной системы и аутофагии в культурах клеток молодой и стареющей глии. (А) Оценка содержания белка человеческого α-синуклеина после воздействия ингибитора убиквинтин-протеосомной системы – MD-132, и ингибитора аутофагии бафиломицин 1А в молодой и стареющей культурах клеток глии. (В) График изменений содержания белка человеческого α-синуклеина после ингибирования убиквинтин-протеосомной системы и аутофагии через 0, 1, 2, 6 и 24 часа в молодой и стареющей культурах клеток глии.
После получения данных, стало необходимо выяснить: есть ли разница аутофагоцитарной активности между молодой и стареющей глией. Для понимания нарушения механизма авторы оценивали данный показатель по разнице накопления аутофагосом с помощью определения содержания мембранного белка легкой цепи 3, а также белка р67, известного как селективный субстрат к аутофагии. Для адекватной оценки был так же использован бафиломицин 1А, чтобы исключить такие явления как индукция и дисфункция аутофагии. Приведенные авторами результаты дают ясно понять, что в молодой глии аутофагоцитарная активность на порядок выше, чем в стареющей, что может объяснить снижение клиренса α-синуклеина с процессом старения клетки (рис.5).
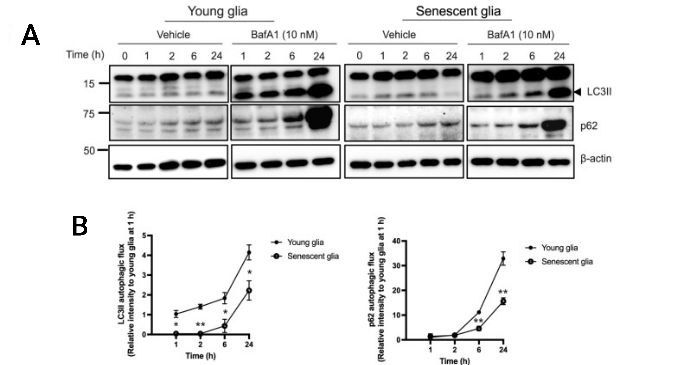
Рис. 5. Оценка аутофагоцитарной активности. (А) Оценка содержания мембраного белка легкой цепи 3 и белка p67 через 1, 2, 6 и 24 часа в молодой и стареющей культурах клеток глии. (В) График изменений содержания мембраного белка легкой цепи 3 и белка p67 через 1, 2, 6 и 24 часа в молодой и стареющей культурах клеток глии.
Таким образом, авторам работы удалось найти взаимосвязь между естественным старением клеток глии и их ролью в прогрессирующем развитии БП. Становится ясно, что увеличение распространения агрегатов α-синуклеина в мозге может быть связано с неспособностью клеток глии своевременно избавляться от токсического для нейронов фактора, что может быть обусловлено снижением активности аутофагии. Полученные данные могут стать основой для разработки комплексных методов терапии, направленных не только на защиту нейронов, а также на приостановку программы клеточного старения, тем самым пролонгировав продромальную стадию БП, не позволяя развиться моторным нарушениям.
Новость подготовила
© А. Банникова
17.04.2024