© Краус Юлия Александровна, доктор биологических наук, руководитель лаборатории эволюции морфогенезов ИБР РАН.
© Краус Юлия Александровна, доктор биологических наук, руководитель лаборатории эволюции морфогенезов ИБР РАН.
Активации генома эмбриона (активация зиготического генома, ZGA) – ключевой этап раннего развития животных. Целью исследования Shen et al., 2022 был поиск таймера, определяющего начало ZGA у эмбриона костистой рыбы Danio rerio. Эта работа впервые связывает начало ZGA с состоянием ядерных пор, обеспечивающих активный транспорт белков из цитоплазмы в ядро. Исследование выполнено коллективом авторов из Университета Цинхуа (Tsinghua University) (Пекин, Китай).
Одно из ключевых событий эмбриогенеза – активация собственного генома эмбриона (Zygotic Gene Activation, ZGA). Для ZGA необходима активность белков, модифицирующих гистоны и ремоделирующих хроматин, делая его доступным для транскрипции (Eckersley-Maslin et al., 2018). В предыдущей заметке, посвященной ZGA ("Кто разбудит геном эмбриона?") речь шла о работе пионерных транскрипционных факторов (ТФ) Pou5f3 и Soxb19 – глобальных активаторов зиготического генома у костистой рыбы Danio rerio (Gao et al., 2022). Эти ТФ, связываясь с ДНК, "открывают" регуляторные участки (преимущественно энхансеры), делая гены доступными для транскрипции (Gao et al., 2022).
Неизбежно возникает вопрос – откуда ТФ "узнают", что настала пора будить геном? Другими словами, как регулируется время начала ZGA? Считается, что таймером, определяющим начало ZGA, является либо изменение отношения ядро/цитоплазма, либо изменение концентрации в клетках эмбриона материнских детерминант (транскрипционных репрессоров или активаторов). Недавнее исследование (Shen et al., 2022) показало, что молекулярным таймером ZGA у Danio может служить созревание белкового комплекса ядерной поры (Shen et al., 2022).
Для более подробного рассказа об этом исследовании нужна некоторая базовая информация о структуре и функциях ядерных пор.
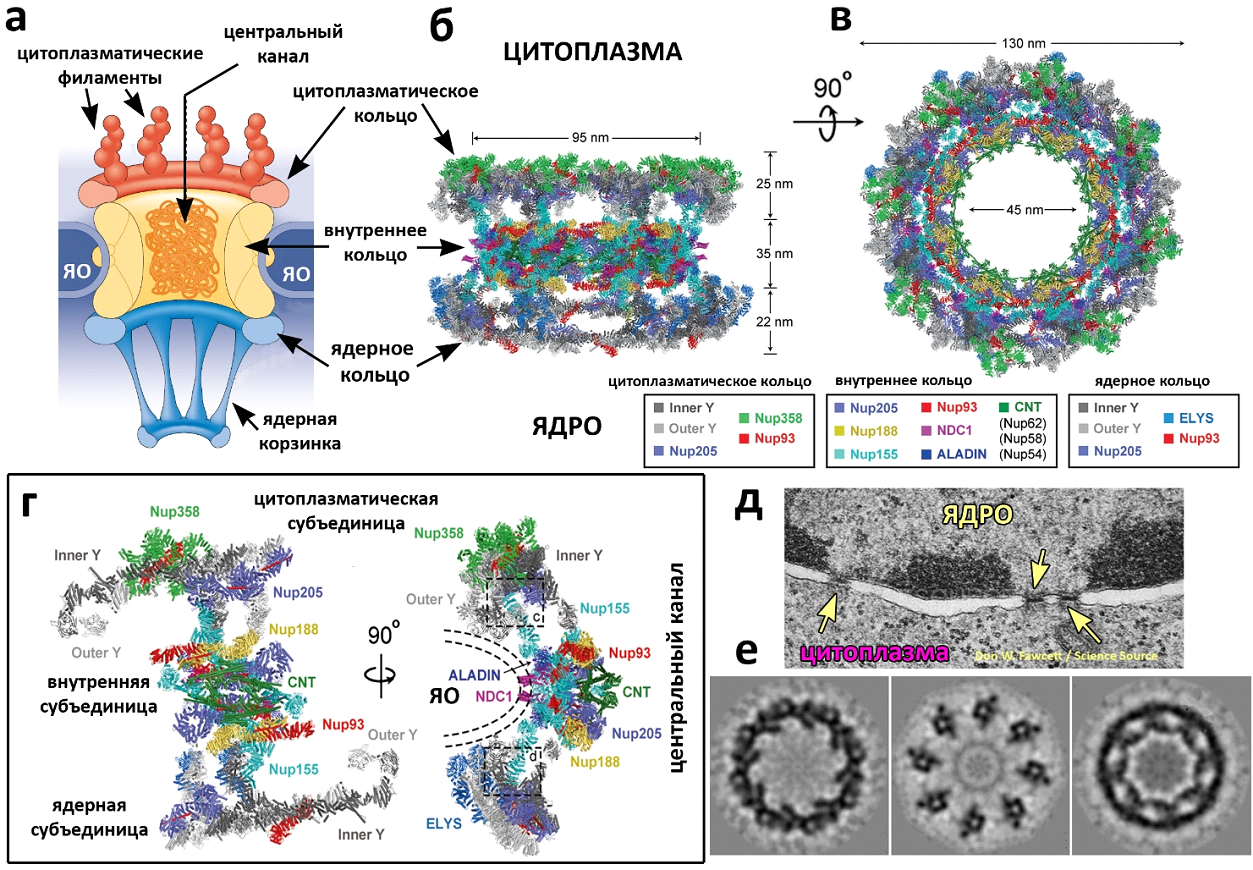
Ядерная пора – это не просто отверстие в двухслойной ядерной оболочке, а единственный канал, осуществляющий избирательный транспорт молекул между ядром и цитоплазмой. Ядерный транспорт (а также созревание мРНК, сборка сплайсосом, некоторые другие процессы) обеспечивается комплексом ядерной поры (Nuclear Pore Complex, NPC). NPC – один из крупнейших белковых комплексов клеток эукариот, состоящий (в зависимости от вида) из 500 – 1000 белков нуклеопоринов (Dultz et al., 2022). Исследование архитектуры и принципов работы ядерной поры – одна из актуальных тем клеточной биологии. С 2015 по 2022 годы в ней произошёл настоящий прорыв, позволивший реконструировать структуру NPC с разрешением до 4 – 7 ангстрем (Schwarz, 2022). Это было достигнуто с помощью набора современных методов, который включает рентгеновскую кристаллографию, масс-спектроскопию, криоэлектронную микроскопию и томографию, компьютерное моделирование (Schwarz, 2022). В 2022м году реконструкции структуры NPC был посвящён специальный раздел номера журнала Science (рис. 1, https://www.science.org/...).
NPC имеет внешний диаметр 120-130 нм и высоту 50-80 нм, состоит из трёх колец (цитоплазматическое, ядерное и центральное) и имеет радиальную восьмилучевую симметрию (рис. 1, 2а – е). От цитоплазматического кольца отходят цитоплазматические филаменты (платформа экспорта мРНК) (рис. 1, 2а). Ядерное кольцо несёт на себе ядерную корзинку, которая тоже задействована в транспорте мРНК (рис. 2а). Центральный канал NPC имеет диаметр 40-60 нм и заполнен белковыми молекулами, обеспечивающими его избирательную проницаемость. Он позволяет молекулам менее 40 кДа свободно диффундировать через пору. Более крупные молекулы транспортируются активно. Для этого нужны ядерные транспортные рецепторы (NTRs) и градиент концентрации малой ГТФазы Ran (Dultz et al., 2022). Более подробно о структуре и методах реконструкции NPC можно почитать в целом ряде современных статей (Wing et al., 2022; Bley et al., 2022; Petrovic et al., 2022; Mosalaganti et al., 2022; Zhu et al., 2022).
Из сказанного выше понятно, что NPC обладает очень сложными составом и архитектурой. С другой стороны, пионерные ТФ могут попасть из цитоплазмы в ядро только за счёт активного транспорта, для которого нужен корректно собранный NPC. Эти положения и легли в основу исследования, посвященного роли ядерных пор в активации генома (Shen et al., 2022).
Авторы начали работу с проверки предположения о том, что концентрация ТФ в ядрах бластомеров эмбрионов Danio зависит от стадии развития. С помощью масс-спектрометрии они сравнили состав материнских белков в ядрах на стадии 32х клеток, когда зиготический геном еще не активирован, и на стадии 512ти клеток, незадолго до ZGA. Оказалось, что концентрации многих белков в ядрах значимо различаются на разных стадиях развития, в то время как в целых клетках (ядро + цитоплазма) изменяются концентрации лишь нескольких белков. Интересно, что концентрация пионерных ТФ Nanog, Sox19b, and Pou5f3 в ядрах возрастает между стадиями 32х и 512ти клеток в 50 – 100 раз, тогда как их концентрация в клетке возрастает всего в 1.2 – 1.9 раз. Небольшое увеличение концентрации этих белков в цитоплазме связано с продолжающейся трансляцией материнских мРНК.
Затем авторы исследовали концентрацию компонентов NPC – белков нуклеопоринов (NUPs) – в протеомах ядер и целых клеток. Всего было обнаружено 26 NUPs. Концентрации 16-ти из них увеличились в ядрах более чем в 2 раза (а иногда – более чем в 5 раз) между стадиями 32х и 512ти бластомеров. При этом их концентрации в целых клетках изменились незначимо. Это может говорить о том, что к стадии средней бластулы молекулы NUPs концентрируются в ядерной оболочке, собираясь в NPCs, которые как раз и регулируют ядерный транспорт материнских ТФ.
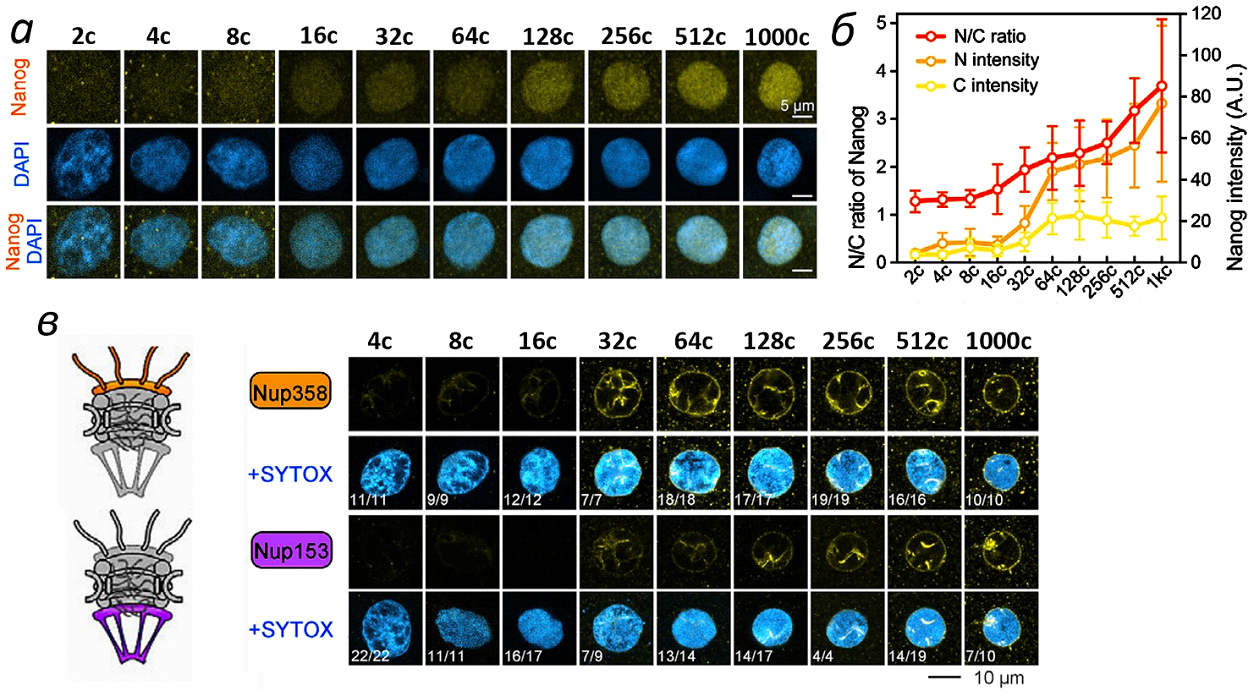
С помощью иммуноцитохимии удалось наглядно показать, что на стадии средней бластулы материнские ТФ накапливаются в ядрах. Для примера здесь приведены данные, полученные при исследовании ТФ Nanog, играющего важную роль в ZGA (рис. 3а, б). Интенсивность экспрессии Nanog в ядре и цитоплазме перевели в количественную форму (рис. 3б). Оказалось, что уровень экспрессии Nanog постепенно увеличивается между стадиями 16 и 1000 клеток; соответственно, растёт соотношение его экспрессии в ядре и цитоплазме (N/C) (Рис. 3б).
Активный транспорт белков в ядра был также изучен экспериментальными методами. Как правило, транспорт белков в ядро зависит от сигнала ядерной локализации (nuclear localization signal, NLS). Клетка метит аминокислотной последовательностью NLS те белки, которые должны быть перемещены в ядро. Авторы создали 3 трансгенные линии, клетки которых синтезируют под промотором EF1alfa белок GFP (или более тяжёлый GST-GFP), меченый NLS: Tg(ef1a:sNLS-GFP), Tg(ef1a:nNLS-GFP), Tg(ef1a:GSTsNLS-GFP). Кроме того, ещё одна линия – Tg(ef1a: GST-GFP) – была контрольной; её клетки синтезировали GFP без метки NLS. Во всех линиях, кроме контрольной, белки GFP (или GST-GFP) активно транспортировались в ядра. Причём концентрация GFP в ядрах медленно увеличивалось от стадии 8 до стадии 128 бластомеров, а затем резко возрастала. Эти данные позволили авторам предположить, что NLS-опосредованный ядерный транспорт белков зависит от стадии развития.
Возникает вопрос – если активность ядерного транспорта белков зависит от стадии развития, то меняется ли в ходе развития состояние (структура) NPC?
Авторы исследовали динамику локализации в ядрах пяти нуклеопоринов с помощью иммуноцитохимии. Здесь приведены изображения, полученные для Nup358 (компонента цитоплазматических филаментов) и Nup153 (компонента ядерной корзинки), которые могут регулировать ядерный транспорт белков и мРНК (рис. 3в). Для обоих белков сигнал метки были почти неразличим до стадии 16 клеток, а затем, между стадиями 32х и 1000 клеток, постепенно становились интенсивнее (рис. 3в).
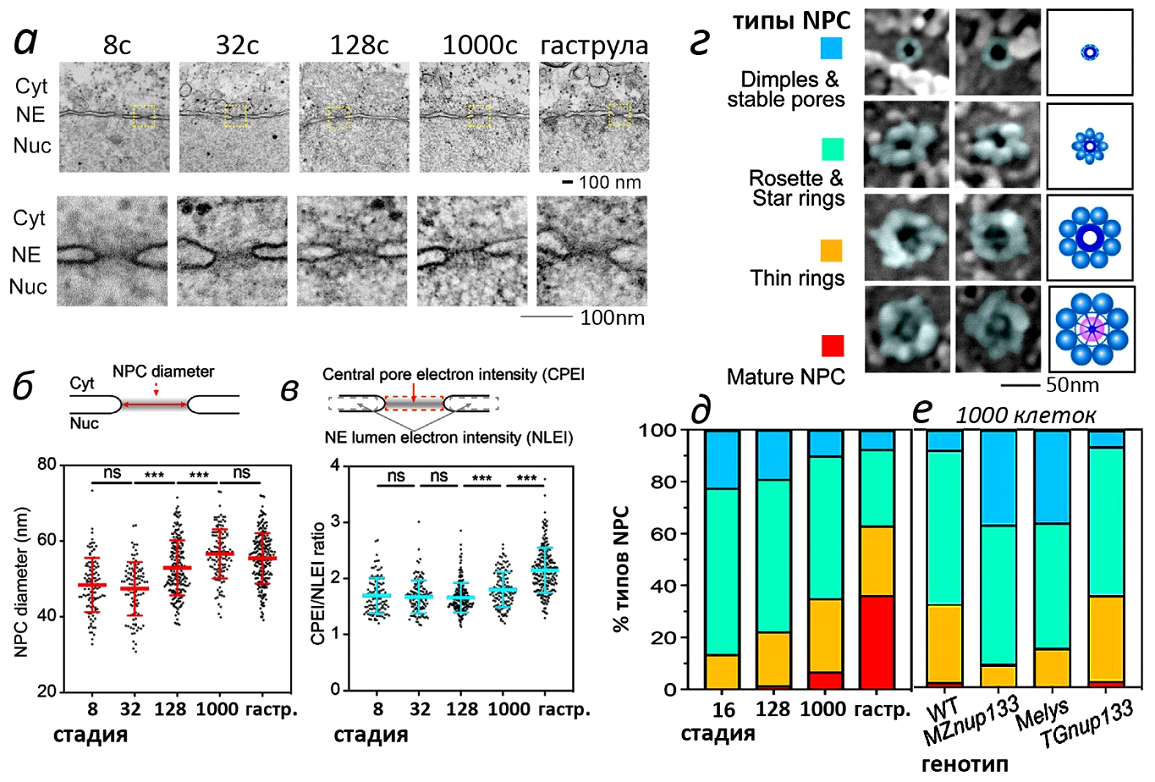
Затем авторы перешли к анализу морфологии NPC на последовательных стадиях развития (рис. 4). С помощью трансмиссионной электронной микроскопии (ТЭМ) были получены изображения ядерных пор (рис. 4а). Сначала измерили длину той области, которая соответствует диаметру NPC (рис. 4б). Оказалось, что диаметр NPC значимо увеличивается между стадиями 32 и 128 клеток и между стадиями 128 и 1000 клеток. При этом у эмбрионов, прошедших стадию средней бластулы, было больше крупных NPC.
На ТЭМ изображениях ядерных пор заметно, что электронная плотность области NPC на разных стадиях различается. Для того, чтобы сделать данные более объективными, авторы вычисляли "относительную электронную плотность" – соотношение электронной плотности области NPC и пространства между слоями ядерной оболочки (CPEI/NLEI, рис. 4в). CPEI/NLEI постепенно увеличивалась от стадии 128 клеток до стадии гаструлы (рис. 4в).
Далее авторы проанализировали морфологию NPC с помощью полевой эмиссионной сканирующей электронной микроскопии (FESEM) (рис. 4г). В ядрах эмбрионов Danio удалось обнаружить все морфологические типы NPC, которые были описаны в предыдущих исследованиях (рис. 4г). Эти типы соответствуют последовательным этапам сборки (созревания) NPC: ямка/стабильная пора (dimple/stable pore), розетка/звездчатое кольцо (rosette/star ring), тонкое кольцо (thin ring) и зрелая форма (mature) (рис. 4г). На стадии 16 бластомеров зрелых NPC вообще не было обнаружено. Они появились на стадии 128 клеток в очень небольшом количестве (1,5%). Во время гаструляции доля зрелых NPC достигла уже 36,3% (рис. 4д). Доля почти созревших NPC (тонкое кольцо) также увеличилась с 13,6% (16 клеток) до 28,2% (1000 клеток) (рис. 4д). Интересно, что доля зрелых (и почти зрелых) NPC в ядрах эмбрионов мутантных линий MZnup133) и Melys) (отсутствие материнских компонентов NPC Nup133 и Elys), была заметно меньше, чем у эмбрионов дикого типа и у эмбрионов трансгенной линии TGnup133 (рис. 4е).
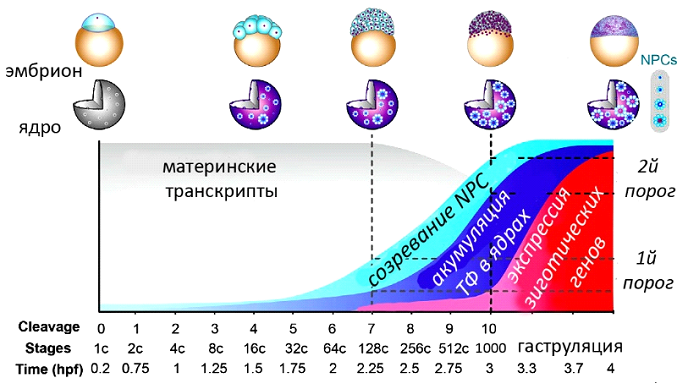
Таким образом, доля крупных и зрелых NPC в ядрах эмбриона Danio увеличивается в ходе развития. Авторы высказали предположение, что по мере созревания NPC ядерный транспорт ТФ становится более эффективным; в результате концентрации разных ТФ в ядре достигают своих пороговых значений, позволяющих активировать транскрипцию зиготических генов, то есть инициировать ZGA (рис.5).
Судя по всему, ещё рано говорить о том, что найден таймер, определяющий начало ZGA. Дело в том, что мы не знаем, почему доля ядерных пор, содержащих зрелый (полностью функциональный) NPC, увеличивается по мере развития. Сами авторы высказывают следующее предположение: "...малое количество некоторых материнских компонентов NPC сдерживает сборку NPC у ранних эмбрионов". Постепенное накопление этих компонентов, транслируемых с материнских мРНК, как раз и может служить таймером, регулирующим начало ZGA. Ещё одно предположение авторов – сборка NPC может блокироваться некими репрессорами, концентрация которых будет уменьшаться со временем благодаря изменению соотношения ядро/цитоплазма. Кроме того, объектом данного исследования был вид, у которого ZGA приурочена к переходу средней бластулы (MBT). Было бы интересно провести похожую работу на одном из видов с ранней ZGA, происходящей на стадиях 2х – 16ти клеток.
Bley C. J., Nie S., Mobbs G. W., Petrovic S., Gres A. T., Liu, X., ...Hoelz A. 2022. Architecture of the cytoplasmic face of the nuclear pore. Science. v. 376(6598). eabm9129.
Dultz E., Wojtynek M., Medalia O., Onischenko E. 2022. The nuclear pore complex: birth, life, and death of a cellular behemoth. Cells. v. 11(9). p. 1456.
Eckersley-Maslin M. A., Alda-Catalinas C., Reik W. 2018. Dynamics of the epigenetic landscape during the maternal-to-zygotic transition. Nature Reviews Molecular Cell Biology. v. 19(7). p. 436-450.
Gao M., Veil M., Rosenblatt M., Riesle A. J., Gebhard A., Hass H., ... Onichtchouk D. 2022. Pluripotency factors determine gene expression repertoire at zygotic genome activation. Nature Communications. v. 13(1). p. 788.
Huang G., Zhan X., Zeng C., Zhu X., Liang K., Zhao Y., ... Shi Y. 2022. Cryo-EM structure of the nuclear ring from Xenopus laevis nuclear pore complex. Cell Research. v. 32(4). p. 349-358.
Maimon T., Elad N., Dahan I., Medalia O. 2012. The human nuclear pore complex as revealed by cryo-electron tomography. Structure. v. 20(6). p. 998-1006.
Mosalaganti S., Obarska-Kosinska A., Siggel M., Taniguchi R., Turoňová B., Zimmerli C. E., ... Beck M. 2022. AI-based structure prediction empowers integrative structural analysis of human nuclear pores. Science. v. 376(6598). eabm9506.
Petrovic S., Samanta D., Perriches T., Bley C. J., Thierbach K., Brown B., ... Hoelz A. 2022. Architecture of the linker-scaffold in the nuclear pore. Science. v. 376(6598). eabm9798.
Raices M., D'angelo M. A. 2012. Nuclear pore complex composition: a new regulator of tissue-specific and developmental functions. Nature reviews Molecular cell biology. v. 13(11). p. 687-699.
Schwartz T.U. 2022. Solving the nuclear pore puzzle. Science. v. 376(6598). p. 1158-1159.
Wing C. E., Fung H. Y. J., Chook Y. M. 2022. Karyopherin-mediated nucleocytoplasmic transport. Nature Reviews Molecular Cell Biology. v. 23(5). p. 307-328.
Zhu X., Huang G., Zeng C., Zhan X., Liang K., Xu Q., ... Shi Y. 2022. Structure of the cytoplasmic ring of the Xenopus laevis nuclear pore complex. Science. v. 376(6598). eabl8280.
Новость подготовила
© Краус Ю.А.
17.04.2023