X. Zhong et al. Generation of three-dimensional retinal tissue with functional photoreceptors from human iPSCs. Nature Communications. 2014.
Yu et al. Nrl knockdown by AAV-delivered CRISPR/Cas9 prevents retinal degeneration in mice. Nature Communications, 2017.
Kuriyan et al. Vision Loss after Intravitreal Injection of Autologous “Stem Cells” for AMD. N. Engl. J. Med. 2017.
Blackiston et al. Serotonergic stimulation induces nerve growth and promotes visual learning via posterior eye grafts in a vertebrate model of induced sensory plasticity. NPJ Regenerative Medicine, 2017.
 © Григорян Элеонора Норайровна
зав. лабораторией проблем регенерации. д.б.н. Область научных интересов: клеточные и молекулярные механизмы регенерации органов и тканей у позвоночных животных.
© Григорян Элеонора Норайровна
зав. лабораторией проблем регенерации. д.б.н. Область научных интересов: клеточные и молекулярные механизмы регенерации органов и тканей у позвоночных животных.
В сообщении приведу несколько примеров экспериментальной и клинической работы, которая ведется с целью восполнения значительно сниженного или утраченного зрения у человека. Сегодня эта работа строится на достижениях современных биологических подходов и технологий, а именно, в первую очередь, на использовании индуцированных плюрипотентных стволовых клеток (iPSCs), получения из них клеточных продуктов, и попыток с их помощью заместить погибшую или поврежденную ткань глаза (чаще всего сетчатку). Другим подходом является геномодификация при использовании технологии CRISPR/Cas9 для устранения генетических дефектов, приводящих к патологии развития сетчатки и потере зрения, например пигментному ретиниту. Многое, как мы увидим, удается в лабораторных экспериментах, но с трансляцией результатов в медицинскую практику дело обстоит сложнее.
Итак, впервые осуществлена попытка терапии пигментного ретинита (retinitis pigmentosa, RP) на мышиной модели с использованием CRISPR/Cas9 технологии. RP – врожденное заболевание, генетически вариабельное, обусловленное нарушениями более чем в 60 генах с 3000-ми мутаций дает все основания действовать с помощью генотерапии. Zhijian Yu с коллегами разработали CRISPR sgRNA, мишенью которой является сетчаточный транскрипционный фактор Nrl (neural retina leucine zipper), ответственный за созревание палочек в развивающейся и их поддержание во взрослой сетчатке (Yu et al. 2017). Доставка Nrl targeted sgRNA и Cas9 эндонуклеазы осуществлялась непосредственно в сетчатку мышей с помощью двух адено-ассоциированных вирусных (AAV) векторов. Известно, что RP обусловлено постепенной гибелью вначале палочек в сетчатке (которые не только отвечают за ночное зрение, но и поддержавают структурно и трофически колбочки), а затем и колбочек. Роль фактора Nrl заключается в поддержании функционирования палочек, а элиминация его приводит к частичной конверсии палочек в колбочки и, что намного более существенно, является условием поддерживающим жизнеспособность колбочек.
Предлагаемая технология прямой доставки в сетчатку млекопитающих и человека конструкции AAV, опосредованной CRISPR/Cas9, как показали эксперименты на мышах, работает при разных формах дегенерации сетчатки, вызванной PR. Инъекции проводили двухнедельным мышам, а наблюдения велись 3-4 и 6 месяцев спустя. В результате вначале происходило значительное снижение экспрессии Nrl , а затем down-регуляция палочковых генов и up-регуляция колбочковых, а также ингибирование гибели колбочковых клеток (рис.1). Однако в данном случае, являющимся безусловным успехом, эксперименты осуществлены на мышиной модели, где в развитии патологии задействован не один, а 67 генов, остаются важные вопросы. Ответы на них должны быть получены до того, как метод будет использован в практике. В частности пока неизвестно, насколько можно экстраполировать все данные на сетчатку человека, и в частности, насколько губительна длительная экспрессия Cas9 для клеток сетчатки млекопитающих и человека.
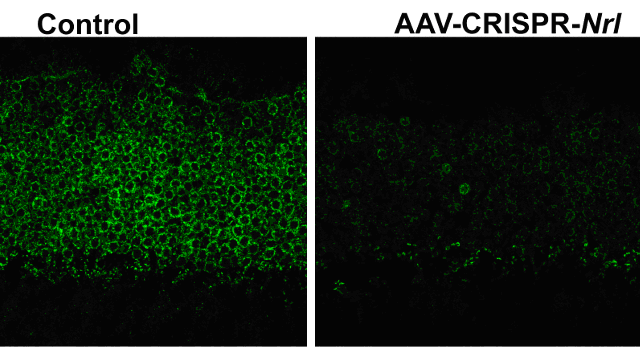
Рис.1. Значительно сниженная экспрессия Nrl в фоторецепторном слое спустя 2.5 мес после доставки конструкции AAV-CRISPR/Cas9 против Nrl (справа), то же AAV-CRISPR/Cas9 против EGFP в качестве контроля.
Существуют также попытки создания в лаборатории функционирующей сетчатки человека. Первыми такими шагами было получение из iPSCs человека морфологически зрелых фоторецепторов, имеющих все атрибуты функциональной специализации – внутренний и наружный сегменты фоторецепторной клетки. Вслед за этим была поставлена задача формирования из таких клеток тканевого продукта, где фоторецепторные клетки находились бы в нужной ориентации и отвечали бы на обработку светом. Maria-Valerio Canto-Soler (директор исследовательского центра ретинальной дегенерации в университете Johns Hopkins) и коллеги показали возможность дальнейшего роста и дифференцировки фоторецепторов, полученных из iPSCs человека, с последующим формированием ткани, содержащей клетки, не только в нужном соотношении и ориентации, но и обладающих функцией (X. Zhong et al. 2014; рис. 1). Формирующаяся ткань, высаженная в чашки на специальный матригель и в среду, обеспечивающую нейральную дифференцировку, имела определенную, сходную с онтогенетичекой у человека, динамику развития и поддерживалась in vitro в течение 200 дней. Аналог фрагмента сетчатки содержал семь клеточных типов, включая четыре типа фоторецепторов, обладающих наружным и внутренним светочувствительными сегментами – проводниками светового потока. Эти клетки содержали зрительные пигменты опсины – трансмембранные белки, ответственные за передачу сигнала от захваченных фотонов света в физиологический ответ, который регистрировали с помощью электродов. В этой истории удивляет автономный механизм выхода клеток искусственно выращенной сетчатки в дифференцировку, т.е. с большой вероятностью наличие неких, пока не известных, внутренних инструкций в отсутствие сопровождающих развитие сетчатки других тканей глаза.
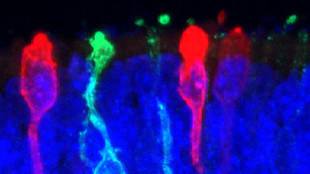
Рис.2. Полученные из iPSСs чловека фоторецепторные клетки в составе фрагмента ткани сетчатки.
Эта работа является определенным достижением, поскольку до сих пор не удавалось вывести получаемые клетки в столь глубокую, физиологически близкую полноценной, дифференцировку. Авторы работы при этом предупреждают, что еще необходимо значительное время до момента, когда такие клеточные продукты смогут быть использованы в клинической практике.
В другой работе, опубликованной в New England Journal of Medicine (Kuriyan et al., 2017) описана неудача попыток трансплантации стволовых клеток трем пациентам, пожилым женщинам, страдающим макулярной дистрофией сетчатки (AMD). Адипозитные клетки (клетки жировой ткани), взятые у пациентов, использовали для получения стволовых клеток, при этом они не были до конца проверены на свойства и возможную патогенность. Трансплантация таких клеток пациентам с AMD привела к серьезным осложнениям и потере зрения во всех трех случаях. В статье отмечается также, что данный случай только вершина айсберга, поскольку известно, что сходным образом трансплантации непроверенного клеточного материала осуществляются в 600 клиниках США. В противоположность данной неудаче в том же журнале New England Journal of Medicine сообщается о благополучных исходах при трансплантации пласта ретинального пигментного эпителия, полученного из iPSCs клеток, с целью лечения AMD у пожилых пациентов. Результат невелик – отсутствие дальнейшего ухудшения зрения в течение 1 года.
Рис.3. Глазное яблоко пациента, страдающего макулярной дистрофией сетчатки. WIKIPEDIA, TMHLEE.
При всех попытках трансплантаций выращенных in vitro из iPSCs или других источников клеток, клеточных агрегатов или фрагментов ткани сетчатки самым трудным и наиважнейшим (поскольку речь идет о сенсорной ткани) является вопрос интеграции введенного материала в ткань реципиента и установление корректных взаимосвязей с другими клетками и зрительным анализатором. Работ, в которых делаются попытки решить эту проблему, или, по крайней мере, найти подходы к ее решению, очень немного. Ниже мы приводим одну из них (Blackiston et al., 2017).
Авторы проделали достаточно необычные эксперименты на личинках лягушки X. laevis, у которых глаза полностью развиваются к 47 стадии. До этого момента на 34 стадии зачатки глаз, а точнее области их формирования, были удалены, что приводило к слепоте личинок, служивших для трнасплантации развивающихся глаз (взятых на 24 стадии) в область хвоста (рис. 3). В сайте трансплантации глаза продолжали развиваться, имели проксимо-дистальную ориентацию и хрусталик, обращенный наружу. Вокруг таких глаз на более поздних стадиях формировалась очень незначительная по объему иннервация. В случае обработки пересаживаемого зачатка глаз агонистом серотониновых рецепторов 5-HT1B/D золмитриптаном (Zolmitriptan) морфология эктопического глаза не изменялась, но значительно возрастала сеть афферентных волокон. В росте нейритов участвовали также ткани хвоста и тела головастика. Возросшая иннервация в ответ на обработку нейротрансмиттером и активацию рецепторов серотонина 5-HT1B/D приводили к увеличению функциональной интеграции эктопического органа в цнс реципиета и, как полагают авторы, включение этой новообразованной нейральной сети в его поведенческую исходную программу.
Особенностью работы явилось то, что используемый агент, агонист 5-HT1B/D золмитриптан известен, как серотонинергическое медикаментозное средство, широко используемое человеком. Вторая особенность – тщательно разработанные физиологические тесты, доказывающие появление светочувствительности у слепых головастиков в результате проведенной трансплантации эктопического развивающегося глаза, его обработки золмитриптаном, роста нейральных волокон и их взаимодействия с нервной тканью реципиента.
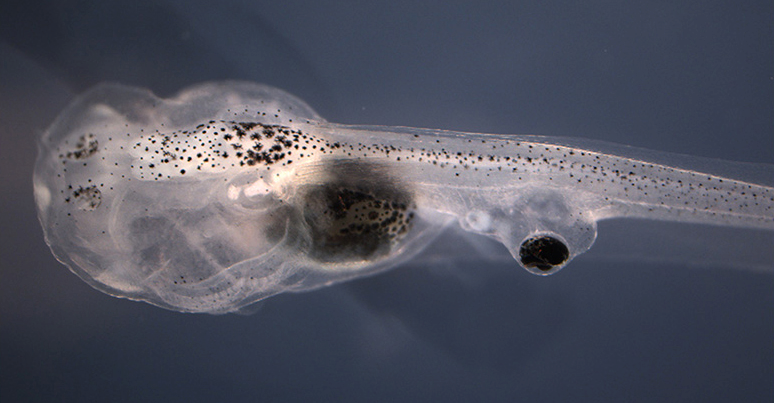
Рис.4. Слепые личинки X.laevis с глазом, подсаженным в хвост, оказались способны получать зрительную информацию после обработки трансплантата нейротрансмиттером.
Остается вопрос, в какой степени мозг реципиента корректно интерпретирует поступающие от подсаженного глаза сигналы, и будет ли работать данная схема взаимодействий во взрослом организме (в случае лягушки после метаморфоза). Несмотря на неординарность подобного подхода и, наоборот, консервативность других в решении вопроса интеграции различного рода клеточных продуктов, тканей и органов при трансплантации, можно, вероятно, заключить, что в эксперименте все средства хороши, но поспешность в трансляции в медицину может быть в лучшем случае неэффективной, а в худшем губительной.
Новость подготовила © 2017 Григорян Э.Н.
17.04.2017