
 © Вепа Абдыев, научный сотрудник лаборатории клеточной биологии ИБР РАН.
© Вепа Абдыев, научный сотрудник лаборатории клеточной биологии ИБР РАН.
© Андрей Рябинин, младший научный сотрудник лаборатории клеточной биологии ИБР РАН.
Индуцированные плюрипотентные стволовые клетки человека (чИПСК) представляют интерес как в рамках фундаментальных исследований, в частности касающихся изучения морфогенеза и механизмов дифференцировки клеток, так и с точки зрения прикладных задач регенеративной медицины, поскольку являются аналогом эмбриональных стволовых клеток человека (чЭСК), полученных из внутренней массы бластоцисты зародыша. Они способны дифференцироваться в любой тип клеток каждого из трех зародышевых листков (Courtot et al., 2014; Lau et al., 2020; Yamanaka, 2020). Помимо этого чИСПК могут быть получены из соматических клеток человека, что с одной стороны делает их более доступным и универсальным источником материала для клеточной терапии и ряда исследований в сравнении с чЭСК, а с другой позволяет получить аутологичные реципиенту клетки почти любого типа (Yamanaka, 2020).
Одной из важных проблем, связанных с использованием стволовых клеток в фундаментальных и прикладных исследованиях является накопление различных мутаций в геноме в ходе продолжительного культивирования (Kucab et al., 2019; Kuijk et al., 2020; Rouhani et al., 2016; Thompson et al., 2020, Laurent et al., 2011; Martins-Taylor et al., 2011; Merkle et al., 2017). Мутация — стойкое изменение генома под действием спонтанных или индуцированных факторов. Мутации разделяются на три типа в соответствии с уровнем, на котором они происходят: геномные, хромосомные и генные. В клеточном цикле клеток человека способны закрепляться хромосомные (делеции, дупликации, инверсии, транслокации) и генные (транзиции, трансверсии, делеции и инсерции) мутации. Генные мутации в подавляющем большинстве случаев затрагивают некодирующие последовательности ДНК, или же они происходят в экзонах, но не вызывают изменение экспрессии генов. Однако незначительная часть мутаций приводит к сдвигу рамки считывания или меняют аминокислотный состав продукта, что приводит к изменению экспрессии генов или меняет свойства синтезируемых белков. Если эти гены были связаны с контролем прохождения чекпоинтов и работой клеточного цикла, это может привести к развитию онкологии (Clancy, 2008). Спонтанные мутации возникают во всех фазах клеточного цикла в результате воздействия естественных мутагенов, в основном активных форм кислорода (Huttley, 2000., Kuijk et al, 2020). Известно, что в условиях in vivo эмбриональные стволовые клетки в большей степени устойчивы к различного рода мутациям по сравнению с соматическими клетками (Cervantes et al, 2002), однако до сих пор не было проведено сравнительного анализа интенсивности и направленности мутагенеза у плюрипотентных клеток эмбриона в условиях in vivo c аутологичными им чИПСК и мультипотентными стволовыми клетками в условиях in vitro при продолжительном культивировании.
В работе, посвященной этой проблеме, был проведен сравнительный анализ частоты накопления и характера мутаций у эмбриональных стволовых клеток прегаструлы человека (чЭСКП) в условиях in vivo и аутологичных им чИПСК в условиях in vitro. Оригинальным подходом данного исследования является комбинация методов VAF (variant allele frequency), методики подсчета мутаций, произошедших в ходе эксперимента или же унаследованных от материнской клетки, и NGS (Next generation sequencing) (He et al., 2019). Авторы смогли выявить паттерн соматических мутаций, произошедших и закрепившихся до гаструляции в 4 эмбрионах человека при помощи построения филогенетического древа, а затем получили чИПСК из тех же стволовых клеток для выявления культурально зависимого мутагенеза. Принцип выявления накопленных соматических мутаций в прегаструле заключался в проверке нулевой гипотезы сохранения мутаций у дочерних клеток. То есть возникшая соматическая мутация должна передаваться в дочерние клетки. Таким образом, нужно было проследить за одинаковыми мутациями в поколениях клеток из разных зародышевых листков и на основании полученных данных построить филогенетическое древо мутагенеза и узнать точку возникновения и количество мутаций (Рис. 1). Для этого при помощи полногеномного секвенирования были проанализированы геномы клонов клеток, полученных из абортивного материала зародыша. Данный подход позволил проследить за мутагенезом в условиях естественной ниши чЭСКП без оперативного вмешательства, прямого контакта исследователя или средств наблюдения с ними.
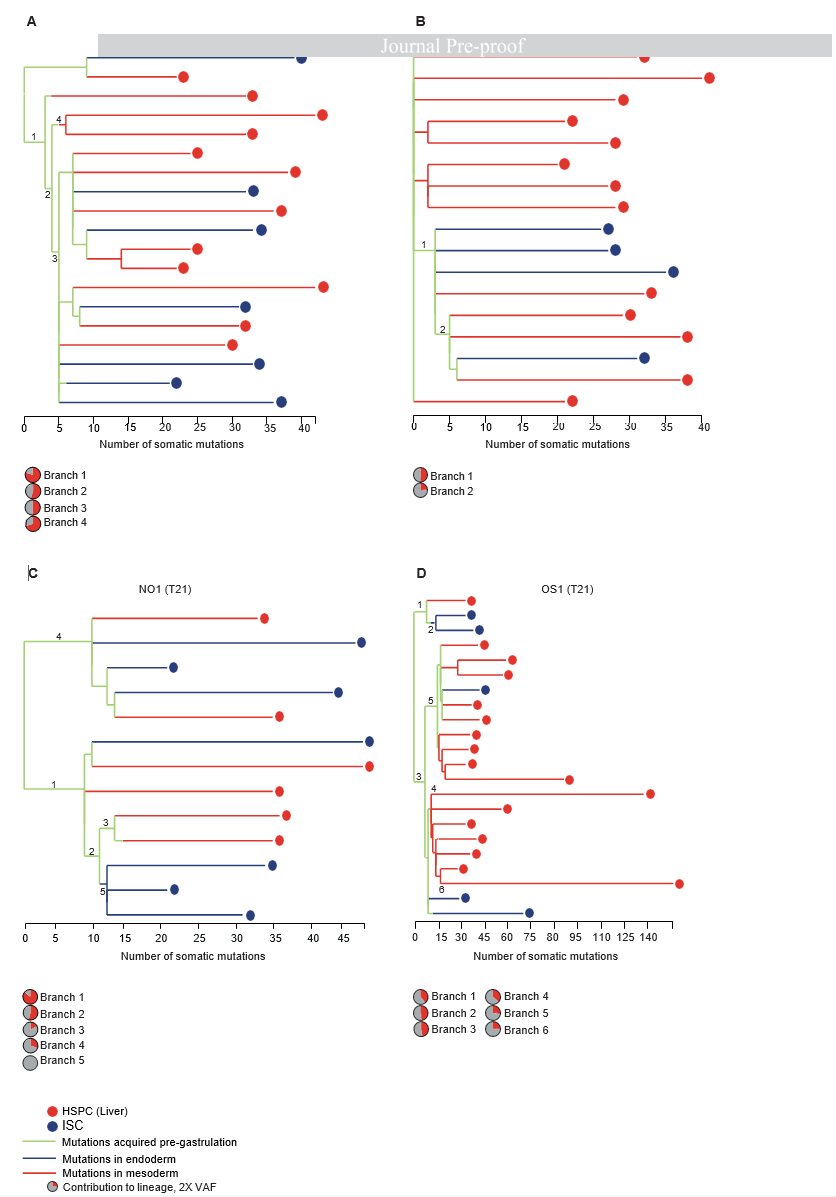
Рис. 1. Филогенетическое древо, полученное на основе анализа мутаций в клонах стволовых клеток, полученных из разных зародышевых листков: (A-D) Филогенетические древа развития 4 человеческих плодов (T21 – с триосомией; n = 2, D21 – без хромосомных аберраций; n = 2), отражающее приобретение точечных генетических мутаций в ходе развития зародышей. Зеленые линии обозначают соматические мутации, приобретенные до гаструляции, синие линии обозначают соматические мутации, выявленные в энтодерме (на основе материала, выделенного из клонов чИСК зародыша), красные – в мезодерме (на основе материала, выделенного из клонов чГСК из печени зародыша). Деления клеток в ветвях, обозначенных номерами, используются для определения соматических мутаций до гаструляции.
В результате авторы смогли выявить 17 независимых клеточных делений в прегаструле, которые определили частоту накопления соматических мутаций на стадиях прегаструлы. В исследовании участвовали как клетки с триосомией по 21 хромосоме (2 зародыша), так и без хромосомных мутаций (2 зародыша). Из материала зародышей получали первичные культуры гемопоэтических стволовых клеток (чГСК) и энтодермальных интестинальных стволовые клеток (стволовые клетки кишечника) (чИСК) с целью выявления и разделения мутаций, возникших на стадии прегаструлы и мутаций, произошедших во время дифференцировки двух зародышевых листов методом VAF. Во всех 4-х случаях на стадии прегаструлы были обнаружены определённые точечные мутации, в том числе инсерции и замены, в общей сложности от 10 до 40. Полученные чИСК использовали для получения чИПСК путем репрограммирования (были использованы клетки зародышей как с триосомией, так и без нее). После получения аутологичных чИПСК, их культивировали в течение 3 месяцев и проводили все манипуляции с ними в условиях гипоксии при 3% содержании O2 с целью увеличения чистоты эксперимента. Команда исследователей параллельно культивировали чИСК, из которых они были получены, в условиях нормоксии в течение 1.5 месяцев. Затем аналогично процедуре с исходными чЭСКП, из аутологичных чИПСК и чИСК получали клоны, забирали материал и проводили полногеномное секвенирование единичных клеток с целью выявления мутаций. Исследователи анализировали клеточный материал после каждого деления в культуре при помощи полногеномного секвенирования единичных клеток и сравнения полученных паттернов мутаций между собой на построенном в результате делений чИСК и чГСК филогенетическом древе (рис. 1), что позволило отделить мутации, произошедшие в результате делений чЭСКП в прегаструле от мутаций, произошедших в результате культивирования. Мутации, которые были найдены в ходе деления и у материнской клетки, и у обеих дочерних клеток исключали из подсчета.
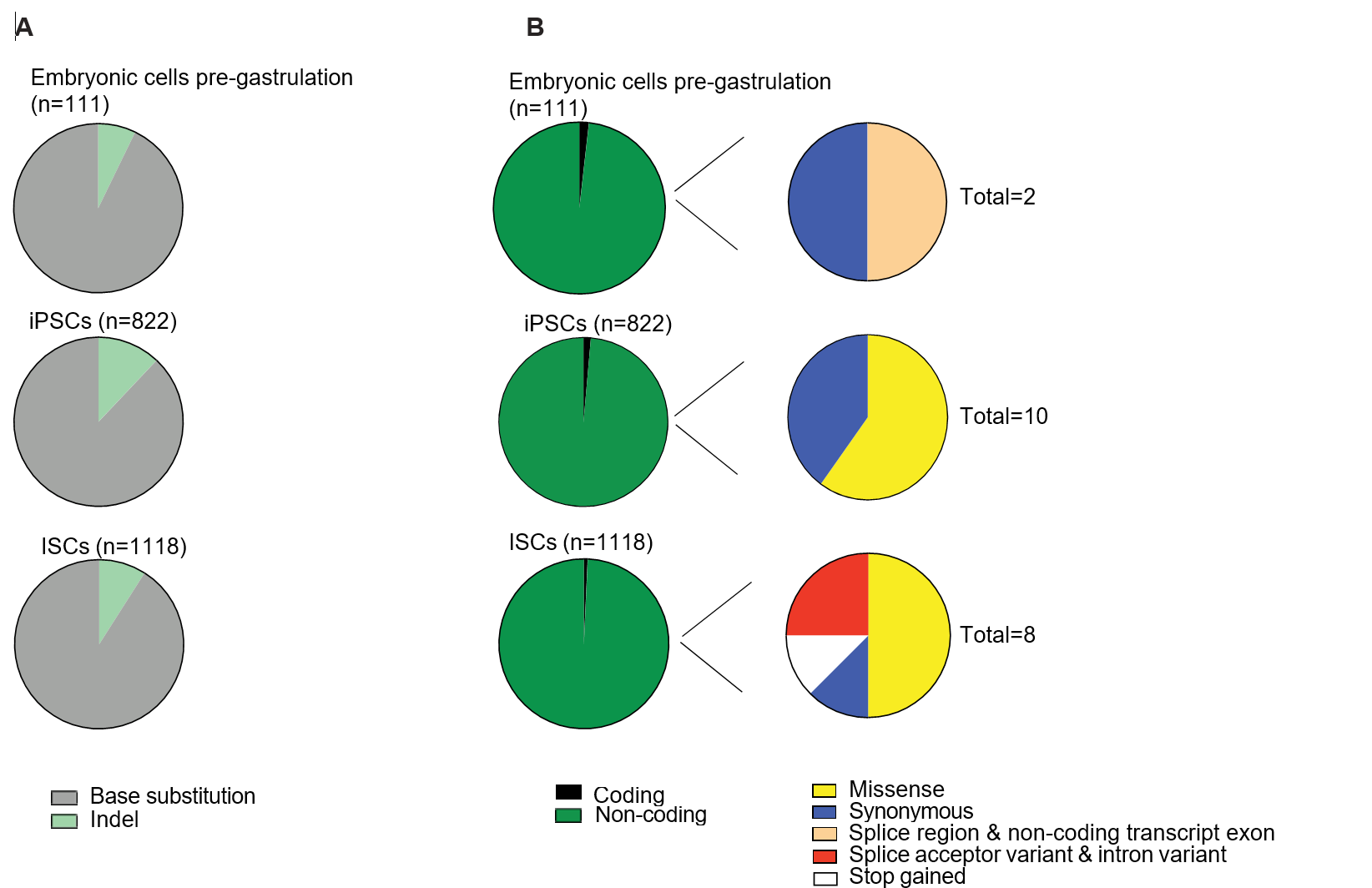
Рис. 2. Выявленные мутаций в эмбриональных клетках до гаструляции и произошедших в ходе культивирования: (А) Круговые диаграммы, демонстрирующие относительное количество выявленных замен и инсерций/делеций; (B) Круговые диаграммы, демонстрирующие относительное число мутаций в кодирующих и некодирующих последовательностях ДНК в геноме (слева) и относительное число белок-кодирующих мутаций в экзонах: миссенс, синонимичные, мутации в областях сплайсинга и в некодирующих транскрипт экзонах, мутации в акцепторных областях сплайсинга и интронах, мутации, приводящие к формированию стоп-кодона (справа).
По итогам сравнительного анализа, чИСК и чИПСК продемонстрировали идентичный характер мутаций (точечные инсерции, делеции и замещения, в подавляющем большинстве это замены оснований в некодирующих областях генома). При этом в условиях гипоксии после длительного культивирования у чИПСК было выявлено меньше мутаций, чем у чИСК (822 против 1118), а время прохождения клеточного цикла у последних увеличилось на 6-8 часов. Среди этих мутаций абсолютное большинство приходилось на некодирующие участки ДНК, менее 1 % затрагивали экзоны, при этом было выявлено лишь по 6 мутаций у чИПСК и 4 мутации у чЭСКП, приводящих к замене аминокислоты в продукте и лишь одна мутация у чЭСКП, приводящая к сдвигу рамки считывания (Рис. 1). Однако чИПСК продемонстрировали самую низкую частоту мутагенеза (число мутаций на деление клеток) – 1,65 у чЭСКП, 1,03 у чИПСК, 2,95 у чИСК (рис.2). Помимо этого на основе анализа материала от плодов с нормальным кариотипом и с триосомией достоверной разницы в интенсивности мутагенеза обнаружено не было. Также исследователи выявили связь между долей мутаций с дезаминированием метилированных цитозиновых оснований и временем прохождения клеточного цикла. У чЭСКП и чИПСК был зафиксирован повышенный процент мутаций с заменой цитозина на тимин, что также коррелирует с коротким клеточным циклом и ускоренной репликацией.
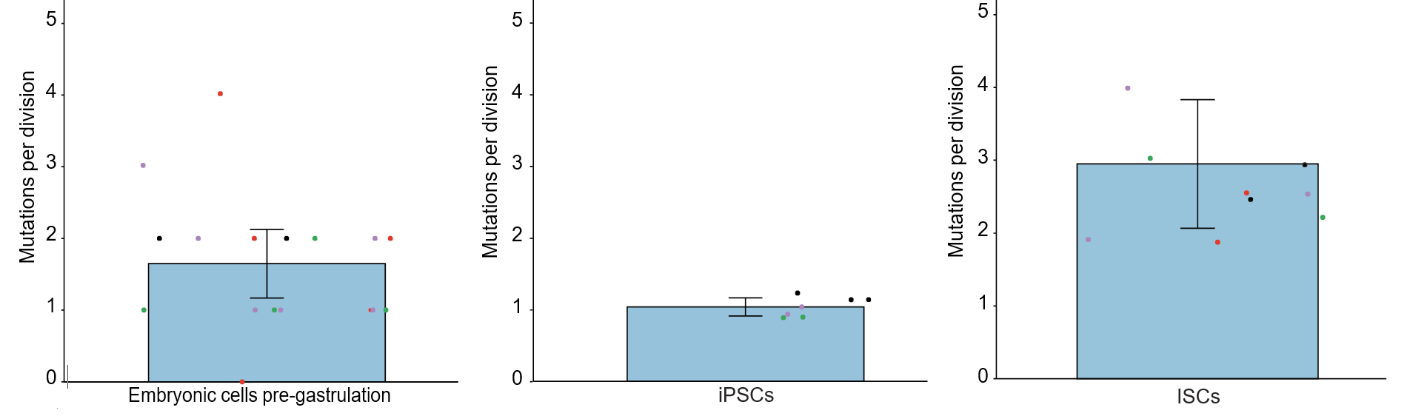
Рис. 3. Частота соматических мутаций у аутологичных чЭСКП in vivo, чИПСК in vitro при культивировании в условиях гипоксии и чИСК in vitro при культивировании в условиях нормоксии.
Таким образом, при длительном культивировании чИПСК точечные мутации в их геноме накапливаются в 2 раза медленнее и они не приводят к серьезному нарушению клеточного цикла в сравнении с аутологичными им мультипотентными клетками, а частота мутагенеза даже ниже, чем у чЭСКП в их естественной нише. Причиной этого может служить увеличение времени репликации в результате дифференцировки, более выраженное при нормоксии влияние активных форм кислорода, приводящих к появлению спонтанных мутаций, и менее интенсивная работа систем репарации ДНК у чИСК. Данное исследование еще раз акцентирует внимание на факте неминуемой аккумуляции мутаций, в том числе онкогенных, в ходе продолжительного культивирования любых стволовых клеток, что в том числе приводит к нарушению прохождения клеточного цикла, срабатыванию чекпоинтов и спонтанной дифференцировке (He et al, 2019; Merkle et al, 2017). Помимо этого, в данной работе в очередной раз подтверждается предположение о минимизации частоты мутагенеза в клеточной линии в условиях культивирования при гипоксии (Kuijk et al, 2020; Thompson et al, 2020).
Список литературы:
1) Cervantes et al, 2002. Embryonic stem cells and somatic cells differ in mutation frequency and type
2) Clancy et al, 2008. Genetic mutation // Nature Education 1(1):187.
3) Courtot et al, 2014. Morphological analysis of human induced pluripotent stem cells during induced differentiation and reverse programming // BioResearch Open Access 3, 206–216.
4) Huttley et al, 2000. How Important Is DNA Replication for Mutagenesis? // Molecular Biology and Evolution 17 (6), 929–937.
5) Kucab et al, 2019. A Compendium of Mutational Signatures of Environmental Agents // Cell 177, 821–836.
6) Kuijk et al, 2020. The mutational impact of culturing human pluripotent and adult stem cells // Nature Communications 11, 1–12.
7) Lau et al, 2020. Unique properties of a subset of human pluripotent stem cells with high capacity for self-renewal // Nature Communications 11, 1–18.
8) Laurent et al, 2011. Dynamic changes in the copy number of pluripotency and cell proliferation genes in human ESCs and iPSCs during reprogramming and time in culture // Cell Stem Cell 8, 106–118.
9) Martins-Taylor et al, 2011. Recurrent copy number variations in human induced pluripotent stem cells // Nature Biotechnology 29, 488–491.
10) Merkle et al, 2017. Human pluripotent stem cells recurrently acquire and expand dominant negative P53 mutations // Nature 545, 229–233.
11) Rouhani et al, 2016. Mutational History of a Human Cell Lineage from Somatic to Induced Pluripotent Stem Cells // PLOS Genetics 12, e1005932.
12) Thompson et al, 2020. Low rates of mutation in clinical grade human pluripotent stem cells under different culture conditions // Nature Communications 11:1 (11), 1–14.
13) Yamanaka, 2020. Pluripotent Stem Cell-Based Cell Therapy-Promise and Challenges // Cell stem cell. 27, 523-531.
14) He et al, 2019. Variant Interpretation for Cancer (VIC): a computational tool for assessing clinical impacts of somatic variants // Genome medicine 11(1), 1–14.
Новость подготовили
© Вепа Абдыев и Андрей Рябинин
17.02.2022