 © Дьяконова Варвара Евгеньевна
доктор биологических наук, ведущий научный сотрудник,
лаборатория нейробиологии развития. Область научных интересов:
нейроэтология, нейробиология, нейротрансмиттеры, поведение.
© Дьяконова Варвара Евгеньевна
доктор биологических наук, ведущий научный сотрудник,
лаборатория нейробиологии развития. Область научных интересов:
нейроэтология, нейробиология, нейротрансмиттеры, поведение.
Связь состояния хроматина с когнитивными функциями остро обсуждается в самое последнее время. В этом отношении патогенез интеллектуальных способностей и возможности терапии при синдроме Кабуки особенно интересны. Синдром Кабуки это моногенное заболевание, вызванное мутациями в генах, связанных как раз с эпигенетической регуляцией работы генома, а именно в метилтрансферазе 2D, либо в деметилазе 6А. Оба белка независимо способствуют деконденсации хроматина, процессу, необходимому для экспрессии генов. Мутации в их генах приводят к дисбалансу открытого и закрытого состояния хроматина в сторону последнего и проявляются в тяжелых когнитивных нарушениях, сниженном нейрогенезе, замедлении развития и нарушении целого ряда других функций. В течение долгого времени синдром Кабуки относился к неизлечимым заболеваниям.
Если, действительно, ключевую роль в патогенезе синдрома Кабуки играет общее смещение баланса в сторону закрытия хроматина, то теоретически, активация противоположных механизмов, направленных на деконденсацию хроматина, могла бы привести к улучшению состояния (Fahrner, Bjornsson 2014). Относительно недавно на мышиной модели этого заболевания такой результат, действительно, был получен. В качестве инструмента деконденсации «переконденсированного» хроматина этих мышей использовали синтетический ингибитор деацетилазы гистонов (HDACi) AR-42 (Bjornsson HT, et al. 2014). Введение AR-42 привело к восстановлению уровня нейрогенеза и улучшению памяти.
Свежая работа этой группы, вышедшая в январе 2017 года в докладах национальной академии наук США (PNAS), приводит свидетельства того, что аналогичный эффект смещения баланса может быть достигнут и другим путем. При этом использовали всего лишь изменение рациона питания или так называемую кетоновую диету. Известно, что снижение содержания углеводов приводит к увеличению выработки эндогенного ингибитора деацетилазы гистонов, бета-гидроксибутирата, вызывающего расслабление участков хроматина за счет блокады действия деацетилазы. Контрольное, экзогенное введение бета-гидроксибутирата мышам с синдромом Кабуки, не подвергавшимся кетоновой диете, также повысило уровень нейрогенеза в гиппокампе и достоверно снизило дефицит пространственной памяти.
Эти исследования представляют большой интерес как для фундаментальной нейробиологии, так и для медицины. В последнем случае, впервые показаны терапевтические эффекты бета-гидроксибутирата и кетоновой диеты, причем в отношении считавшегося неизлечимым моногенного заболевания. Эффекты кетоновой диеты создают хорошие предпосылки для исследований на людях с синдромом Кабуки и другими генетически предопределенными интеллектуальными отклонениями. В отличие от введения искусственных химических соединений, регуляция пищевого рациона физиологичнее и безопасней.
С фундаментальной точки зрения, эти данные интересны тем, что хорошо согласуются с гипотезой о роли эпигенетической регуляции в когнитивных процессах. В частности, они подчеркивают значение общего баланса конденсации/деконденсации хроматина для взрослого нейрогенеза и механизмов памяти. Интересен вопрос о возможном биологическом смысле эффектов кетонов. Их выработка начинается при недостатке углеводов, что в естественных условиях может наблюдаться при умеренном голоде, переходе к хищничеству. Очевидно, что эти условия, действительно, требуют активации когнитивных способностей для решения задач, актуальных для выживания. С другой стороны, следует понимать, что открытие хроматина одновременно делает геном более уязвимым для различных мутагенных факторов, внешней и внутренней природы. К последним могут относиться, например, мобильные элементы, присутствие и роль которых в геноме мозга, в том числе человека, активно изучается (Ramesh et al., 2016; Brattås et al., 2017) .
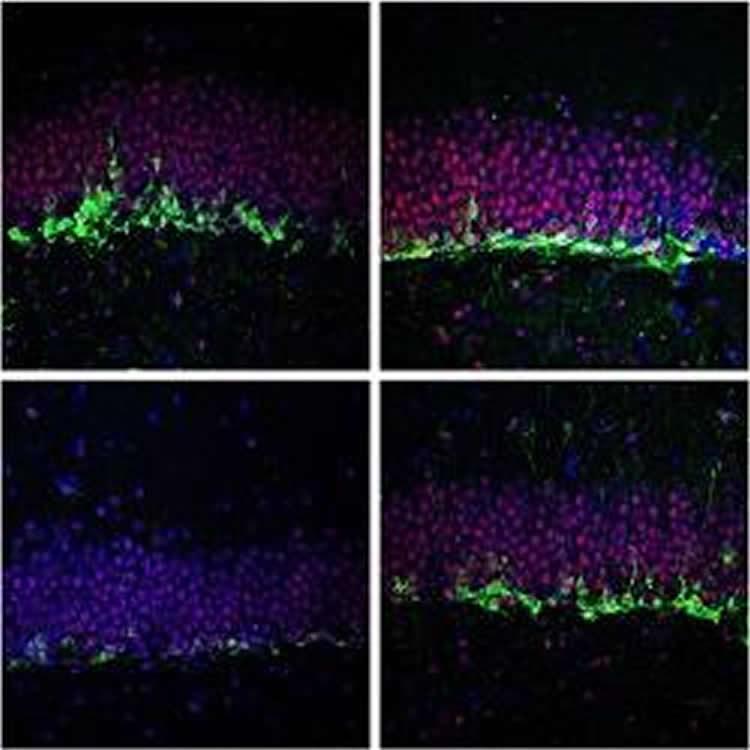 Новорожденные нейроны (зеленые) зубчатой фасции взрослых контрольных мышей (верхние фотографии) и мышей - генетической модели синдрома Кабуки (нижние фотографии, на обычной диете левые фотографии, и на кетоновой диете (правые фотографии). Из работы: Benjamin JS, Pilarowski GO, Carosso GA, Zhang L, Huso DL, Goff LA, Vernon HJ, Hansen KD, Bjornsson HT. A ketogenic diet rescues hippocampal memory defects in a mouse model of Kabuki syndrome. Proc Natl Acad Sci U S A. 2017 Jan 3;114(1):125-130. doi: 10.1073/pnas.1611431114. |
Литература:
- Fahrner JA, Bjornsson HT (2014) Mendelian disorders of the epigenetic machinery: tipping the balance of chromatin states. Annu Rev Genomics Hum Genet 15:269–293.
- Bjornsson HT, et al. (2014) Histone deacetylase inhibition rescues structural and functional brain deficits in a mouse model of Kabuki syndrome. Sci Transl Med 6(256):256ra135.
- Benjamin JS, Pilarowski GO, Carosso GA, Zhang L, Huso DL, Goff LA, Vernon HJ, Hansen KD, Bjornsson HT. A ketogenic diet rescues hippocampal memory defects in a mouse model of Kabuki syndrome. Proc Natl Acad Sci U S A. 2017 Jan 3;114(1):125-130. doi: 10.1073/pnas.1611431114.
- Ramesh V, Bayam E, Cernilogar FM, Bonapace IM, Schulze M, Riemenschneider MJ, Schotta G, Götz M. Loss of Uhrf1 in neural stem cells leads to activation of retroviral elements and delayed neurodegeneration. Genes Dev. 2016 Oct 1;30(19):2199-2212.
- Brattås P. L., Marie E. Jönsson, Liana Fasching, Jenny Nelander Wahlestedt, Mansoureh Shahsavani, Ronny Falk, Anna Falk, Patric Jern, Malin Parmar, Johan Jakobsson. TRIM28 Controls a Gene Regulatory Network Based on Endogenous Retroviruses in Human Neural Progenitor Cells. Cell Reports, 2017; 18 (1): 1 DOI: 10.1016/j.celrep.2016.12.010
Новость подготовила © 2016 Дьяконова В.Е.
17.01.2017