

© Ким Адамейко, младший научный сотрудник лаборатории биохимии процессов онтогенеза. Научные интересы: биоинформатика, транскриптомика, хроматин, беспозвоночные.
Junior research scientist Laboratory of Biochemistry. Interests: bioinformatics, transcriptomics, chromatin, invertebrates.
© Агния Соколова, младший научный сотрудник. Область научных интересов: развитие, систематика и морфология губок.
Технологии секвенирования индивидуальных клеток и сопутствующие биоинформатические методы, появившиеся в последнее десятилетие, углубили наше понимание механизмов дифференцировки клеточных типов и их взаимодействия, однако эволюционный аспект часто оставался за скобками. Чтобы исследовать происхождение клеточных типов животных, следует обратиться к их наиболее древним представителям. Научный коллектив под руководством Д. Муссера, Л. Мороза и Д. Арендта изучил клеточную номенклатуру пресноводной губки Spongilla lacustris (озёрная бадяга) и идентифицировал у неё генетические модули, характерные для нейронов и мышечных клеток.
Первопроходцами в секвенировании индивидуальных клеток базальных животных стали Себе-Педрос с соавторами в 2018 г. [1]. Объекты их исследования - морская губка Amphimedon queenslandica, пластинчатое Trichoplax adhaerens и гребневик Mnemiopsis leidyi. Однозначных выводов о том, какая из этих трех групп (Porifera, Placozoa или Ctenophora) наиболее эволюционно древняя, сделать вновь не удалось, однако были выявлены важные отличия в системе регуляции транскрипции этих животных. Клетки губки по профилям экспрессии генов образовывали 10 кластеров, которые хорошо группировались в три крупных семейства, соответствующих морфологии: хоаноциты (жгутиковые клетки, ответственные за ток воды и захват пищевых частиц), пинакоциты (покровные клетки) и археоциты (мезенхимальные стволовые клетки). В 2019 г. Согабе с соавторами [2] сравнили экспрессионные профили этих трёх семейств клеток Amphimedon queenslandica с таковыми у одноклеточных эукариот. Оказалось, что несмотря на морфологическое сходство, к одноклеточным хоанофлагеллятам транскрипционно ближе археоциты, а не хоаноциты.
Муссер и соавторы вывели номенклатуру клеточных типов губки на новый уровень, получив экспрессионные данные для приблизительно 10 тысяч клеток губки Spongilla lacustris, что втрое больше, чем в работе 2018 г (данные для двух столь разных видов губок, тем не менее, неплохо дополняют друг друга). Благодаря такому разрешению удалось идентифицировать 42 кластера (рис. 1А), из которых 18 соответствовали морфологически различным клеточным типам (пять из них описаны впервые), а остальные представляли собой клетки на разных этапах дифференцировки. К основным трём семействам (эндимоциты – пинакоциты и другие клетки, ассоциированные с покровами тела, пептидоциты – хоаноциты и их родственники, археоциты – стволовые клетки) добавилось амебоидно-нейроидное семейство. Его представители, вероятно, выполняют регуляторную и иммунную функции. Подробнее о новых типах можно прочитать в заметке на “Элементах” [3]. Авторы исследовали иерархию клеточных типов с помощью различных статистических и биоинформатических методов (Рис. 1Б, В). В работе Согабе была доказана возможность трансдифференцировки хоаноцитов через археоциты в другие клеточные типы губок; интересно, что полученная Муссером иерархия допускает эту возможность.
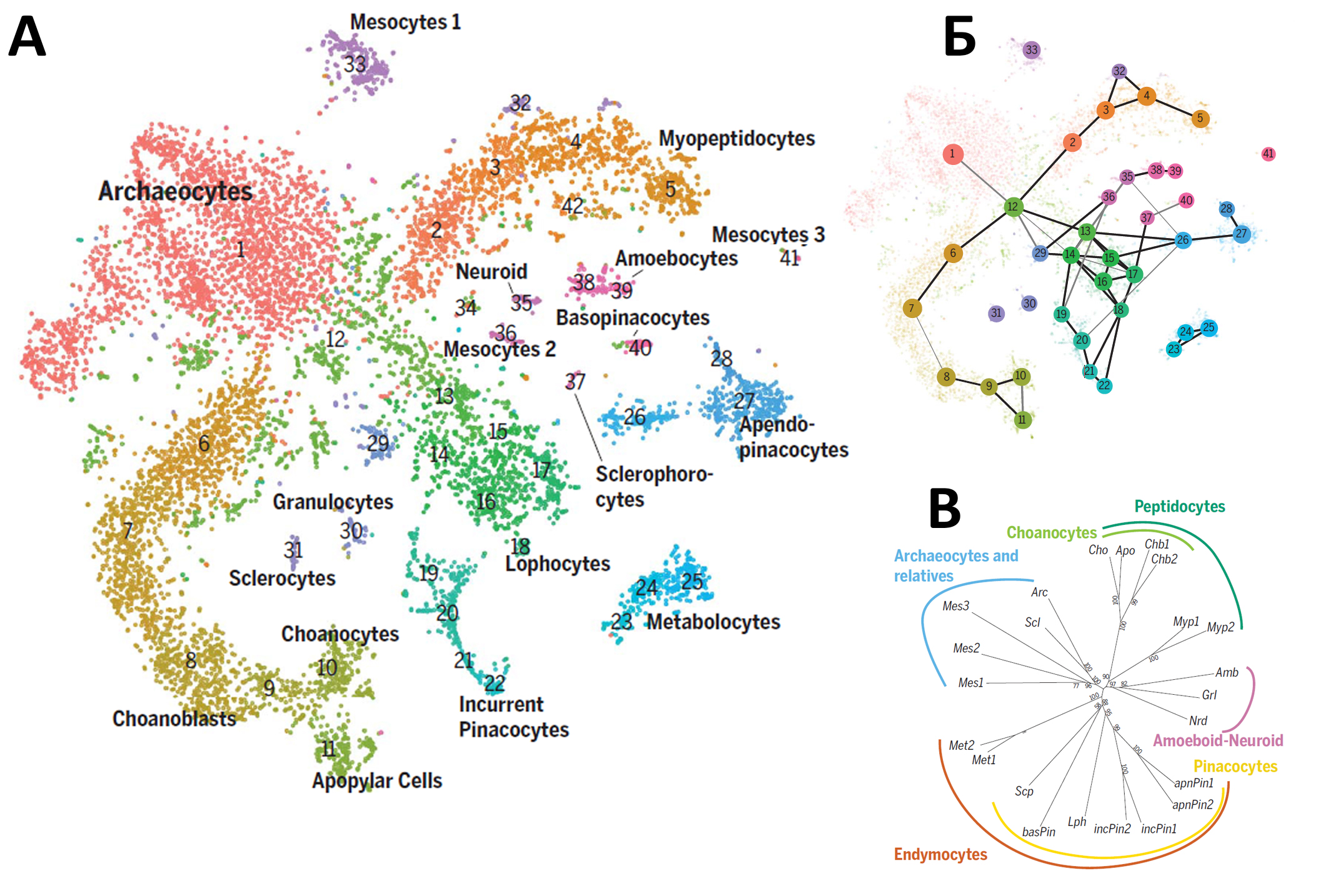
Рис. 1. A – Кластеризация экспрессионных профилей индивидуальных клеток озёрной бадяги (в координатах tSNE). Подписаны 18 клеточных типов, наиболее удалённых на графике друг от друга, остальные номера соответствуют переходным состояниям. Б – Возможные связи между кластерами согласно методу PAGA. Жирность линии соответствует силе связи. В – Филогенетическое дерево клеточных типов согласно методу присоединения соседей.
Авторы оперируют понятием генетического модуля – набора корегулируемых генов (т.е. генов, которые регулируются общими транскрипционными факторами, ТФ), составляющих функциональную единицу любой клеточной системы. Выявление таких типо-специфичных модулей и соответствующих им ТФ может помочь приблизиться к решению фундаментального вопроса происхождения клеточных типов. Особый акцент в работе сделан на «нервный» модуль. Исследователи обнаружили, что некоторые гены, которые у высших животных характеризуются как постсинаптические, активно экспрессируются в хоаноцитах. Сам по себе этот факт неудивителен, т. к. клетки губок постоянно взаимодействуют друг с другом. Однако похоже, что хоаноциты особым образом контактируют со специфическими «центральными» клетками, располагающимися внутри хоаноцитных камер (рис. 2А). В этих клетках была обнаружена экспрессия генов, соответствующих у высших животных пресинаптическим. Авторы дали этим клеткам новое название «нейроидные».
В работе приведены высочайшего качества изображения шарообразных хоаноцитных камер, на которых можно увидеть взаимное расположение хоаноцитов и нейроидных клеток (рис. 2Б). Снабженные тонкими выростами, направленными к воротничку хоаноцитов, нейроидные клетки как будто обволакивают микровилли, а иногда и жгутик. На ультратонких срезах этих клеток можно наблюдать многочисленные митохондрии и везикулы, а в профилях экспрессии обильно представлены гены везикулярного транспорта. Стоит отметить, что у хоаноцитов губок класса Demospongiae, к которым относится бадяга, жгутик бьётся непрерывно, и про регуляцию пищедобывательной активности этих клеток пока ничего неизвестно. В отличие от хоанобласта стеклянных губок класса Hexactenilida, чьи жгутики могут прерывать работу в ответ на условия среды, демоспонгии регулируют ток воды через тело путём сокращения каналов и отверстий водоносной системы. Способны ли нейроидные клетки действительно модулировать работу хоаноцитов напрямую – покажут будущие эксперименты.
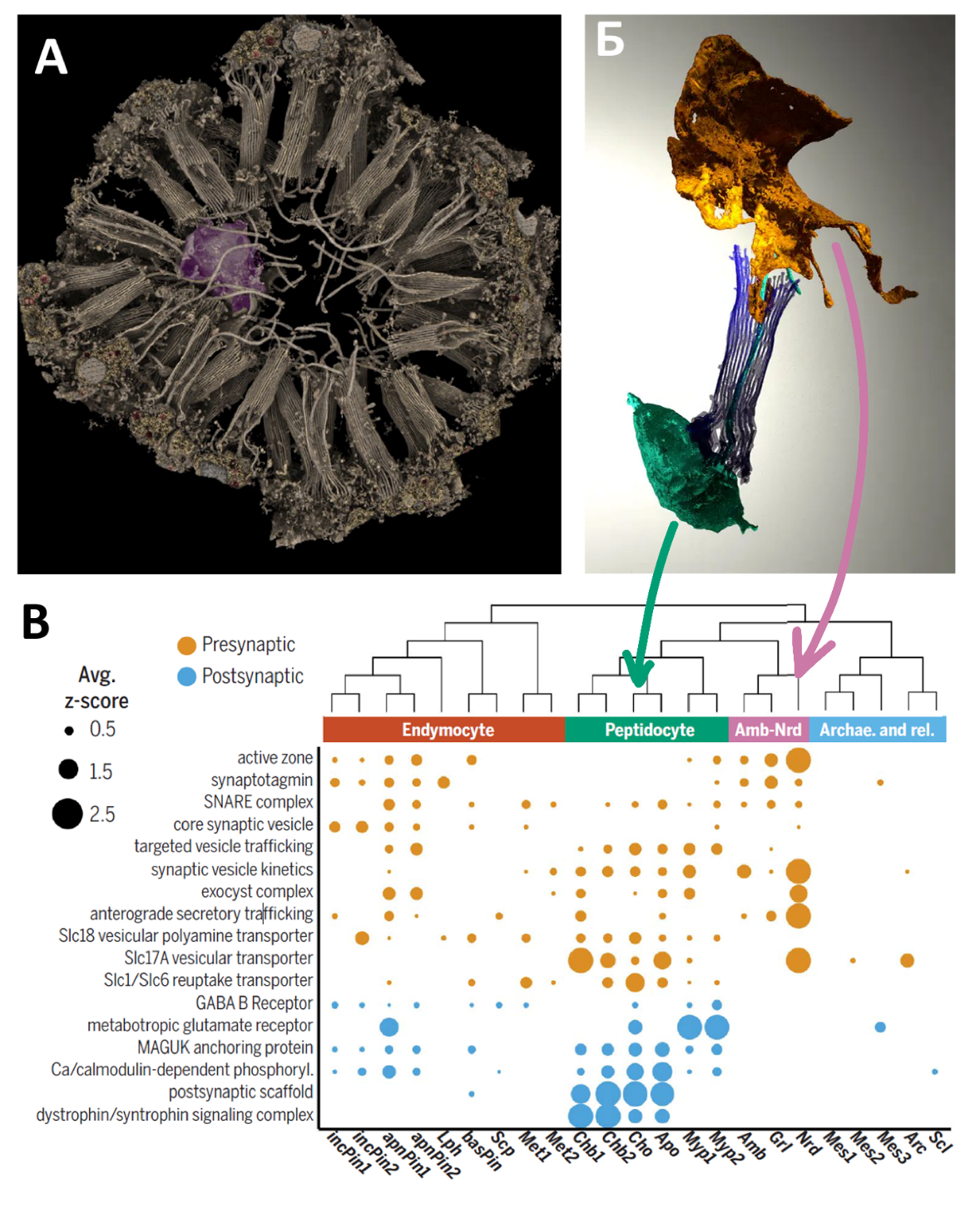
Рис. 2. А – хоаноцитная камера с нейроидной клеткой внутри (окрашена фиолетовым). Б – нейроидная клетка, контактирующая с воротничком хоаноцита. В – профиль экспрессии синаптических и постсинаптических генов в разных клеточных типах бадяги. Стрелки указывают положение на схеме хоаноцитов и нейроидных клеток.
Рассматривая систему взаимодействия этих клеток, сложно избежать аналогии с синапсами, формирующимися между нейронами животных с настоящей нервной системой. Однако во избежание излишне громких сопоставлений, необходимо иметь в виду ряд моментов. 1) Нейроидные клетки и хоаноциты не демонстрируют непосредственного физического контакта, поэтому о направленной передаче «клетка-клетка» пока не может идти речи. Зато можно предположить, что между этими клетками имеет место эволюционно древняя объёмная передача (volume transmission), при которой на сигнальную молекулу реагируют все клетки, имеющие соответствующие рецепторные компетенции. 2) Нам неизвестно, как именно используются нейрональные гены у губок. Многие из них не эксклюзивны для нейронов. Более того, в ДНК губок отсутствуют гены некоторых ключевых ионных каналов, необходимых для создания потенциала действия – резкого электрического сигнала, который стимулирует высвобождение нейротрансмиттеров в нейронах. 3) Постсинаптический и пресинаптический набор
экспрессирующихся генов – не уникальное свойство нейроидных клеток и хоаноцитов: и те, и другие гены работают также в других клеточных типах бадяги (рис. 2В). Характерной особенностью скорее является отсутствие в нейроидных (и амебоидных) клетках экспрессии постсинаптических генов, что может указывать на односторонний сигналинг.
Тот факт, что генетические модули, отвечающие за отправляющий и принимающий концы системы межклеточного взаимодействия, представлены в различных типах клеток губок, важен для понимания возможных вариантов перехода к более сложноустроенной системе клеточного взаимодействия. Используя одни и те же консервативные нейрональные гены, разные клеточные линии ранних многоклеточных животных могли многократно и независимо дать начало настоящим нейронам.
Любопытно, что одним из ТФ, наиболее сильно экспрессирующихся в нейроидных клетках, является деацетилаза гистонов HDAC 1/2, важная роль которой для реагрегации клеток губки Halisarca dujardinii была показана в недавнем исследовании коллектива авторов из ИБР РАН [4].
При изучении «нервного модуля» невольно возникает вопрос – какими же молекулами обмениваются клетки губок? Кандидатов на эту роль не так много. Наиболее вероятные – оксид азота NO, глутамат и ГАМК. Ранее для них было экспериментально показано влияние на жизнедеятельность губки [5, 6], а в обсуждаемой статье приведены убедительные видеосвидетельства влияния NO на пульсацию водоносной системы. В транскриптомах бадяги содержится инструментарий для метаболизма этих молекул, однако он неполный – как и в случае с другими сигнальными веществами (например, адреналином). Так, в исследованных клетках был неактивен ген глутаматдекарбоксилазы, катализирующей превращение глутамата в ГАМК.
Несомненным достоинством работы является подтверждение биоинформатических результатов экспериментальными методами. Так, авторы выявили специфичные для клеточных типов экспрессирующиеся гены и визуализировали эти типы в целом организме с помощью флуоресцентной гибридизации молекул РНК (smFISH) (рис. 3).
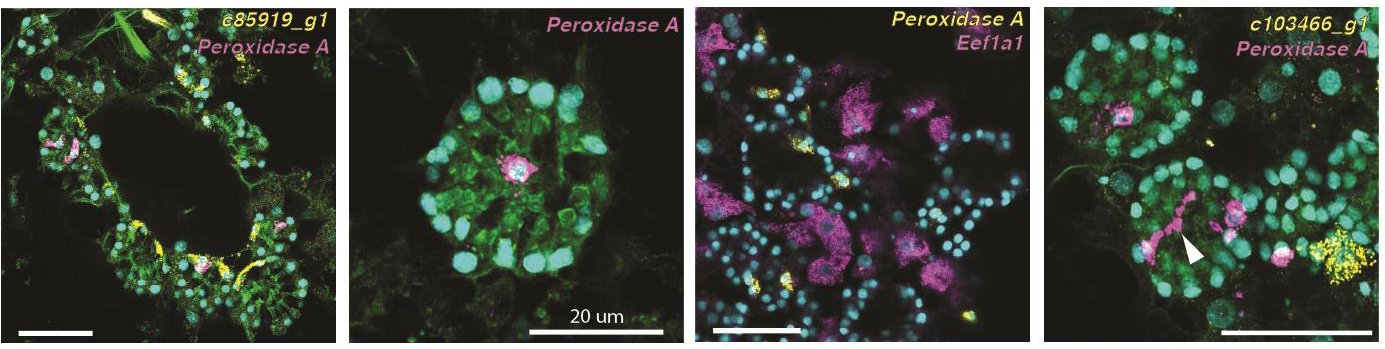
Рис. 3. Результаты smFISH гибридизации специфичных генов на примере нейроидных клеток. Маркер нейроидных клеток: Peroxidase A, маркер археоцитов: Eef1a1, маркер апопилярных клеток (окружают выход из жгутиковой камеры): c85989_g1, маркер амёбоцитов: c103466_g1. Стрелка на панели справа указывает на длинные филоподии нейроидной клетки.
За последние несколько лет губки сменили звание примитивных, слабо интегрированных «протоживотных» на статус крайне самобытной группы, только сейчас раскрывающей секреты своей организации, поведения и способностей. Наличие у губок консервативных нейрональных модулей означает, что генетическая основа для дифференциации нейронов сформировалась значительно раньше, чем сама нервная система. То же справедливо и для мышечной системы, т. к. объёмные сократительные модули были показаны для эндимоцитов бадяги. Работа коллектива Муссера, Мороза Арендта представляет собой образец альянса самых современных биологических методов, а её результаты – кладезь интересной информации для любого эволюционного биолога.
Литература[1] Sebé-Pedrós, A., Chomsky, E., Pang, K. et al. (2018). Early metazoan cell type diversity and the evolution of multicellular gene regulation. Nature Ecology & Evolution 2, 1176–1188. https://doi.org/10.1038/s41559-018-0575-6
[2] Sogabe, S., Hatleberg, W.L., Kocot, K.M. et al. (2019). Pluripotency and the origin of animal multicellularity. Nature 570, 519–522. https://doi.org/10.1038/s41586-019-1290-4
[3] А. Марков. У губок найдены вероятные эволюционные предшественники нейронов и миоцитов. “Элементы”, 08.11.2021. https://elementy.ru/novosti_nauki/433891/
[4] Кравчук, О.И., Бураков, А.В., Горностаев, Н.Г. и др. (2021). Деацетилазы гистонов в процессе реагрегации клеток губки Halisarca dujardinii. Онтогенез 52 (5), 319–333, https://doi.org/10.31857/S0475145021050050
[5] Ellwanger, K., Eich, A. Nickel, M. (2007). GABA and glutamate specifically induce contractions in the sponge Tethya wilhelma. Journal of Comparative Physiology A 193, 1–11.
[6] Elliott, G. R., Leys, S. P. (2010). Evidence for glutamate, GABA and NO in coordinating behaviour in the sponge, Ephydatia muelleri (Demospongiae, Spongillidae). Journal of Experimental Biology 213(13), 2310–2321.
Новость подготовили ©Ким Адамейко, Агния Соколова
16.11.2021