
Область интересов: дифференцировка плюрипотентных стволовых клеток, микрофлюидика, живые эквиваленты кожи, кожные органоиды.
Волосяные фолликулы (ВФ) являются производными кожи, участвующими в ее развитии и гомеостазе. Среди производных кожи, которые могут быть получены в лабораторных условиях, в рамках получения ВФ достигли наилучших результатов. У млекопитающих ВФ отвечают за формирование, рост и развитие стержней волоса, которые, в свою очередь, обеспечивают терморегуляцию, сенсорную информацию, защиту от внешних воздействий и важны для социальной коммуникации [1; 2]. Клетки дермальной папиллы (DPCs) расположены в основании ВФ, где они контролируют развитие и цикл ВФ и участвуют в поддержании его гомеостаза [3].
Происхождение DPCs в эмбриогенезе человека различается в зависимости от района кожи, в котором они формируются. Краниальные и лицевые DPCs в составе ВФ происходят из клеток нервного гребня, а дорсальные и вентральные DPCs развиваются из дермомиотома сомитов и боковых пластинок [4]. Однако из-за биоэтических ограничений процесс дифференцировки клеток нервного гребня в DPCs, а также промежуточные этапы дифференцировки в морфогенезе кожи человека изучены недостаточно хорошо [4].
Важным инструментом в современной биологии развития, регенеративной медицине и моделировании генетических заболеваний являются индуцированные плюрипотентные клетки человека (hiPSCs) [5, 6]. На сегодняшний день разработано несколько протоколов, позволяющих напрямую дифференцировать hiPSCs в DPCs [7; 8]. В недавних исследованиях также сообщалось о получении аутологичных двухкомпонентных живых эквивалентов кожи (ЖЭК) из полученных из hiPSC фибробластов и кератиноцитов [9; 10]. Кроме того, при помощи DPCs и кератиноцитов можно создавать модели эпителиально-мезенхимных взаимодействия между кератиноцитами и клетками ДП в органогенезе кожи (11). Нашими главными задачами было получение клеток DPCs из hiPSCs и исследование их потенциала в качестве дермального эквивалента в ЖЭК, поскольку ДП участвуют в регенерации волосяных фолликулов и развитии кожи, а также стабильно пролиферируют в культуре и анализ траектории дифференцировки hiPSCs-NPCs в hiPSCs-DPCs.
В ходе нашего исследования мы получили DP-подобные клетки из hiPSCs при помощи двухстадийной дифференцировки hiPSCs. На первой стадии при помощи двойного SMAD- ингибирования были получены нейтральные стволовые прогениторные клетки (hiPSC-NPCs). На второй стадии hiPSC-NPCs дифференцировали в клетки дермальной папиллы (hiPSCs-DPCs) и верифицировали их фенотип при помощи иммуноцитохимического выявления маркеров и ПЦР в реальном времени.
В результате на основе высокого уровня экспрессии гладкомышечного актина, версикана, виментина, фибронектина, S100A4, Cd133 и пониженного уровня экспрессии Sox2, нестина, nanog и β-III-тубулина у полученной в ходе дифференцировки клеточной линии был подтвержден целевой фибробластоподобный фенотип (рис. 1С;D;E). Также необходимо отметить изменение морфологии в ходе дифференцировки. На финальной стадии клетки приобрели характерный для клеток DP веретеновидный фенотип с относительно недлинными отростками и большим ядерно- цитоплазматическим отношением (рис. 1А).
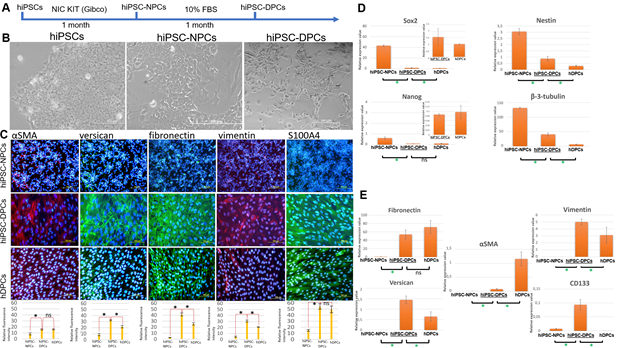
Рис. 1. Морфология и экспрессия маркеров hiPSC-DPCs.
A. Схема дифференцировки hiPSCs в hiPSC-DPCs.
B. HIPSCS на разных стадиях дифференцировки в ДП-подобные клетки. 1A: фазовый контраст. Масштабная линейка: 200 мкм на левом и правом изображениях и 400 мкм в центре.
C. Иммунофлуоресцентное определение маркеров ДПК (версикан, αSMA, S100A4, фибронектин и виментин) в hiPSC-NPCs (отрицательный контроль), hiPSC-DPCs (экспериментальная группа) и hDPCs (положительный контроль). Масштабная линейка: 100 и 200 мкм. Ниже: Интенсивность флуоресценции версикана, αSMA, S100A4, фибронектина и виментина в hiPSC-NPCs, hiPSC-DPCs и hDPCs. Шкала - относительная величина; *p ≤ 0,05; ns - не значимо; p ≥ 0,05, тест Манна-Уитни.
D. Уровни экспрессии маркеров плюрипотентности (Sox2, Nanog) и NPC (Sox2, Nestin, β-тубулин III) в hiPSCs (отрицательный контроль 1), hiPSC-NPCs (отрицательный контроль 2), hiPSC-DPCs (экспериментальная группа) и hDPCs (положительный контроль), полученные методом qPCR. *p ≤ 0,05; ns - non significane; p ≥ 0,05, Mann-Whitney test.
E. Уровни экспрессии маркеров фибробластов - фибронектина, виментина, версикана, αSMA и CD133 - в hiPSCs (отрицательный контроль 1), hiPSC-NPCs (отрицательный контроль 2), hiPSC-DPCs (экспериментальная группа) и hDPCs (положительный контроль) с помощью qPCR. *p ≤ 0,05; ns - non significane; p ≥ 0,05, Mann-Whitney test.
Также целевой фенотип полученной клеточной линии был подтвержден в ходе ряда функциональных тестов на эпителиально-мезенхимные взаимодействия с кератиноцитами человека: формирование двухслойного ЖЭК; формирование сфероидов, имитирующих ранние стадии фолликулогенеза; тест на тубулогенез. Все тесты дали положительный результат. С результатами этих тестов можно ознакомиться в полном тексте статьи.
Для того, чтобы изучить дифферон клеток нервного гребня в эмбриогенезе, мы проанализировали траекторию дифференцировки hiPSC-NPCs в 4 временных точках (W_2 – 2 недели дифференцировки; W_4 – 4 недели дифференцировки; W_6 – 6 недель дифференцировки; W_8 – 8 недель дифференцировки) при помощи Bulk RNA-секвенирования. Данная модель является относительной репрезентативной, поскольку NPCs являются близкими аналогами клеток нервного гребня. В ходе этого анализа мы сумели подтвердить формирование субпопуляции клеток, близких к нейрально-мезенхимным бипотентным прогениторным клеткам, описанным Солдатовым и др. в 2019 (рис. 2А). Сходство W_2 с бипотентными прогениторами подтверждалось повышением экспрессии TWIST1, PRRX2, PRRX1 и PHOX2B (рис. 2Е). Снижение экспрессии маркеров вегетативных нейронов (ASCL1 и PHOX2B) и повышение экспрессии глиальных (EGFLAN, MSTN, GFAP) и мезенхимальных (TWIST1, PRRX1, FLI1, SIX2, FOXC1) маркеров на W_4-W_8 свидетельствует о том, что нейрально-мезенхимных предшественники дифференцируются в глиальные и мезенхимных клетки после второй недели дифференцировки (рис. 2Е). Эти изменения также коррелировали с морфологическими изменениями и образованием нейронов в W_2, которые не наблюдались в W_4. Терминальный фенотип hiPSC-DPCs был сходен с таковым у hDPCs (рис. 2D). Примечательно, что все вегетативные глиальные маркеры экспрессировались как в hDPCs, так и в клетках W_8 (рис. 2E). Возможно, что некоторые глиальные субпопуляции сохраняются в эмбриональной и взрослой нише ДП. Паттерны экспрессиии генов hDPCs (CD44, APCDD1L, VCAM, ACTA2, MFAP5) в hiPSCs-DPCs, а также сходные уровни экспрессии генов бипотентных прогениторов между hiPSC-DPCs и положительным контролем (hDPCs) могут быть интерпретированы как формирование субпопуляции ДП-подобных клеток на стадиях дифференцировки W_6 и W_8 (рис. 2E).
Для лучшего понимания фенотипической пластичности DP-подобных клеток в процессе дифференцировки и верификации результирующей клеточной линии был проведен анализ экспрессии генов нейронов, фибробластов, эмбриональных и зрелых DPCs. Анализ показал, что в hiPSC-NPCs (отрицательный контроль) по сравнению с клетками W_8 происходит снижение экспрессии нейральных генов (PAX6, TUBB3, NESTIN, GLDC, SOX2, MAP2, SLC2A4) и повышение экспрессии генов фибробластов (VCAN, FN1, S100A4, CD44 и др.) (рис. 2E и 2F). Примечательно, что большинство генов, экспрессирующихся в эмбриональных и зрелых DPCs (BMP4, BMP7, WNT5A, MEGF11, LPL, COL23A1, BAMB1 и EDN3), достигали максимального уровня экспрессии в клетках W_2 (рис. 2F). Изменения в экспрессии генов коррелировали с наблюдаемым преобразованием морфологии (рис. 2D). Кроме того, по временным изменениям экспрессии генов клетки W_2 отличались от контрольной и остальных экспериментальных групп, а клетки W_4, W_6 и W_8 были в основном идентичны и более схожи с клетками положительного контроля (hDPCs), чем клетки W_2 (рис. 2В и 2С). Таким образом, данный анализ демонстрирует сходство между развитием нервного гребня мыши (для дифферона которого и были определены ключевые маркеры, экспрессия которых анализировалась в данной работе) и дифференцировкой in vitro нервного гребня человека в DP-подобные клетки. Паттерн экспрессии ключевых маркеров в DP-подобных клетках (W_8) сходен с таковым в hDPCs, но не идентичен.
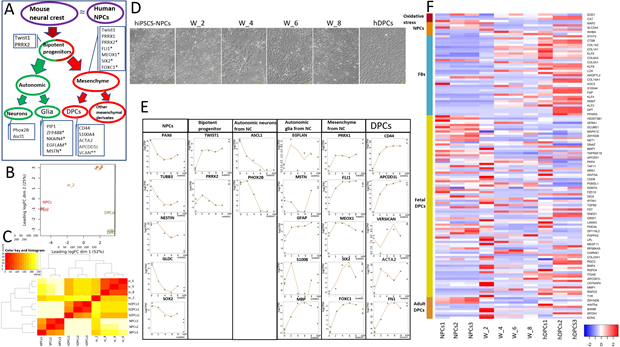
Рис. 2. Анализ данных РНК-секвенирования объемных hiPSC-DPC в нескольких временных точках
дифференцировки.
A. Схема, показывающая траекторию дифференцировки клеток нервного, которые являются предшественниками DPCs, в ходе эмбриогенеза мыши [18].
B. Тепловая карта иерархической кластеризации матрицы евклидовых расстояний значений log2(CPM) для всех образцов (NPCs 1-3 [отрицательный контроль], hiPSC-DPCs после 2, 4, 6 и 8 недель дифференцировки и DPCs 1-3 [положительный контроль]).
C. Многомерное шкалирование, показывающее вариабельность между репликами и различными методами лечения по log2 fold change (log2FC) расстояния (log2FC 500 лучших генов).
D. Фазово-контрастные изображения, демонстрирующие изменение морфологии клеток в процессе дифференцировки hiPSC. Масштабная линейка: 200 мкм (левое и правое изображения); 400 мкм (центр).
E. Точечные диаграммы для отдельных групп генов, отражающие профили экспрессии генов NPCs, бипотентных предшественников, вегетативных нейронов, вегетативной глии, мезенхимальных стволовых клеток, происходящих от нервного гребня, и маркеров DPCs. Точками показаны фактические значения экспрессии для каждого образца. Линии: значения, найденные с помощью GLM; *специфические маркеры для несмещенной кластеризации; **некоторые неспецифические маркеры фибробластов с высокой экспрессией в hDPCs.
F. Тепловая карта, иллюстрирующая экспрессию дифференциально экспрессирующихся генов на основе RNA-seq сравнения между NPCs 1-3 (отрицательный контроль), hiPSC-DPCs после 2, 4, 6 и 8 недель дифференцировки и hDPCs 1-3 (положительный контроль). В столбцах указаны образцы, а в строках - гены с повышенной (красный цвет) и пониженной (синий цвет) экспрессией.
Для дальнейшей оптимизации протокола дифференцировки и анализа эпителиально- мезенхимальных взаимодействий мы оценили динамику экспрессии нейрональных и специализированных маркеров в DP-подобных клетках в процессе дифференцировки. Другой задачей было выявление стадии дифференцировки, наиболее чувствительной к взаимодействию с кератиноцитами. Для этого было разработана модель, состоящая из двух частей. В первой группе клетки дифференцировали в соответствии с нашим стандартным протоколом. Во втором - клетки дифференцировались в системе с мембранными вставками вместе с кератиноцитами человека в течение 4 дней (рис. 3А). Затем мы использовали иммуноцитохимический анализ для оценки экспрессии маркеров пролиферации (KI67), нейральных (β-3-тубулин, GFAP) и дермальных клеток (версикан, α-SMA и виментин) в контроле и в условиях совместного культивирования на стадиях W_2; W_4; W_6и W_8. Экспрессия GFAP, глиального маркера, и β-3-тубулина, маркера незрелых нейронов, была обнаружена только в отрицательном контроле и в W_2 как в контроле, так и в условиях совместного культивирования, за исключением положительной экспрессии β-3- тубулина на 56-й дне дифференцировки. При совместном культивировании DP-подобных клеток с кератиноцитами человека нейральная дифференцировка подавлялась, а количество β-3-тубулин+ клеток было значительно ниже, чем в контроле. (рис. 3В; рис. S6). Однако, без сокультивирования, hiPSC-NPCs и hiPSC-DPCs через 2 недели дифференцировки были способны образовывать нейроны, экспрессирующие β-3-тубулин (рис. 3В). Кроме того, экспрессия гладкомышечного актина через 14 и 28 дней дифференцировки и версикана через 14 дней дифференцировки была значительно выше в условиях сокультивирования с кератиноцитами по сравнению с контролем (рис. 3В; рис. S6). Динамика экспрессии всех дермальных маркеров изменялась в одинаковой степени, за исключением более высокой экспрессии версикана, наблюдавшейся через 6 недель дифференцировки в контроле по сравнению с условиями сокультивирования. Других существенных различий, основанных на иммуногистохимии, не наблюдалось (рис. 3В; рис. S6).
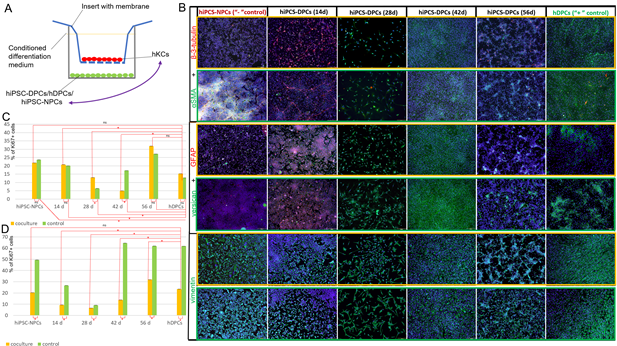
Рис. 3. Влияние совместного культивирования на hiPSC-DPCs и первичные кератиноциты человека.
А. Схема дифференцировки hiPSCs в DPCs при сокультивировании.
B. Иммуногистохимическое определение с помощью флуоресцентной микроскопии α-SMA, β-3-тубулина, GFAP, версикана и виментина в одних hiPSC-DPC (обведено зеленой рамкой) и в условиях сокультивирования с кератиноцитами (обведено оранжевой рамкой). Масштабная линейка: 200 мкм.
C. Доля пролиферирующих клеток при дифференцировке в DPCs в контроле и при совместном культивировании с кератиноцитами в течение 4 дней. *статистически значимая разница; p < 0,05.
D. Доля пролиферирующих кератиноцитов (Ki67+) в контроле и при совместном культивировании с дифференцирующимися hiPSC-DPCs. * статистически значимая разница; p < 0,05; ns - non significane; p ≥ 0,05.
Если обобщить все полученные результаты, можно утверждать, что разработанный нами протокол дермальной дифференцировки hiPSC-NPC позволил получить клеточную линию с характеристиками молодых фибробластов, экспрессирующих маркеры DPCs и индуцирующих ранние стадии фолликулогенеза in vitro. Полученные hiPSC-DPC взаимодействовали с кератиноцитами при формировании органоидов в ЖЭК, инициировали тубулогенез и интегрировались в органоиды в культурах висячей капли, повторяя ранние стадии фолликулогенеза. Кроме того, в клетках W_6 и W_8 наблюдалась экспрессия маркеров фетальных и взрослых DPCs. Также новой информацией является тот факт, что hiPSC-NPC дифференцировались в DP-подобные клетки через промежуточный тип клеток, который был похож на бипотентный нейрально-мезенхимальный прогенитор, наблюдаемый при развитии нервного гребня мыши. В заключение необходимо отметить, что нами были получены библиотеки RNA-seq на 5 различных точках дифференцировки. Эти данные могут быть в дальнейшем использованы для изучения механизмов и сигнальных путей, лежащих в основе дифференцировки клеток нервного гребня.
Список использованной литературы:
- Stenn, K.S., Paus, R. (2001). Controls of hair follicle cycling. Physiological Reviews 81, 449–494.
- Zhang, L. (2018). Keratins in skin epidermal development and diseases. Intechopen 5, 65–81.
- Goodier, M., Hordinsky, M. (2015). Normal and aging hair biology and structure ‘aging and hair’. Alopecias – Practical Evaluation and Management. Current problems of dermatology 47, 1–9.
- Collins, C. A., Jensen K.B., MacRae, E. J., Mansfield, W., Watt F. M. (2012). Polyclonal origin and hair induction ability of dermal papillae in neonatal and adult mouse back skin. Developmental Biology 366, 290–297.
- Qu, Ying & Yucer, Nur & Garcia, Veronica & Giuliano, Armando & Cui, Xiaojiang. (2018). hiPSC-Based Tissue Organoid Regeneration. DOI: 10.5772/intechopen.76997
- Passier, R., Orlova, V., Mummery, C. (2016). Complex Tissue and Disease Modeling using hiPSCs. Cell Stem Cell 18, 309-321.
- Gnedeva, K., Vorotelyak, E., Cimadamore, F., Cattarossi, G., Giusto, E., Terskikh, V.V., Terskikh, A.V. (2015). Derivation of Hair-Inducing Cell from Human Pluripotent Stem Cells. PLoS ONE 10, 1–16.
- Veraitch, O., Mabuchi, Y., Matsuzaki, Y., Sasaki, T., Okuno, H.,Tsukashima, A., Amagai, M., Okano, H., Ohyama, M. (2017). Induction of hair follicle dermal papilla cell properties in human induced pluripotent stem cell-derived multipotent LNGFR(+)THY)-1(+) mesenchymal cells. Scientific Reports 21, e42777.
- Guo, Z., Higgins, C.A., Gillette, B.M., Itoh, M., Umegaki, N., Gledhill, K., Sia, S.K., Christiano, A.M. (2013). Building a microphysiological skin model from induced pluripotent stem cells. Stem cell research and therapy 4, 1–15.
- Itoh, M., Umegaki-Arao, N., Guo, Z., Liu, L., Higgins, C.A., Christiano, A.M. (2013). Generation of 3D Skin Equivalents Fully Reconstituted from Human Induced Pluripotent Stem Cells (iPSCs). PLoS One 8, e77673.
- Driskell, R.R., Clavel, C., Rendl, M., Watt, F.M. (2011). Hair follicle dermal papilla cells at a glance. Journal of Cell Science 124, 1179–1182.
- Chermnykh, E., Vorotelyak, E., Gnedeva, K., Moldaver, M., Yegorov, Y., Vasiliev, A., Terskikh, V. (2010). Dermal papilla cells induce keratinocyte tubulogenesis in culture. Histochemistry and cell biology 133, 567–576.
Новость подготовил
© А.Рябинин
16.10.2023