Комментарий к статье Hoang T., Wang J., Boyd P., et al. «Gene regulatory networks controlling vertebrate retinal regeneration». Science, 2020, V. 370, N 6519, eabb8598. DOI: 10.1126/science.abb8598
 © Григорян Элеонора Норайровна,
главный научный сотрудник лаборатории проблем регенерации. д.б.н.
© Григорян Элеонора Норайровна,
главный научный сотрудник лаборатории проблем регенерации. д.б.н.Область научных интересов: клеточные и молекулярные механизмы регенерации органов и тканей у позвоночных животных.
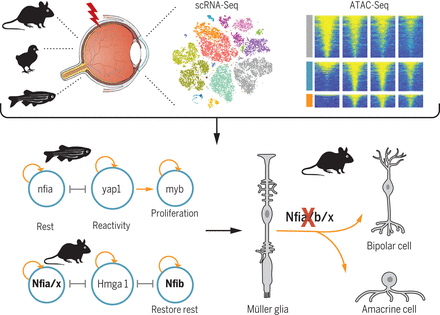
Статья «Gene regulatory networks controlling vertebrate retinal regeneration», представленная коллективом из 26 соавторов из ряда научных центров США и опубликованная в журнале Science в конце 2020, является новым шагом в понимании того, какие ключевые молекулярные различия определяют возможность регенерации сетчатки у рыб, и ее отсутствие у млекопитающих. В качестве животных моделей выбраны рыбка «полосатик» (zebrafish) и мышь, а модели регенерации сетчатки – регенераторный ответ на повреждение сетчатки глиальных клеток Мюллера (МГ), завершающийся продукцией ими новых ретинальных нейронов. У рыб активированные повреждением клетки МГ входят в пролиферативную фазу, а затем претерпевает конверсию в нейральном направлении, в то время как у мышей их молекулярно-генетическая регуляционная сеть запрещает репрограммирование и удерживает клетки в исходном состоянии глиальной дифференцировки.
Эти модели и потенциальный клеточный источник восстановления сетчатки (МГ) широко известны и активно эксплуатируются исследователями в настоящее время как наиболее многообещающие (Hamon et al., 2016; Jorstad et al., 2017; Dvoriantchikova et al., 2019). По этой причине достаточно хорошо изучены биология и поведение клеток МГ, а также контролирующие их у животных разных классов, молекулярные регуляционные сети. Это послужило основой для проведенного Hoang et al. (2020) более глубокого, современного сравнительного исследования.
Для изучения состояния клеток Мюллера после повреждения сетчатки авторами были применены широкое РНК секвенирование (RNA-seq), а также эссей, выявляющий транспозаза-доступный хроматин, с последующим высокоразрешающим его секвенированием (ATAC-sec). Этот подход позволял одновременное определение профилей экспрессии генов и доступность хроматина для считывания для клеток МГ рыб и мышей. В исследовании учтены разные этапы регенерационного ответа клеток: быстрого – сразу после повреждения сетчатки и отсроченного, в период образования новых нейронов у рыб и возврата к исходному фенотипу МГ мышей. Сетчатку повреждали двумя способами: цитотоксином NMDA и с помощью облучения ярким светом. Воздействие NMDA приводило к разрушению внутренней сетчатки (интернейроны и ганглиозные клетки), тогда как свето-облучение разрушало ретинальный фоторецепторный слой.
Помимо этого, после воздействия двумя указанными видами повреждения, а также при обработке экзогенными факторами (из ряда модификаторов клеточного поведения, не связанных с повреждением сетчатки), было проведено секвенирование РНК отдельных клеток (scRNA-seq). В этой части исследования репрограммирование клеток Мюллера было изучено на моделях сетчатки рыбы, цыпленка и мыши.
В дополнение в исследовании Hoang et al. (2020) были разработаны необходимые компьютерные программы, помогающие объединить все полученные в разных сериях и всеми приведенными методами сведения. В итоге это дало возможность воссоздать картину изменений внутриклеточных регуляторных молекулярных сетей при динамических их изменениях (IReNA). В завершение исследования с помощью метода “loss-of-function” (создания мутаций определенных генов, приводящих к потере их функции) были определены роль и значение каждого из выбранных ключевых кандидатов, претендующих служить контролером и регулятором конверсии клеток МГ.
В ходе работы было получено 100 образцов RNA-sec и 40 образцов ATAC-sec от рыб и мышей, а также 105666, 85051 и 77924 единичных изолированных клеток от рыб, цыпленка и мыши, соответственно. Интегрированные данные по профилям экспрессии генов и доступности хроматина были получены для всех видов воздействия на сетчатку у всех исследуемых животных.
При межвидовом сравнении удалось обнаружить эволюционно консервативные и видоспецифичные генетические регуляторные системы, которые после стимуляции контролируют переход от стабилизированной дифференцировки к реактивному состоянию и пролиферации клеток МГ (рыбы, цыпленок) или отсутствию подобного клеточного поведения (мыши). Направленная в эксперименте потеря функции генов, таких как hmga1 и yap1, приводила к ингибированию репрограммирования клеток МГ у рыб. У цыпленка фармакологическое нарушение активности FABP 5/7/8 (связывающих жирные кислоты белков 5,7,8), также ингибировало индуцированное повреждением проявление нейрогенной компетенции клеток МГ. И наконец, у взрослых мышей, делеция генов Nfia/b/x (факторы a,b,x, относящиеся к ядерному фактору I), в норме поддерживающих и восстанавливающих состояние покоя клеток MГ, приводила, напротив, к запуску программы репрограммирования, результатом чего было образование ретинальных биполяров и амакриновых интернейронов.
В заключении авторы (Hoang et al., 2020) подчеркивают, что у мыши, в отличие от рыб и птиц, генетические регуляторные сети, определяющие компетенцию клеток МГ к репрограммированию в нейральном направлении, пролиферации и нейрогенезу, находятся в ингибированном состоянии. Именно их распознавание помогло выявить несколько ключевых факторов транскрипции, стабилизирующих исходную дифференцировку. Нарушение функции последних позволило клеткам МГ пролиферировать и генерировать новые нейроны для восстановления сетчатки мышей после повреждения. Авторы демонстрируют удобство методов (RNA-sec) и (ATAC-sec) для идентификации генов и факторов - мишеней в регуляторных молекулярно-генетических сетях, воздействие на которые способно запустить программы конверсии клеток МГ в поврежденной сетчатке млекопитающих с целью ее восстановления.
Hamon, A.; Roger, J.E.; Yang, X.J.; Perron, M. Muller glial cell dependent regeneration of the neural retina: An overview across vertebrate model systems. Dev. Dyn. 2016, 245, 727–738. DOI: 10.1002/dvdy.24375.
Jorstad, N.L.; Wilken, M.S.; Grimes, W.N.; Wohl, S.G.; VandenBosch, L.S.; Yoshimatsu, T.; Wong, R.O.; Rieke, F.; Reh, T.A. Stimulation of functional neuronal regeneration from Müller glia in adult mice. Nature. 2017, 548, 103–107.
Dvoriantchikova, G.; Seemungal, R.J.; Ivanov, D. Development and epigenetic plasticity of murine Müller glia. Biochim. Biophys. Acta Mol. Cell Res. 2019, 1866, 1584–1594.
Новость подготовила © Григорян Э.Н.
16.09.2021