 © Кулибин Андрей Юрьевич, старший научный сотрудник лаборатории эволюционной биологии развития, кандидат биологических наук.
© Кулибин Андрей Юрьевич, старший научный сотрудник лаборатории эволюционной биологии развития, кандидат биологических наук.
Воспроизведение всех этапов гаметогенеза in vitro – важная нетривиальная задача, имеющая как фундаментальное, так и практическое, медицинское значение. Возможность получения мужских гамет in vitro из эмбриональных стволовых клеток была продемонстрирована уже несколькими группами исследователей; последняя работа на эту тему была опубликована в 2016 г. (Complete Meiosis from Embryonic Stem Cell-Derived Germ Cells In Vitro. Zhou Q, Wang M, Yuan Y et al. Cell Stem Cell. 2016 Mar 3;18(3):330-40. doi: 10.1016/j.stem.2016.01.017). В то же время возможность воспроизведения в культуре оогенеза вызывала сомнения, в первую очередь из-за сложных взаимодействий, устанавливающихся между ооцитом и поддерживающими его рост фолликулярными клетками. Действительно, до настоящего времени в культуре удавалось поддерживать лишь отдельные стадии этого процесса, но ни нормального образования фолликулов, ни сравнимого с ситуацией in vivo роста ооцитов получить не удавалось.
Однако опубликованная в августе 2016 г. в PNAS статья полностью развеивает сомнения в возможности воспроизведения оогенеза в культуре. Авторам статьи удалось полностью реконструировать процесс оогенеза мыши in vitro, начиная с первичных половых клеток и кончая зрелыми ооцитами; формирование фолликулов, мейоз и рост ооцитов проходили без видимых аномалий, и более того, авторам удалось провести оплодотворение дифференцированных in vitro ооцитов и получить жизнеспособное потомство.
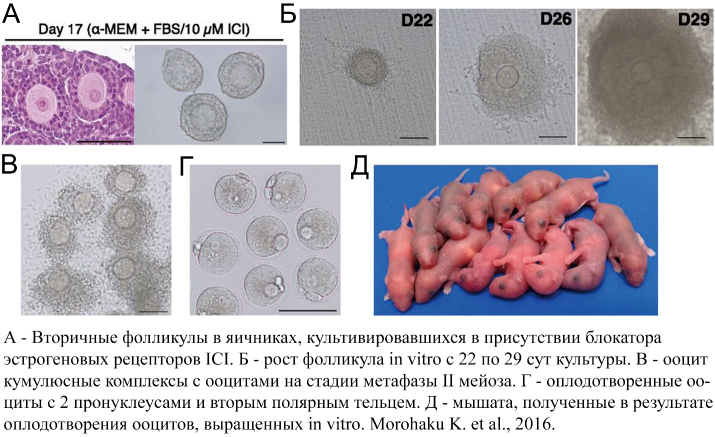
Исследователи выделяли яичники на 12.5 сутки эмбрионального развития и помещали их в органную культуру, где первичные половые клетки вступали в мейоз и происходили формирование и рост фолликулов. На 17 сутки культуры растущие вторичные фолликулы изолировали и культивировали до 29-33 суток К этому времени ооциты завершали рост и по размерам были лишь слегка меньше гамет, развивавшихся in vivo, а также имели нормальный, ооцит-специфический паттерн метилирования. Далее, из фолликулов выделяли ооцит-кумулюсные комплексы и завершали процесс созревания ооцитов, помещая их в среду с гонадотропинами и эпидермальным фактором роста. Через 17 ч большая часть ооцитов завершала первое мейотическое деление и останавливалась на метафазе второго деления, как и ооциты in vivo. Полученные в результате in vitro оплодотворения из этих ооцитов мыши были жизнеспособны и фертильны.
Для успешного прохождения оогенеза in vitro авторами работы были внесены значительные модификации в методику культивирования ткани яичника и фолликулов. Прежде всего, авторы отметили, что при стандартном культивировании ткани яичника в присутствии 10% фетальной бычьей сыворотки формирование примордиальных фолликулов нарушено. Помимо нормальных фолликулов, содержащих один ооцит, образуются фолликулы с несколькими ооцитами; кроме того, нарушается целостность оболочки фолликулов. В результате, при выделении из ткани яичника вторичных фолликулов - необходимом условии для дальнейшего роста ооцитов, бóльшая часть фолликулов разрушается. Проанализировав литературные данные, а также проведя РНК-секвенирование (RNA-Seq) органной культуры яичников, исследователи установили, что формирование фолликулов нарушается в результате избыточной активации сигнальных путей, активируемых эстрогенами, присутствующими в фетальной бычьей сыворотке. Действительно, после добавления в культуральную среду блокатора эстрогеновых рецепторов ICI формирование фолликулов в органной культуре стало происходить как в норме, in vivo. В результате, авторы смогли получить значительное количество вторичных фолликулов через 17 суток культивирования. На этом этапе авторы вновь внесли модификацию в методику: они культивировали вторичные фолликулы в культуральной среде с добавлением сыворотки и фолликулостимулирующего гормона в присутствии поливинилпиролидона (PWP). PWP способствовал лучшей интеграции ооцитов и клеток гранулозы, и, кроме того, усиливал пролиферацию клеток гранулозы и, таким образом, рост фолликула. Успешному росту и созреванию фолликулов in vitro также способствовала обработка фолликулов коллагеназой на 20 сут культивирования, в результате которой удалялись внешние слои клеток вторичных фолликулов, что, вероятно, приводило к более эффективному поступлению факторов из среды к фолликулу. Накопление в культуральной среде прогестерона и эстрогена и положительная иммунофлуоресцентная окраска части фолликулярных клеток на стероидогенные ферменты убедительно свидетельствовали о нормальной стероидогенной активности фолликулов in vitro. Суммирование всех этих модификаций методики культивирования и привело к успешному получению зрелых ооцитов in vitro с высокой эффективностью: в наиболее удачном варианте эксперимента в среднем из каждой помещенной в культуру эмбриональной гонады удавалось получить по 43 зрелых ооцита и, после всех манипуляций по искусственному оплодотворению, по 3-4 мышонка, чья фертильность была подтверждена впоследствии.
Авторы позиционируют разработанный ими метод реконструкции оогенеза мыши in vitro как новый подход для изучения механизмов развития женских половых клеток, мейоза и формирования и роста фолликулов, однако отмечают, что для других видов млекопитающих и, в частности, человека, могут понадобиться дальнейшие модификации методики, так как степень влияния эстрогенов на формирование примордиальных фолликулов значительно разнится у разных видов.
|
© Copyright © 2016 Kulibin A.Yu.