 © Косых Анастасия Валерьевна, младший научный сотрудник ЦКП "Группа биологических моделей", кандидат биологических наук.
© Косых Анастасия Валерьевна, младший научный сотрудник ЦКП "Группа биологических моделей", кандидат биологических наук.
Первая дифференцировка в жизни эмбриона происходит еще до его имплантации, когда клетки морулы разделяются на две популяции - трофобласт, формирующий в дальнейшем хорион и часть плаценты, и внутреннюю клеточную массу (ВКМ). В дальнейшем клетки ВКМ случайным образом делятся на предшественников клеток первичной энтодермы и эпибласта, затем происходит физическая сортировка клеток ВКМ на два слоя (Рис.1). Нижний слой, контактирующий с полостью бластоцисты, называют первичной энтодермой (PrE), она будет принимать участие в формировании желточного мешка. Верхний слой - эпибласт (EPI) - сформирует тело плода.
Молекулярный механизм дифференцировки клеток в ходе раннего эмбриогенеза достаточно хорошо изучен. Гораздо меньше известно о том, как достигается правильное позиционирование клеток PrE. Известно, что как только все клетки PrE оказываются на обращенной к полости поверхности ВКМ, они поляризуются и проходят эпителизацию, но физика процесса перераспределения клеток PrE и EPI до эпителизации остается загадкой. Ранее было предложено несколько возможных принципов сортировки клеток, включая разность адгезии, поверхностного натяжения и сродства клеток. Эта работа направлена на изучение механизма сортировки клеток PrE в составе ВКМ.
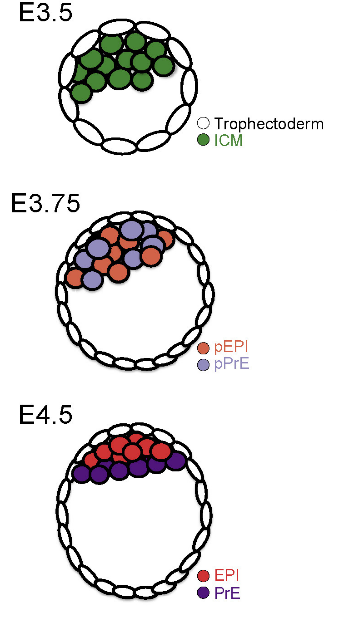
Рис. 1. Схема сегрегации EPI и PrE в бластоцисте мыши.
Первым делом авторы определили целевой срок эмбрионального развития и подтвердили полноценность изучаемой модели. Разобрав ВКМ эмбрионов ранних стадий развития для анализа экспрессии характерных маркеров (Nanog, Gata6, Pdgfra, Sox17, Gata4, Sox7), авторы показали, что можно отличить прогениторы EPI и PrE (pEPI и pPrE) уже со стадии Е3.75. Кроме того, они прижизненно проследили динамику сегрегации Е3.75 ВКМ, экспрессирующей репортер линии PrE - PdgfraH2B-GFP и локализованный в мембране репортер mTmG, и пронаблюдали, что клетки pPrE, которые изначально были распределены в ВКМ случайным образом, перераспределились на ее поверхность. Для упрощения модели, они также подтвердили, что ВКМ в культуре в отсутствие трофэктодермы способна давать EPI и PrE, после чего происходят сегрегация и созревание в соответствии с процессами в нормальной бластоцисте. Соответственно, основная работа проводилась на изолированной Е3.75 ВКМ.
Следующим шагом авторы подробно обосновывают саму идею наличия дополнительных механизмов сортировки ВКМ. Сначала они проанализировали уже известные механизмы – клеточная адгезия и миграция.
В пользу незначительности влияния разной степени адгезии они указывают на литературные данные о том, что силы межклеточной адгезии играют лишь небольшую роль в сортировке тканей и что клетки ВКМ экспрессируют E-кадгерин равномерно. Дополнительные анализы показали отсутствие разницы экспрессии кадгеринов в популяциях клеток pEPI и pPrE на E3.75.
Далее попытались исключить вклад направленной миграции в сортировку ВКМ. Авторы предположили, что раз клетки pPrE не демонстрируют отростки, указывающие на мезенхимальную миграцию, то они вероятно способны к амебоидной миграции. Проведя исследования в специальных 3D условиях, разработанных для анализа амебоидной миграции, они пришли к заключению, что клетки ВКМ не обладают высокой миграционной способностью и исключили миграцию из возможных механизмов сортировки клеток ВКМ.
Далее авторы перешли к другому возможному варианту управления клеточной сортировкой и механикой клеточной поверхности. Во-первых, с помощью транскриптомного анализа они показали, что экспрессия вариабельных генов, связанных с актиновым цитоскелетом становится отчетливой на стадии E3.75, что совпадает с этапом сортировки клеток pEPI и pPrE и может служить доказательством наличия механической асимметрии между клетками pEPI и pPrE на Е3.75.
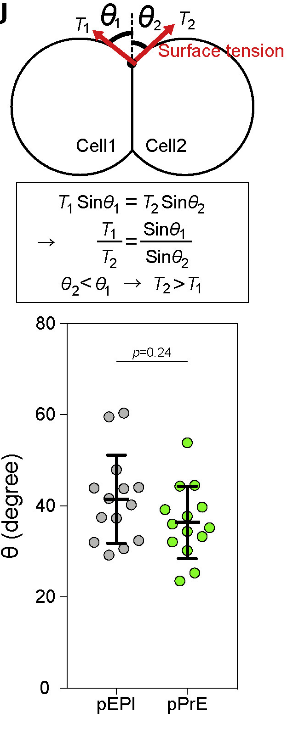
Рис. 2. Схема гетероклеточного дублета, показывающая, как измеряется внешний контактный угол, а также уравнения баланса сил, указывающие на то, что меньший из двух угол должен иметь более высокое поверхностное натяжение. Внешние контактные углы гетеротипических дублетов E3.75 pEPI и pPrE.
Одним из возможных проявлений механической асимметрии, является дифференциальное поверхностное натяжение клеток. С помощью атомно-силового микроскопа достоверных различий авторам обнаружить не удалось. Поверхностное натяжение клеток преимущественно отражает сократительное напряжение актомиозинового кортекса, которое в первую очередь контролируется активностью миозина II. При оценке уровня фосфорилированной регуляторной легкой цепи миозина (pMRLC), ключевого регулятора активности миозина, различий между pEPI и pPrE также обнаружено не было. В дополнение провели анализ формы гетеротипических клеточных дублетов pEPI и pPrE, который также не показал достоверных различий между pEPI и pPrE (суть анализа состоит в том, что в системе, состоящей из пары клеток, в области контакта у клетки с более высоким поверхностным натяжением будет меньший угол контакта) (Рис. 2). Исходя из всего вышеперечисленного, авторы приходят к выводу, что различия в поверхностном натяжении клеток вряд ли являются основным фактором, определяющим сортировку pEPI / pPrE.
Другим предполагаемым механическим регулятором сегрегации в развивающихся тканях является разница межклеточного сродства, которое определяется балансом сил между межклеточной адгезией, клеточным поверхностным натяжением и межфазным натяжением в клеточных контактах. Физическое моделирование предполагает, что в многоклеточных системах различия в межклеточном сродстве между двумя типами клеток могут быть достаточными для управления сортировкой клеток.
Для оценки сродства клеток авторы проанализировали площадь и углы контактов между дублетами pEPI и pPrE. Авторы показывали, что у дублета pEPI:pEPI аффинность выше, чем у pPrE:pPrE, и предположили, что pPrE будет склонен к сортировке снаружи агрегата. С другой стороны, авторы указали, что очень небольшая разница в размере контакта между дублетами pEPI:pEPI и гомотипическими дублетами pPrE:pPrE, а одних только различий в аффинности между клетками недостаточно, чтобы обеспечить надежную их сортировку. Для окончательной проверки авторы использовали трехмерную вычислительную модель, основанную на методе субклеточных элементов, называемую CS3D (3D force-based cell-sorting simulation). Полученная модель показала, что экспериментально измеренная разница в статической средней межклеточной аффинности недостаточна для поддержки надежной сортировки pEPI и pPrE.
Авторы отметили, что еще в исследованиях 1975 года показано, что клетки pPrE поздних бластоцист демонстрируют менее «гладкую» морфологию по сравнению с клетками pEPI. В связи с этим они исследовали возможную связь этих различий с флуктуациями в механике мембраны. Авторы проанализировали на видео амплитуду поверхностных колебаний мембран, как единичных клеток pEPI и pPrE, так и в составе ВКМ (Рис.3). Они показали, что клетки pPrE в обоих моделях демонстрируют значительно более высокие поверхностные флуктуации (образование выпячиваний, пузырьков), чем аналогичные клетки pEPI, соответственно был сделан вывод, что клетки PrE демонстрируют значительно более динамичную механику клеточной поверхности, чем EPI, и они, вероятно, являются результатом внутриклеточной передачи сигналов, которая инициирует образование PrE. В качестве проверки авторы расширили модель CS3D, включив в нее колебания клеточной поверхности, внедрив случайные колебания поверхностного натяжения, и подтвердили, что разница в поверхностных флуктуациях может контролировать надежную сортировку pEPI и pPrE.
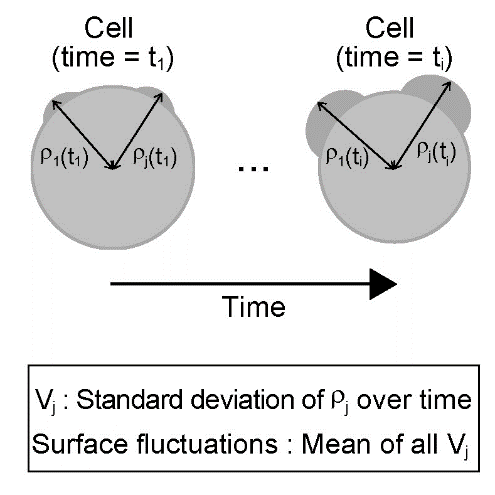
Рис. 3.. Схема, показывающая, как рассчитываются флуктуации поверхности.
Исходя из полученных ранее данных, в качестве вероятного механизма усиления поверхностных колебаний в клетках pPrE авторы предложили натяжение мембраны, которое зависит от плоскостного натяжения липидного бислоя и прикрепления мембраны к кортикальному слою. С помощью оптического пинцета авторы неожиданно для себя показали, что эффективное натяжение мембраны выше в клетках pPrE, чем в клетках pEPI. Эффективное натяжение мембран в первую очередь регулируется степенью взаимодействия мембраны с кортикальным слоем, при этом ключевую роль играет семейство белков Ezrin-Radixin-Moesin (ERM). Авторы подтвердили, что уровни фосфорилированных ERM (pERM), активной формы ERM, в клетках pPrE были намного выше, чем в клетках pEPI.
Однако наряду с этим, авторы наблюдали высокую степень пространственной изменчивости уровней pERM вдоль клеточной границы в клетках pPrE. Чтобы разобраться в полученных данных, авторы использовали индуцируемую доксициклином (Dox) конститутивно активную эзриновую (EzrinT567D-IRES-mCherry, или CA-EZR для краткости) линию ES клеток мыши. Используя эту линию, они обнаружили, что чем выше уровень mCherry, а значит и CA-EZR, тем менее вариабелен pERM на мембране. Также показали, что увеличение количества активного эзрина сверх эндогенных уровней в клетках ES и, таким образом, снижение гетерогенности pERM приводит к уменьшению поверхностных флуктуаций. В дополнение, авторы показали, что изменение натяжения мембраны с течением времени на уровне одной клетки четко коррелирует с числом выступов клетки (Рис.4), а также обнаружили более высокую вариацию толщины актинового слоя в клетках pPrE по сравнению с клетками pEPI. В результате авторы выдвигают гипотезу, что не средние значения статических механических параметров клеточной поверхности, а различия в вариабельности объясняют более интенсивные флуктуации клеточной поверхности, наблюдаемые в клетках pPrE по сравнению с клетками pEPI.
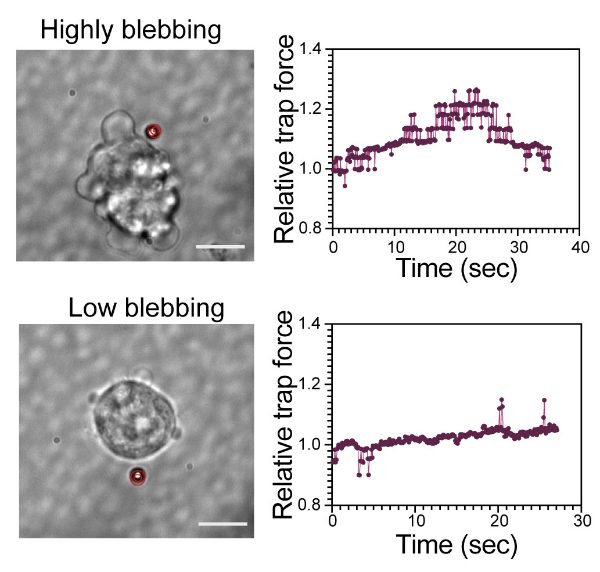
Рис. 4. Репрезентативные изображения измерения натяжения мембраны ЭСК ссильным «пузырением» (вверху) и клетки со слабым «пузырением» (внизу) с использованием оптического пинцета.
Для подтверждения своей гипотезы авторы собрали агрегаты из CA-EZR ES клеток и показали, что клетки с низким уровнем экспрессии CA-EZR (уровень флуктуации выше, чем в контрольных клетках), были преимущественно снаружи агрегата, в то время как клетки с высокой экспрессией CA-EZR, локализованы внутри. Дополнительные исследования с использованием клеток с нокдауном ERM и α-actinin-4 показали, что клетки с более высоким уровнем поверхностных флуктуаций располагались снаружи агрегата. В результате авторы приходят к заключению, что положение клеток внутри агрегата сильно влияет на уровень флуктуаций на их поверхности, что подтверждает их гипотезу о том, что различия в поверхностных флуктуациях приводят к сортировке клеток в многоклеточных агрегатах. В связи с этим они возвращаются к процессам в клетках ВКМ.
Авторы ввели ES клетки, нормальные и с повышенным уровнем флуктуаций, в эмбрион E2.5. В норме, клетки, введенные в любое время до ранней стадии средней бластоцисты (∼E3.5), должны локализоваться почти исключительно в EPI внутри ВКМ к E4.0, что и произошло с контрольными эмбрионами. Однако значительная часть модифицированных ES клеток была интегрирована в ВКМ, но во внешнем слое, соответствующем локализации PrE, прилегающей к бластоцелю. Авторы отметили, что ES-клетки, локализованные снаружи, экспрессировали маркер EPI Oct4, но не маркер ранней линии PrE Sox17, а значит увеличение флуктуаций действительно влияют на позиционирование, но не на судьбу клеток.
Пытаясь обосновать физику процесса, авторы предполагают, что сортировка клеток в ВКМ не следует классической «термодинамической» картине фазовой сегрегации, в которой клетки будут разделяться из-за различий в статическом среднем сродстве клеток для снижения общей свободной энергии системы. Ключевую роль они отводят различиям в динамике клеточной поверхности, которые проявляются в виде дифференциальных флуктуаций клеточной поверхности, однако, как именно проходит процесс сортировки остается неясным.
В ходе дополнительного изучения клеток pPrE и pEPI.в монослое и в составе ВКМ авторы показали, что клетки pPrE являются не только более активными в плане флуктуаций, но и более «текучей» (с высоким потенциалом изменения формы) популяцией клеток. Таким образом, более высокая текучесть и поверхностные колебания вместе приводят к отделению клеток pPrE от более «твердой» популяции клеток pEPI.
В результате авторы пришли к заключению, что небольшое различие клеточного сродства само по себе не объясняет, почему PrE-клетки сортируются наружу, и что для сортировки клеток раннего эмбриона мыши важны не только средние уровни механических факторов клеточной поверхности, но также их динамика и сопутствующие флуктуации клеточной поверхности (Рис. 5). На свободной поверхности флуктуации в первую очередь проявляются в виде выпячиваний и пузырьков, а внутри объема они проявляются в виде изменений формы. Предлагаемый здесь механизм флуктуаций, вероятно, связан с «разжижением» клеток и тканей, что, как предполагается, способствует морфогенезу тканей.
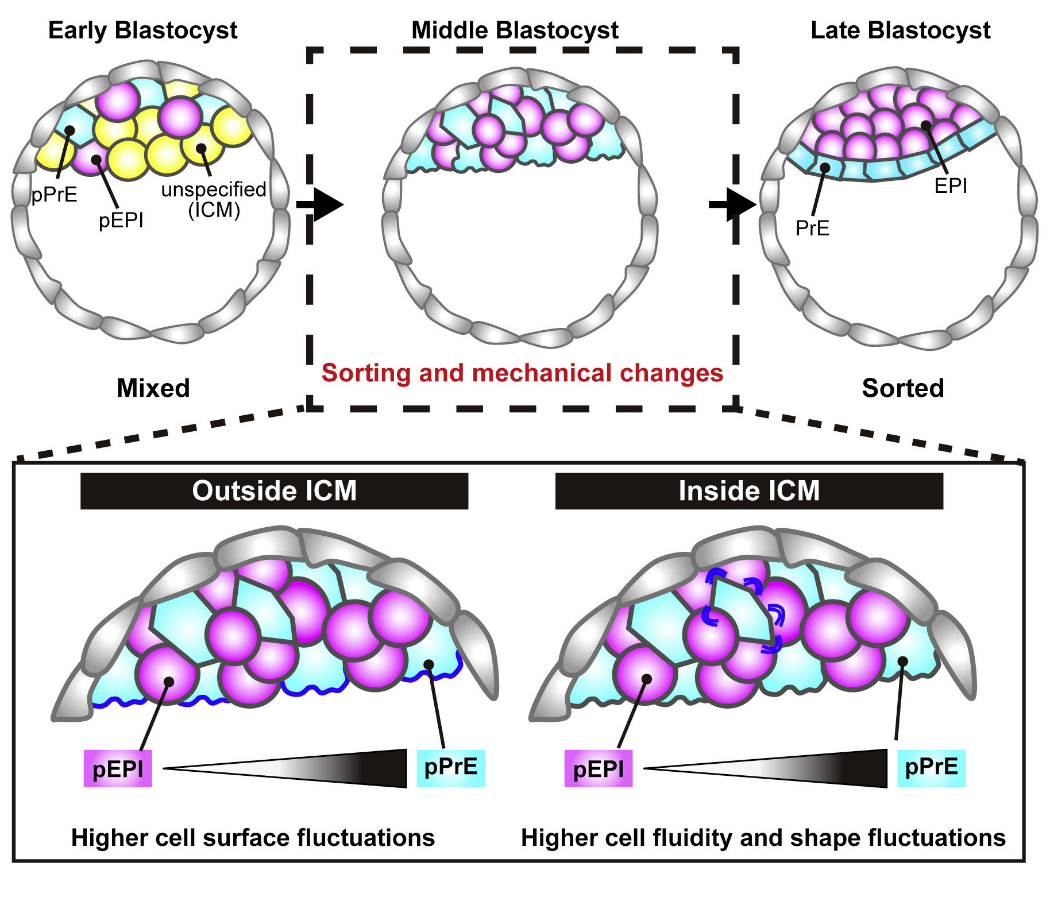 Рис. 5. Схема, показывающая, как флуктуации клеточной поверхности и текучесть клеток регулируют сортировку клеток ВКМ в раннем эмбриогенезев.
Рис. 5. Схема, показывающая, как флуктуации клеточной поверхности и текучесть клеток регулируют сортировку клеток ВКМ в раннем эмбриогенезев.
В этой работе авторы предлагают механизм для объяснения пространственной сегрегации в ткани, основанный не только на различиях в статических механических свойствах, но и на динамических, неравновесных механизмах. Будет интересно исследовать, как динамика клеточной поверхности влияет на другие процессы самоорганизации организмов, включая морфогенез тканей и онкогенез. Представлен огромный массив данных, в работе принимали участие 8 институтов.
Авторы признают, что связь между «текучестью» клеток и флуктуациями является на данный момент по большому счету спекуляцией. Предстоит еще большая работа по определению молекулярного механизма регуляции приведенных процессов.
Новость подготовила
© Косых А.В.
16.05.2022