 © Паюшина Ольга Викторовна
старший научный сотрудник лаборатории клеточных и молекулярных основ гистогенеза, доктор биологических наук.
© Паюшина Ольга Викторовна
старший научный сотрудник лаборатории клеточных и молекулярных основ гистогенеза, доктор биологических наук.
Как известно, воспалительные реакции сопровождаются гибелью клеток, которая в зависимости от ее масштабов может приносить организму как пользу (уничтожение поврежденных или зараженных патогенами клеток), так и вред (массивное повреждение ткани, ведущее к нарушению ее функций). Но является ли клеточная смерть при воспалении только следствием вызываемых им изменений в ткани, или же она сама может выступать в роли пускового механизма воспалительной реакции? Традиционно считалось, что клетки в воспаленной ткани гибнут под влиянием возникающих в ней неблагоприятных условий, связанных с недостатком питания, оксидативным стрессом, продукцией токсичных соединений лейкоцитами, воздействием белков комплемента и т.п. Такая гибель, происходящая путем некроза, с разрывом плазматической мембраны и высвобождением содержимого клетки в межклеточное пространство, противопоставлялась апоптозу – генетически запрограммированному процессу, протекающему без лизиса клетки и ассоциированному не столько с воспалением, сколько с развитием и ремоделированием тканей. Недавнее открытие программируемого некроза делает менее однозначной картину причинно-следственной связи между процессами воспаления и клеточной смерти и порождает потребность в молекулярных маркерах, позволяющих различать формы некротической гибели клеток в воспаленных тканях. Этой проблеме посвящен обзор, опубликованный в апреле 2016 г. в журнале Science (D. Wallach, T.-B. Kang, C.P. Dillon, D.R. Green. Programmed necrosis in inflammation: Toward identification of the effector molecules, V. 352 (6281), aaf2154, DOI: 10.1126/science.aaf2154). В нем авторы рассматривают две разновидности гибели клеток, происходящих, подобно «случайному» некрозу, с разрушением плазматической мембраны, однако управляемых строго определенными молекулярными механизмами, отличными от таковых при апоптозе – некроптоз и пироптоз.
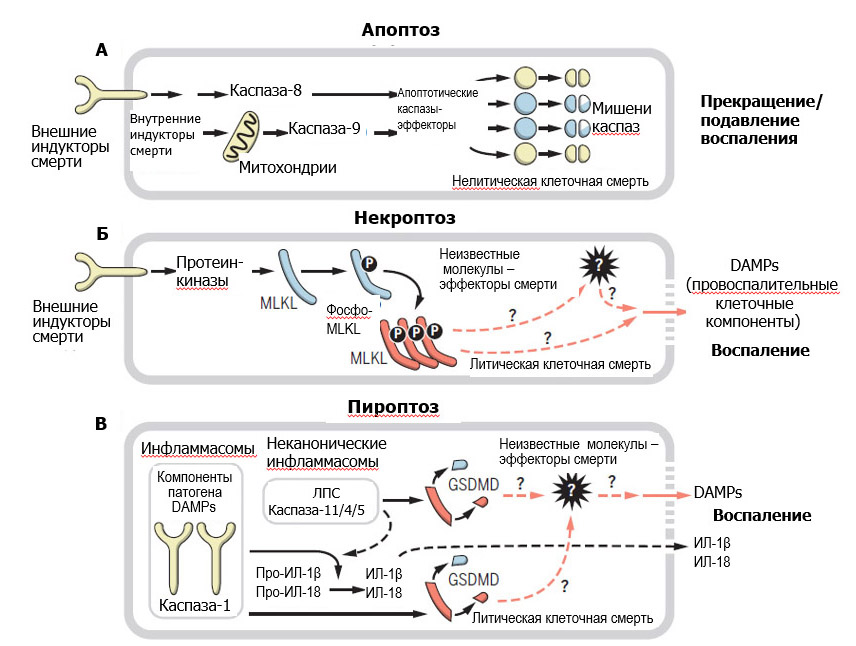 |
Эффекторные механизмы литической и нелитической клеточной смерти. (А) При апоптозе каспазы расщепляют белки, управляющие процессом гибели клетки. (Б) При некроптозе протеинкиназы фосфорилируют белок MLKL, тем самым активируя его. Фосфо-MLKL затем вызывает лизис клетки. (В) При пироптозе другие каспазы расщепляют и, следовательно, активируют гаcдермин-D (GSDMD), таким образом вызывая смерть. Эти каспазы также активируют цитокины ИЛ-1β и ИЛ-18. Как при некроптозе, так и при пироптозе мембрана клетки разрывается с высвобождением клеточных компонентов, способных вызывать воспаление (DAMPs, damage associated molecular patterns).
Обсуждая вопрос о роли клеточной смерти в воспалении, авторы отмечают, что ввиду морфологической идентичности всех форм литической гибели клетки особое значение для понимания механизмов повреждения тканей в различных патологических ситуациях приобретает идентификация молекулярных эффекторов некроптоза и пироптоза. Специфические молекулы, опосредующие эти процессы, могли бы быть не только маркерами, отличающими их от «случайного» некроза, но и мишенями для фармакологического воздействия с целью предотвращения запрограммированной некротической гибели клеток и инициируемого ею воспаления, если они являются главными патологическими детерминантами. В качестве кандидатов на роль таких молекул рассматриваются недавно открытые белки, участвующие в реализации поздних стадий некропотза и пироптоза – соответственно псевдокиназа MLKL и гасдермин-D. Функции этих белков представляются более специфичными, чем у молекул, действующих на стадии инициации клеточной гибели, но в достаточной ли степени, чтобы использовать их для однозначной идентификации программируемых форм некроза? Положительный ответ на этот вопрос требует установления строгой причинно-следственной связи между активацией данных молекул и гибелью клетки с последующим развитием воспаления. Анализируя имеющуюся информацию о функциях MLKL и гасдермина-D, авторы не приходят к окончательному выводу о том, можно ли считать их специфическими эффекторами программируемого некроза. В первую очередь это связано с неизученностью механизмов их действия: если для активированного MLKL предполагается (но не доказана) способность к формированию пор в клеточных мембранах, то по поводу эффектов, оказываемых гасдермином-D, пока не существует даже предположений. Кроме того, некоторые данные указывают на возможное участие обоих белков в индукции воспаления независимо от клеточной гибели – а значит, их функции в качестве эффекторов смерти могут не быть абсолютно специфичными. Очевидно, для получения более определенного ответа на вопросы о молекулярных механизмах некроптоза и пироптоза и предпочтительных методах их идентификации требуется продолжение исследований в данном направлении.
В целом следует заключить, что на сегодняшний день наши знания о гибели клеток при воспалении далеко не полны. И особая ценность данной статьи состоит в том, что ее авторы не только поднимают проблему установления причинно-следственной связи программируемых форм некроза с воспалительной реакцией, но и указывают путь к ее решению – поиск молекулярных индикаторов программ некроптоза и пироптоза среди эффекторов, действующих на завершающих стадиях этих процессов. Окажутся ли такими индикаторами рассматриваемые в статье MLKL и гасдермин-D, или же будут найдены другие молекулы, более подходящие на эту роль – покажут дальнейшие исследования.
Новость подготовила © 2016 Паюшина О.В.
16.05.2016