

© Лядова Ирина Владимировна, зав. лабораторией клеточных и молекулярных основ гистогенеза, докт. мед. наук. Область научных интересов: дифференцировка клеток иммунной системы, гемопоэз, регуляция воспаления, инфекционная иммунология.
© Антонов Даниил Олегович, старший лаборант лаборатории клеточных и молекулярных основ гистогенеза, студент МГМУ им. Сеченова. Область научных интересов: медицинская биотехнология, инфекционная иммунология, дифференцировка человеческих иПСК в летки иммунной системы.
Junior research scientist Laboratory of Biochemistry. Interests: bioinformatics, transcriptomics, chromatin, invertebrates.
Механизмы и факторы, определяющие образование гемопоэтических клеток в эмбриогенезе человека, до конца не установлены, что в значительной степени обусловлено трудностями изучения эмбриогенеза человека. Ackermann и соавторы описывают органоид-подобную 3D систему, основанную на дифференцировке иПСК in vitro, позволяющую моделировать ранние стадии эмбрионального гемопоэза человека. Показано, что данная система (названная авторами «геманоидная») моделирует эндотелиально-гематопоэтический переход (EHT); с использованием «геманоидов» впервые продемонстрирована роль интерлейкина 3 (IL-3) в ЕНТ.
В эмбриональном гемопоэзе (ГП) выделяют, как минимум, две стадии (волны): примитивный и дефинитивный ГП. На стадии примитивного ГП, происходящей в желточном мешке, образуются эмбриональные макрофаги и ядросодержащие эритроциты. Лимфоидные клетки, дефинитивные эритромиелоидные предшественники и гемопоэтические стволовые клетки (ГСК) образуются на более поздних стадиях – дефинитивных (Рис. 1).
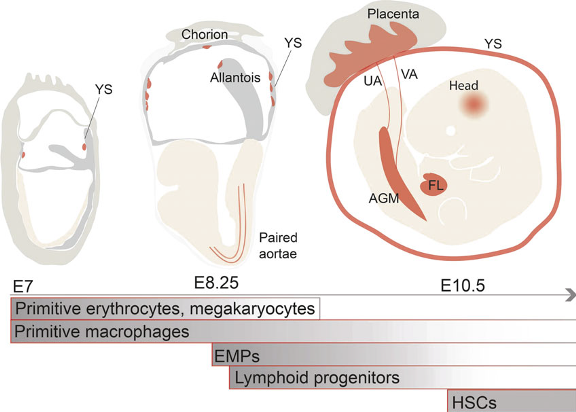
Рис. 1. Сайты и время образования клеток крови у эмбриона мыши (Источник: Kauts, M. L., Vink, C. S. and Dzierzak, E. (2016) ‘Hematopoietic (stem) cell development — how divergent are the roads taken?’, FEBS Letters, 590(22), pp. 3975–3986. doi: 10.1002/1873-3468.12372. YS – yolk sac, желточный мешок; UA -umbilical artery, пупочная артерия; VA – vitelline artery, желточная артерия; AGM – aorta‐gonad mesonephros, аорто-гонадный мезонефрос
Первичным клеточным источником, ответственным за появление дефинитивных гемопоэтических клеток, является гемогенный эндотелий (ГЭ), который преимущественно присутствует в аорто-гонадном мезонефросе (Рис. 2). Возникновение гемопоэтических клеток из ГЭ происходит путем EHT, который контролируется как внутриклеточными сигналами, опосредованными активацией факторов транскрипции (ТФ), так и внешними факторами – молекулами внеклеточного матрикса, межклеточными взаимодействиями, цитокинами. Роль цитокинов в постнатальном гемопоэзе и дифференцировке гемопоэтических клеток из ГСК хорошо известна. Напротив, участие цитокинов в ранних стадиях эмбрионального ГП остается изученным мало.
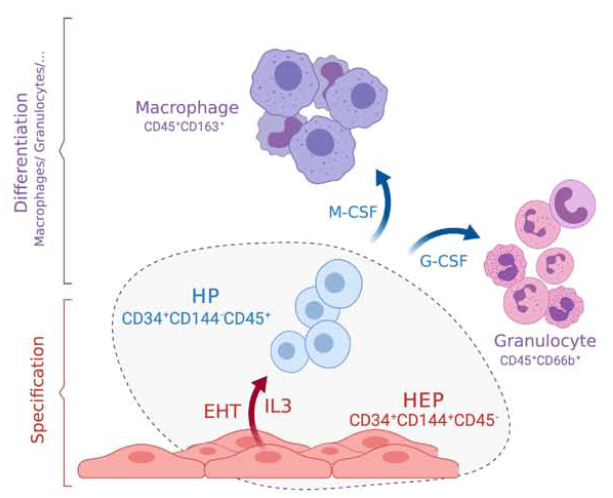
Рис. 2. Геманоидная модель и роль IL-3 в гемопоэтической спецификации гемогенного эндотелия (Источник: Ackermann, M. et al. (2020) ‘A 3D iPSC-differentiation model identifies interleukin-3 as a regulator of early human hematopoietic specification’, Haematologica, p. haematol.2019.228064. doi: 10.3324/haematol.2019.228064.)
В последние годы были предложены различные способы индукции гемопоэтической дифференцировки иПСК человека, в частности – способы генерации миелоидных клеток. Одна из наиболее распространенных моделей получения макрофагов предполагает получение из иПCК эмбриоидных телец (ЭТ) и последующее культивирование ЭТ в присутствии IL-3 и M-CSF. В работе авторы подробно характеризуют данную модель, демонстрируют, что она моделирует эмбриональный гемопоэз, приводит к образованию эндотелиальных структур и их ЕНТ и впервые показывают роль IL-3 в ЕНТ.
Авторы использовали протокол гемопоэтической дифференцировки иПСК, основанный на генерации эмбриоидных телец (ЭТ) (Рис. 3). Для изучения роли IL-3 в гемопоэтической спецификации, образованные ЭТ культивировали в присутствии IL-3, IL-3 и M-CSF , антител anti-IL-3 или без добавления экзогенных факторов. Для анализа изменений, происходящих в процессе дифференцировки, проводили полногеномный транскриптомный анализ с использованием Illumina HumanHT BeadChips®.
Для моделирования ЕНТ вне геманоидов использовали систему сокультиврования гемопоэтических предшественников со стромальными клетками ОР-9, экспрессирующими DLL1,4: образованные в геманоидах гемопоэтические предшественники, имеющие фенотип CD144+CD34+CD45-, сортировали и культивировали в присутствии трансгенных ОР-9 и IL-3 (или без последнего). Образование гемопоэтических клеток CD45+ оценивали методом проточной цитометрии и микроскопии.
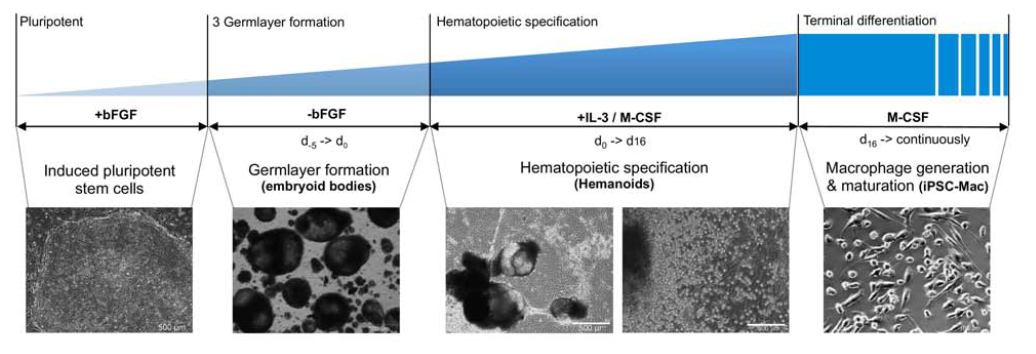
Рис. 3. Схематическое изображение и микроскопия различных стадий в рамках используемого протокола гемопоэтической дифференцировки.
Основные полученные результаты
1. Добавление IL-3 достаточно для индукции гемопоэтической программы в ЭТ. Система, названная в этой статье «геманоиды» (hemanoids), была разработана авторами в серии предшествующих работ и позволяла получать различные клетки (макрофаги, гранулоциты, эритроциты). Методика основана на получении ЭТ и последующем культивировании их в присутствии различных факторов, одним из которых является IL-3. Целью данной работы явилось определение роли IL-3 на ранних стадиях гемопоэтической дифференцировки.
В первой серии экспериментов авторы показали необходимость и достаточность IL-3 для гемопоэтической дифференцировки:
i. Культивирование ЭТ в среде без добавления IL-3 не сопровождалось образованием гемопоэтических и миелоидных клеток;
ii. В присутствии IL-3 или смеси IL-3 и CSF1 отмечалось длительное образование в культуре гемопоэтических клеток CD45+ (процентное содержание - >90% в обоих случаях).
iii. В геманоидах, культивированных в присутствии IL-3, по сравнению с культурами, стимулированными смесью IL-3 и M-CSF («стандартная» смесь, применяемая разными авторами для индукции миелоидной дифференцировки иПСК), геманоиды были меньше по размеру и количество образованных гемопоэтических клеток было в 2-3 раза меньше, также образующиеся миелоидные клетки были менее зрелыми (фенотип CD45+CD11b+CD14-CD163- по сравнению с фенотипом CD45+CD11b+CD14+CD163+ в культурах IL-3/M-CSF), клоногенный потенциал образованных клеток был, напротив, выше (оценен по образованию CFU-GEMM, CFU-GM, BFU-E).
Тем самым авторы показали, что добавление одного только IL-3 достаточно для индукции гемопоэтической программы дифференцировки в геманоидах.
2. Гемопоэтическая дифференцировка в геманоидах моделирует эмбриональных гемопоэз
В следующей серии опытов было показано образование в геманоидах эндотелиальных клеток, способных к EHT.
Cначала путем окрашивания парафиновых блоков гемотоксилин-эозином авторы показали, что основная часть ЭТ имела структуру, характерную для нейро-эктодермальных образований, однако в культуре также присутствовали железистые виментин-позитивные мезодермальные и пан-цитокератин-позитивные эпителиальные структуры. На 16-й день дифференцировки появлялись кистообразные структуры с эндотелиальной выстилкой.
Иммунофлуоресцентное окрашивание подтвердило развитие всех трех зародышевых листков у геманоидов, так как были обнаружены тубулин-положительные клетки, отмечающие наличие нейрональной сети; FOXA2-положительная энтодерма, а также десмин-положительные мезодермальные/мышечные клетки. (4).
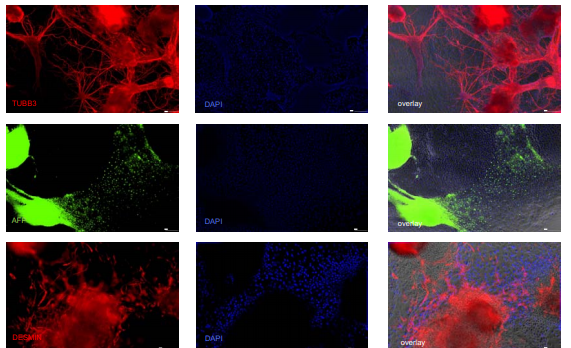
Рис. 4. Геманоиды фиксированные параформальдегидом и подвергшиеся иммунофлуоресцентному окрашиванию на TUBB3 (тубулин) (верхний ряд), FOXA2 (средний) и DESMIN (нижний ряд) на 16 день дифференцировки
С помощью ПЦР в реальном времени была исследована динамика изменения экспрессии транскрипционных факторов в ЭТ и геманоидах, показана последовательная смена экспрессии факторов, ассоциированных с плюрипотентными клетками (TRA-1-60), мезодермой (KDR1), ГЭ (SOX17) и гемопоэтическими клетками (TAL1 ).
Проточная цитометрия выявила появление первых гемато-эндотелиальных прогениторных клеток (HEP, CD144+СD34+) на стадии ЭТ (0.72±0.46%) с последующим увеличением их процента в геманоидах. НЕР не экспрессировали CD235 (маркер примитивного гемопоэза), однако большая их часть (70%) экспрессировали рецептор к IL-3 (CD123/ IL-3R).
После появления НЕР на ранних этапах гемопоэтической спецификации (день 4) в геманоидах появлялись первые гемопоэтические предшественники (HP), имевшие фенотип CD34low/ CD45+, количество которых увеличивалось к 16 дню до 5,36±1,46%. Функционально HP продемонстрировали клоногенный потенциал и давали начало различным типам колоний, а также нескольким типам миелоидных клеток.
Культивирование сортированных НЕР в «эндотелиальной среде» приводило к появлению клеток по морфологии сходных с HUVEC (эндотелиальные клетки пупочной вены человека). При культивировании НЕР с OP9-DLL1,4 в присутствии IL-3 отмечали образование гемопоэтических стволовых/прогениторных клеток CD144-/CD34+/CD45+ с высоким клоногенным потенциалом. Таким образом, дифференцировка в геманоидах моделировала эмбриональный гемопоэз, в частности, ЕНТ.
3. Присутствие в геманоидах 3D структур эндотелиального типа
В отдельной серии экспериментов с использованием репортерной линии ч-иПСК был проведен анализ структуры НЕР в геманоидах. Линию иПСК hCD34iPSC16 трансфецировали лентивирусом, экспрессирующим GFP под контролем промотора CD144, а также UCOE (ubiquitous chromatin opening element, повсеместный элемент, открывающий хроматин), препятствующий эпигенетическому сайленсингу лентивирусного вектора. Экспрессия GFP регистрировалась в НЕР (клетках CD144+CD34+) и снижалась в гемопоэтических предшественниках (CD34+/CD144-/CD45+). При этом флуоресцентная микроскопия показала образование в геманоидах организованные сети эндотелиального типа (5).
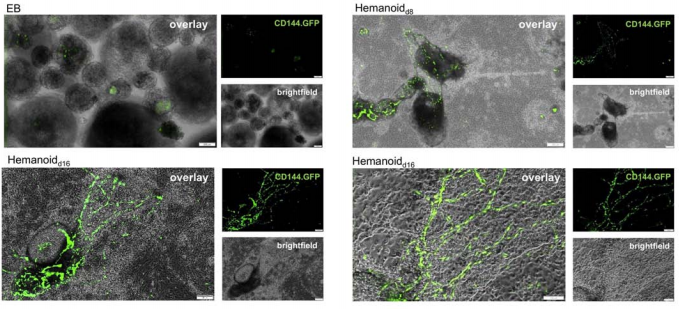
Рис. 5. Флуоресцентная микроскопия EB и развивающихся геманоидов на 8-й и 16-й день дифференцировки (светлое поле (brightfield); флуоресценция CD144.GFP и наложение (overlay)
4. Транскриптомный анализ отдельных стадий гемопоэтической дифференцировки, показал , что геманоидная система моделирует ранний гемопоэз человека.
Был проведен транскриптомный анализ клеток, находящихся на разных стадиях дифференцировки: сортированных иПСК (клетки TRA-1-60+), НЕРs (CD34high/CD144+/CD45-), HEPs и гемопоэтических предшественников (CD34low/CD144-/CD45+). Было показано появление экспрессии IL-3R уже на стадии НЕР. Полученные результаты были верифицированы с помощью ПЦР в реальном времени и в экспериментах на мышах: методом РНК-гибридизации in situ было показано, что у эмбрионов Е9.5, у которых в АГМ уже сформирован гемогенный эндотелий, но гемопоэтические клетки в АГМ еще отсутствуют (показано по отсутствию экспрессии GATA2), в АГМ отмечается экспрессия IL-3R и частичная ко-экспрессия IL3R и Sox17. (6)
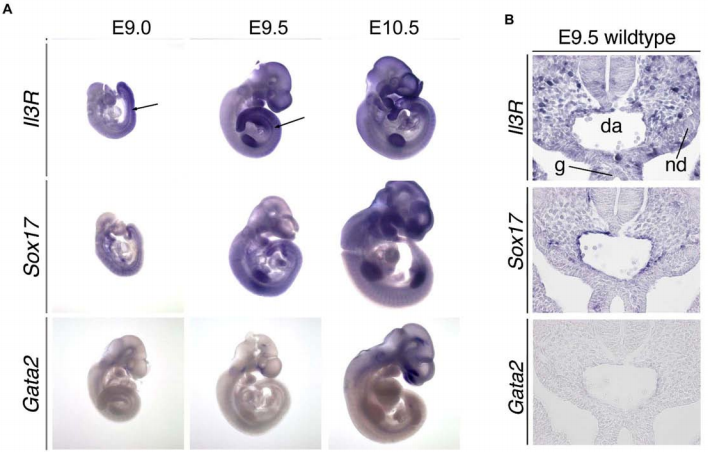
Рис. 6. А. Полный анализ гибридизации in situ мРНК IL-3R, Sox17 и Gata2 в эмбрионах E9.0, E9.5 и E10.5. IL-3R экспрессировался в области AGM (аортo-гонадного мезонефроса), мезенхиме хвостовой почки, конечностях, жаберных дугах и сомитах от E9.0 до E10.5. В. Анализ гибридизации РНК in situ поперечных срезов эмбриона E9.5.
В статье приводится детальный анализ экспрессии генов, ассоциированных с разными стадиями дифференцировки (плюрипотентностью, мезодермальной спецификацией, ГЭ, гемпатопоэтическими клетками) в указанных выше популяциях клеток, выделенных и сортированных из геманоидов. В частности, приводятся данные, подтверждающие эндотелиальный характер НЕР и повышение экспрессии генов, ассоциированных с гемопоэзом, в гемопоэтических предшественниках, полученных из геманоидов. Проанализированы сигнальные пути, вовлеченные в дифференцировку иПСК гемопоэтические клетки.
Анализ экспрессии специфичных для стадий генов продемонстрировал характерные профили экспрессии для всех определенных популяций клеток. Транскрипты, ассоциированные с плюрипотентностью, такие как NANOG, DNMT3B и POU5F1, были высоко экспрессированы в иПСК и быстро подавлялись при индукции гемопоэтической дифференцировки. Напротив, гены, связанные с образованием примитивной полоски и мезодермы, такие как PDGFRA, HAND1 или CDH11, были высоко экспрессированы в популяции ранней мезодермы Tra-1-60-/KDR+.
Возникающие HEP экспрессировали гены, связанные с эндотелием кровеносных сосудов, такие как гены, участвующие в передаче сигналов трансформирующего фактора роста (TGF) (например, ACVRL1) и Notch (NOTCH1, DLL4). При анализе онтологий генов, связанных с гематопоэзом, обнаружено, что важный регулятор эндотелиально-гемопоэтического перехода — HOXA9, - высоко экспрессируется в HEP, что дополнительно подтверждает их гематопоэтический потенциал. Классические гены, участвующие в гематопоэзе, такие как GFI1B, GATA2, GATA1, EVI2B, SPI1 или ANGPT1, были высоко экспрессированы в HP.
Суммируя вышесказанное, авторы заключают, что геманоидная система моделирует ранний гемопоэз человека и характеризуется последовательным появлением сначала HEPs, имеющих фенотип KDR+/CD34high/CD144+/CD43-CD45- с соответственным эндотелиальным и гемопоэтическим потенциалом и транскрипционными характеристиками, а позже - клоногенных HPs CD34low/CD144-/CD43+CD45+, экспрессирующих факторы транскрипции, характерные для гемопоэтических стволовых клеток и клеток-предшественников.
5. IL-3 влияет на ранние стадии гемопоэтической спецификации иПСК.
В заключительной серии экспериментов авторы исследовали влияние IL-3 на появление ранних гемопоэтических клеток. Для этого диссоциировали геманоиды, культивированные в разных условиях (в отсутствие экзогенных факторов, в присутствии IL-3 или IL-3/M-SCF) в разные сроки дифференцировки и анализировали процент популяций НЕР и НР (7). Показано, что в отсутствие IL-3 в культурах появлялись только клетки CD34highCD144+, а клетки CD34lowCD45+ не появлялись, т.е. не происходил ЕНТ. Появление некоторого количества клеток CD34lowCD45+ в культурах без добавления IL-3 полностью отменялось при внесении в культуры антител анти-IL-3.
Интересно, что онкостатин М и SCF, факторы, которые участвуют в ранних стадиях гемопоэтической дифференцировки, способностью стимулировать ЕНТ не обладали (8).
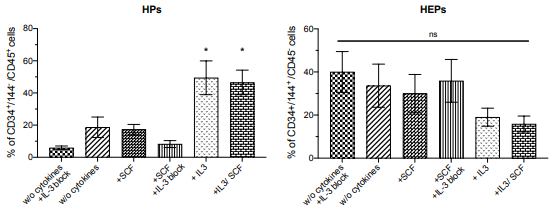
Рис. 7. Содержание клеток CD144+/CD45- HEP и CD144-/CD45+ HP среди общего количества CD34+ клеток внутри геманоидов, культивируемых в разных условиях (без цитокинов с добавлением IL-3-блокирующих антител; без цитокинов; в присутствии SCF; в присутствии SCF и IL-3-блокирующих антител; в присутствии IL- 3; в присутствии IL-3 + SCF)
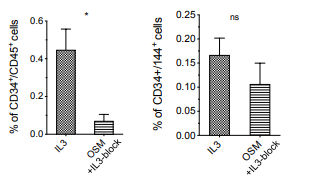
Рис. 8. Содержание клеток CD34+/CD144+ HEP и CD34+/CD45+ HP в геманоидах, культивированных в присутствии IL-3 или OSM и IL-3-блокирующими антителами в геманоидах на 16 день дифференцировки (n = 3, среднее ± SEM)
Обсуждая полученные результаты, авторы отмечают, что внутри геманоидов моделируются определенные стадии эмбрионального развития, а также формируется специфическая микросреда, поддерживающая раннии стадии гемопоэза. Показана важная роль IL-3 на ранних этапах кроветворения, а именно – его участие в эндотелиально-гематопоэтическом переходе. Продемонстрировано, что добавление IL-3 достаточно для индукции непрерывной продукции незрелых миелоидных клеток-предшественников. В дальнейшем представляет интерес исследовать роль других «гемопоэтических» цитокинов (FLT3-L, TPO) в формировании HEP c на модели геманоидов.
Новость подготовили © Лядова И.В. © Антонов Д.О.
16.02.2021