© Буторина Нина Николаевна, старший научный сотрудник лаборатории клеточных и молекулярных основ гистогенеза, к.б.н.
© Буторина Нина Николаевна, старший научный сотрудник лаборатории клеточных и молекулярных основ гистогенеза, к.б.н.
Область научных интересов - мезенхимные стромальные клетки, гемопоэтические стволовые клетки, их роль в процессах регенерации, экспансия и культивирование на биоматериалах, дифференцировка в различные типы клеток.
Гемопоэтические стволовые клетки (ГСК) обладают способностью к самообновлению и являются источником дочерних клеток, которые пролиферируют, созревают и развиваются в клетки крови всех типов. Размер пула ГСК во взрослом костном мозге, их самоподдержание, пролиферация и дифференцировка регулируются компонентами микроокружения костного мозга, в частности, мезенхимными стромальными клетками (МСК). В эмбриональный период в области аорто-гонадо–мезонефроса (АГМ) присутствуют резидентные стромальные клетки, которые способствуют развитию гемопоэза, однако, мало что известно об их происхождении, транскрипционной и функциональной идентичности, вкладе в генерацию длительно репопулирующих ГСК (LT-ГСК).
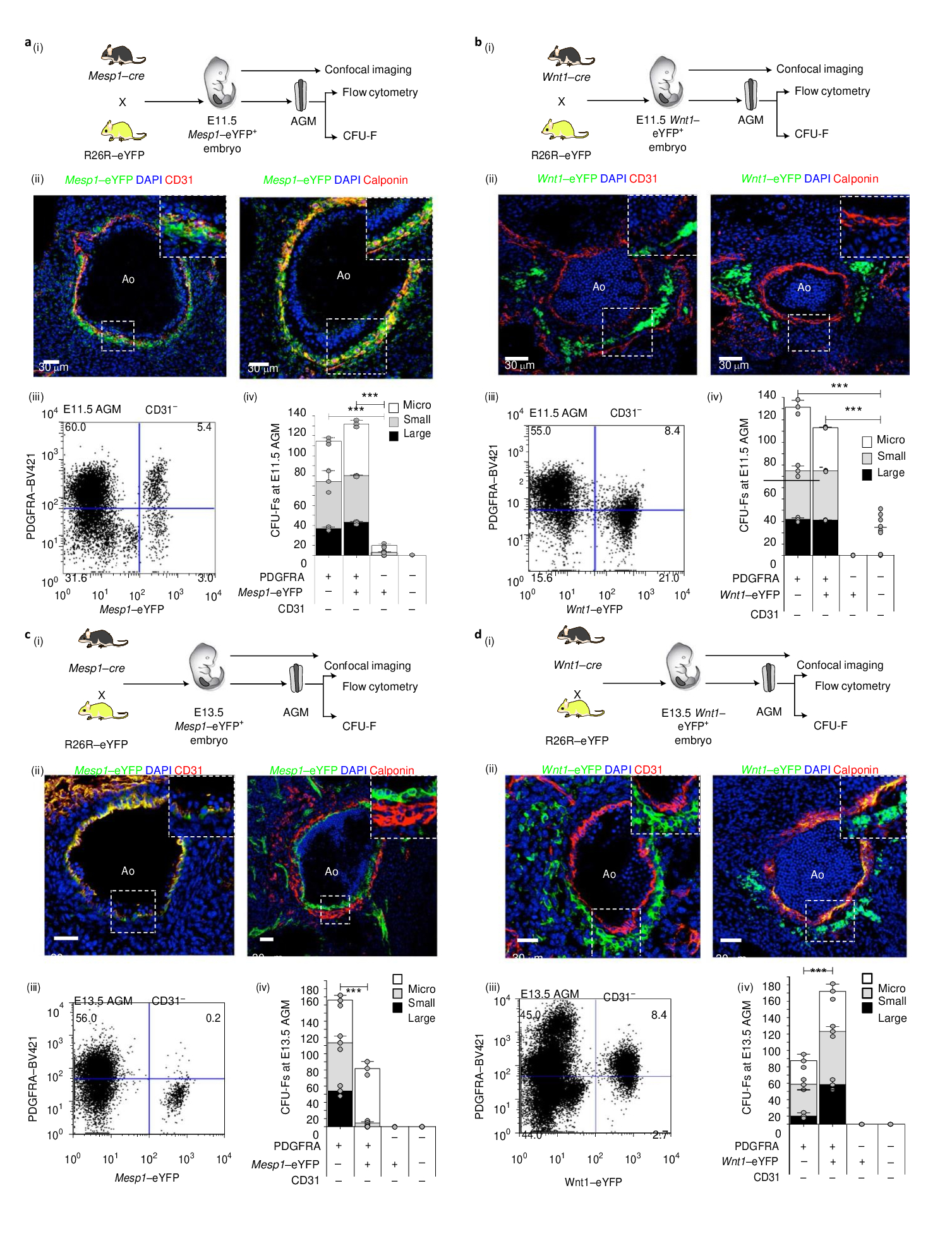
Chandrakanthan с соавторами исследовали роль стромальных клеток в области АГМ, присутствие МСК, их влияние на развитие дорсальной аорты, участие в эндотелиально-гемопоэтическом переходе (EHT). В результате было показано, что стромальные клетки PDGFRA+ мезодермального происхождения (Mesp1 der PSC) заселяют область АГМ на 10,5-11,5 день гестации , но к 13.5 суткам замещаются стромальными клетками из нервного гребня (Wnt1 der PSC) . При этом, совместная агрегация негемогенных эндотелиальных клеток с клетками Mesp1 der PSC приводит к активации программы гемопоэтической транскрипции в эндотелиальных клетках и генерации LT-ГСК, в отличие от агрегации с клетками Wnt1 der PSC . Полученные данные позволяют предположить, что АГМ совместно с Mesp1 der PSCs потенциально могут быть использованы для получения LT-ГСК из эндотелия.
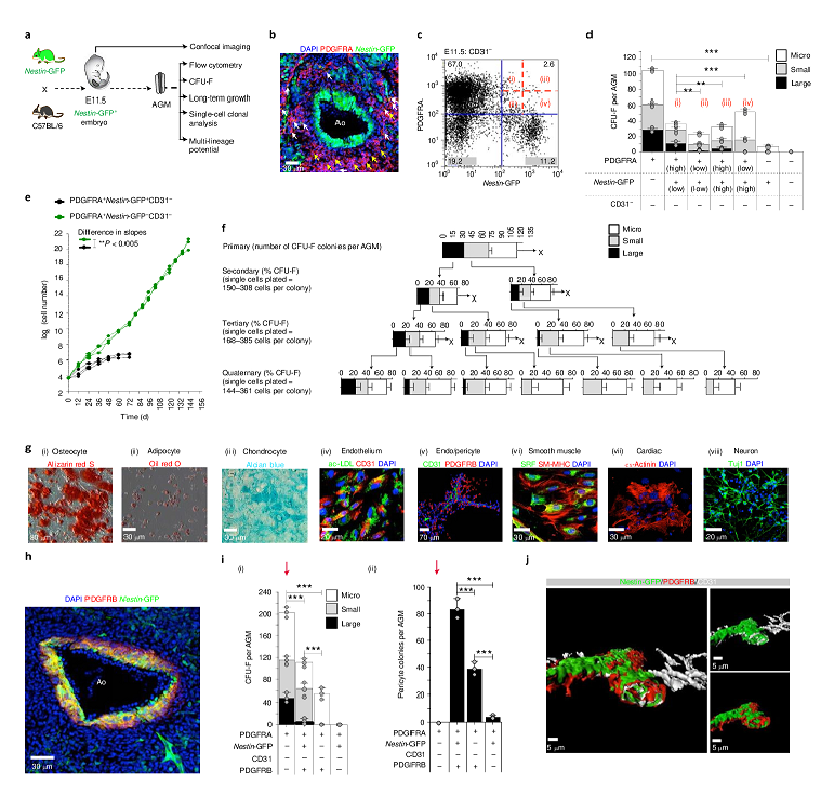
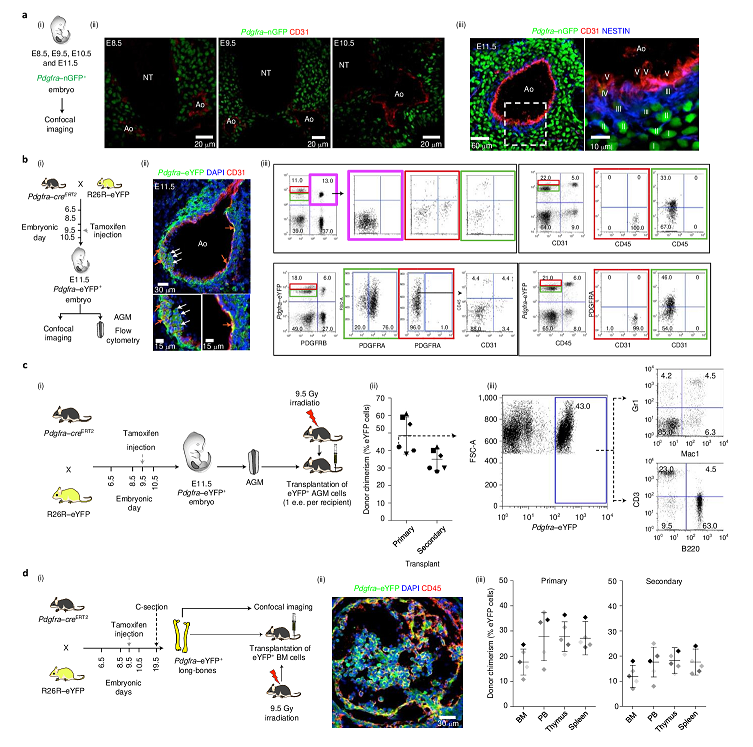
У эмбрионов мыши первые ГСК появляются в середине гестации (эмбриональный день 10.5, E10.5) из гемогенных эндотелиальных клеток, выстилающих вентральную поверхность дорсальной аорты, посредством EHT в области АГМ. Гемогенный эндотелий определяется между E8.5 и E10.5 (Ganuza, M. et al., 2017) и проходит стадии, необходимые для генерации ГСК в АГМ между E10.5 и E12.5 ( Kumaravelu, P. et al.2002). В исследованиях популяций стромальных клеток в АГМ использовали трансгенных мышей Nestin-GFP, у которых все МСК костного мозга GFP+. Эндотелиальные и субэндотелиальные клетки аорты и клетки крови, прилегающие к эндотелию аорты, содержат Nestin-GFP+ (рис.1b). Как Nestin-GFP+, так и Nestin-GFP- стромальные клеточные фракции в E11.5 AGM экспрессируют рецептор альфа фактора роста тромбоцитов (PDGFRA), экспрессируемый на поверхности МСК и на ранних мезодермальных клетках эмбриона . По-видимому, PDGFRA + стромальные клетки (PSC) в АГМ обладают свойствами MСК. Были изучены функциональные свойства PSC, а также Nestin-GFP+ и Nestin-GFP- клеток в АГМ. Оказалось, что потенциал КОЕ-F в E11.5 AGM находится, в основном, в клетках PDGFRA +, а экспрессия Нестина отмечена в субпопуляции клеток PSC с более ограниченными потенциалом КОЕ-Ф и дифференцировки. (рис. 1g(i) -(viii). Перициты характеризуются экспрессией β-рецептора фактора роста (PDGFRB)( Armulik, A. et al ,2011.) и распределены концентрически в субэндотелии дорсальной аорты E11.5 (Рис. 1h.). При исследовании взаимосвязи перицитов с клетками Nestin-GFP+, было выяснено, что потенциал КОЕ-F во фракции Nestin-GFP+ находился исключительно в пределах субфракции PDGFRB+ (рис. 1i(i)). PSC являются своеобразным резервуаром для эндотелиальных и субэндотелиальных клеток в развивающейся аорте и могут способствовать долгосрочной репопуляции ГСК, которые появляются в E11.5. Ранее было выяснено, что PSC способствуют почкованию клеток крови из эндотелиальной оболочки дорсальной аорты E10.5 AGM (Ding, G.et al,2013). Оценили распределение CD31 в E8.5, E9.5, E10.5 и E11.5 AGM у мышей с нокаутом Pdgfra–nGFP.(рис.2 а (i)-(iii)) В ранний эмбриональный период развития клетки Pdgfra–nGFP находятся поблизости от эндотелиальных клеток парной дорсальной аорты (рис. 2а(ii)). Была подтверждена родственная связь между клетками PDGFRA+ в E9.5 и в E11.5. (Рис. 2b(i)). Анализ трансплантации клеток eYFP+ AGM (Рис. 2c(i)) показал, что эти клетки способны восстанавливать кроветворение у смертельно облученных мышей и способствуют появлению нескольких линий крови (рис. 2с(ii), (iii)). Клетки Pdgfra–eYFP+ способны заселять костный мозг (Рис. 2d(ii), Рис. 3i,j ). Отсутствие PSC в развивающемся эмбрионе оказывает вредное воздействие на кроветворение в AGM. Наблюдалось нарушение нормального развития дорсальной аорты (Рис. 4а(ii)). Мыши, несущие нацеленную нулевую мутацию Pdgfra , показали раннюю эмбриональную летальность ( Soriano P.,1997).
Передача сигналов PDGFRA необходима для создания микросреды, поддерживающей гемопоэз (Li, W. L. et al., 2006). В отсутствии Pdgfra, E10.5 и E11.5 AGM LT-ГСК не производятся (Рис. 4b(ii),(iii)).
Отдельные волны PSC последовательно заполняют AGM. Стромальные клетки, полученные из Mesp1–eYFP+, вносят вклад в эндотелий аорты в E8.5, E9.5 и E10.5 AGM (Saga, et al 2000) (рис. 3а(i)). Потенциал КОЕ-F PSC в E10.5 и E11.5 AGM, в совокупности, составляют две субфракции Mesp1–eYFP+ и Wnt1-eYFP+, которые имеют разное происхождение и занимают различные анатомические местоположения по отношению к гемогенному эндотелию. Mesp1derPSC показали большую способность к многолинейной дифференцировке, чем не-Mesp1der PSC. В отличие от гемогенных E10.5 и E11.5 AGM, E13.5 AGM больше не является гемогеническим. Во время этого перехода популяция КОЕ-F изменяется. Потеря клеток Mesp1der в субэндотелии, наряду с заменой клетками Wnt1der в E13.5, по времени совпадает с потерей EHT в дорсальной аорте. Mesp1 и PSC индуцируют EHT в негемогенном эндотелии. Ткани, расположенные вентрально к AGM, оказывают усиливающее влияние на появление ГСК, тогда как ткани на дорсальной стороне снижают выработку ГСК. Кроме того, PSC Mesp1der индуцируют гемогенные транскрипционные программы. Во время перехода негемогенных эндотелиальных клеток в гемогенный эндотелий, происходит изменение транскрипционных программ. Уровень экспрессии некоторых секретируемых белков, ранее связанных с EHT, был более высоким в E11.5 Mesp1der PSC, чем в Wnt1derPSC. Изменение экспрессии факторов транскрипции SOX17 и RUNX1 коррелирует с процессами EHT. Анализ транскриптомов эндотелиальных клеток показал, что по мере того, как они приобретали гемогенный потенциал, клетки приобретали экспрессию Runx1, наблюдалось сопутствующее усиление экспрессии гемопоэтических генов и теряли экспрессию эндотелиальных генов. Для EHT важна PSC- опосредованная передача сигналов. Прерывание передачи сигналов PDGFRA препятствует функционированию PSC Mesp1der и EHT. Одновременно с прекращением EHT в E13.5 субэндотелиальные Mesp1der ПСК заменяются на Wnt1der PSC. До сих пор неясно, способствует ли замена Mesp1der PSCs на Wnt1der PSCs прекращению кроветворения AGM и что объясняет исчезновение Mesp1der PSC из общего числа клеток на E13.5. Вероятно, что Mesp1der PSC сами по себе представляют собой гетерогенную популяцию клеток.
Таким образом, возникновение гемопоэза в AGM, по-видимому, зависит от ограниченного, невозобновляемого пула гемогенных эндотелиальных клеток, которые заменяются эндотелиальными клетками сомитового происхождения, что может объяснить прекращение гемопоэза AGM при E13.5.
Список литературы:
Armulik, A., Genove, G. & Betsholtz, C. Pericytes: developmental, physiological, and pathological perspectives, problems, and promises. Dev.Cell 21, 193–215 (2011).
Ding, G., Tanaka, Y., Hayashi, M., Nishikawa, S. I. & Kataoka, H. PDGF receptor alpha+ mesoderm contributes to endothelial and hematopoietic cells in mice. Dev. Dynam. 242, 254–268 (2013).
Ganuza, M. et al. Lifelong haematopoiesis is established by hundreds of precursors throughout mammalian ontogeny. Nat. Cell Biol. 19 1153–1163 (2017).
Kumaravelu, P. et al. Quantitative developmental anatomy of definitive haematopoietic stem cells/long-term repopulating units (HSC/RUs): role of the aorta-gonad-mesonephros (AGM) region and the yolk sac in colonization of the mouse embryonic liver. Development 129, 4891–4899 (2002).
Li, W. L. et al. Platelet derived growth factor receptor alpha is essential for establishing a microenvironment that supports definitive erythropoiesis. J. Biochem. 140, 267–273 (2006).
Saga, Y., Kitajima, S. & Miyagawa-Tomita, S. Mesp1 expression is theearliest sign of cardiovascular development. Trends Cardiovasc. Med. 10,345–352 (2000).
Soriano, P. The PDGF alpha receptor is required for neural crest cell development and for normal patterning of the somites. Development 124,2691–2700 (1997).
Новость подготовила
© Буторина Н.Н.
16.01.2023