© Александра Александровна Ветрова, аспирантка лаборатории эволюции морфогенезов.
Область научных интересов: биология развития беспозвоночных, EvoDevo, роль сигнальных путей в развитии.
© Станислав Валерьевич Кремнёв, кандидат биологических наук, старший научный сотрудник, лаборатория эволюции морфогенезов ИБР РАН.
Научные интересы: морфогенез, эволюция эмбрионального развития.
Резюме. В виде препринта на сайт bioRxiv.org выложена статья, посвящённая детальному исследованию динамики локализации ядерного β-катенина в ходе развития актинии Nematostella vectensis - представителя типа Cnidaria (книдарии = стрекающие), относящихся к базальным многоклеточным (Lebedeva et al., 2022). Полученные данные подтверждают гипотезу, что у стрекающих первичная разметка основной оси тела определяется градиентом материнского ядерного β-катенина. Однако было показано, что вопреки предыдущим предположениям, материнский ядерный β-катенин локализуется на вегетативном полюсе яйцеклетки, соответствующем у книдарий аборальному (заднему) концу тела. Более того, в отличие от билатерий, β-катенин у Nematostella не участвует в запуске молекулярных каскадов, приводящих к дифференцировке энтодермы. Полученные данные противоречит общепринятым представлениям о консервативной роли β-катенина в спецификации зародышевых листков, а также вновь поднимают вопрос о гомологии элементов плана строения книдарий и билатерий.
β-катенин - центральный компонент канонического сигнального пути Wnt/β-катенин (cWnt). У билатерально-симметричных животных материнский β-катенин локализуется в ядрах клеток на вегетативном полюсе эмбриона, где впоследствии происходит гаструляция и дифференцируются энтодерма (а часто и мезодерма). Таким образом, в ходе эмбрионального развития он вовлечён в два фундаментальных процесса: разметку основной оси тела и спецификацию энтомезодермы. Функциональные исследования и данные по экспрессии генов-компонентов сигнального пути сWnt свидетельствуют, что β-катенин участвует в разметке основной оси тела не только у билатерий, но и у большинства многоклеточных животных.
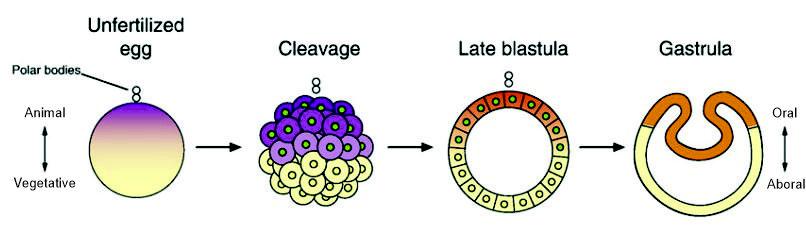
До сих пор предполагалось, что β-катенин был вовлечен в спецификацию второго зародышевого листка, энтодермы, ещё у общего предка книдарий и билатерий. В соответствии с этой гипотезой, материнский ядерный β-катенин у книдарий должен локализоваться на анимальном полюсе яйцеклетки, соответствующем у них сайту гаструляции (т.е. формирования энтодермы), заднему концу тела личинки и оральному концу тела полипа или медузы (Рис. 1).
Соответственно, высказывалось предположение, что эволюция билатерий связана с «переворотом оси»: в ходе эволюции от общего предка, материнский β-катенин билатерий поменял полюс локализации (Salinas-Saavedra et al., 2018). Новые данные, полученные в ходе изучения эмбрионального развития актинии Nematostella vectensis, позволили проверить эту гипотезу.
Ранее исследования распределения ядерного β-катенина в эмбрионах стрекающих проводили с помощью микроинъекции синтетической мРНК гибридного белка β-катенин-GFP (Wikramanayake et al., 2003; Momose et al, 2008). Предполагалось, что белок β-катенин-GFP будет разрушаться в областях, где канонический Wnt каскад не активен, и функционирует деструктивный комплекс GSK3-APC-Axin. Накапливаться он будет в тех областях, где Wnt каскад активен, а деструктивный комплекс ингибирован. Таким образом была показана ядерная локализация β-катенина на оральном полюсе в ходе гаструляции Nematostella и Clytia. При таком способе визуализации нельзя было исключить нарушение разметки эмбриона, связанное с гиперэкспрессией β-катенина. Также этот метод не позволяет выявить распределение ядерного β-катенина на более ранних стадиях развития, так как после микроиньекции мРНК в зиготу требуется время на синтез и созревание белка. Распределение эндогенного материнского ядерного β-катенина на стадиях до гаструляции у Nematostella было показано методом иммуноцитохимии (Leclere et al., 2016). Действительно, ядерный β-катенин был выявлен на одном из полюсов радиально-симметричной бластулы. На основе результатов предыдущих экспериментов, было высказано следующее утверждение: у Nematostella на стадии бластулы материнский ядерный β-катенин локализуется на оральном полюсе. Проблема здесь состоит в том, что для бластулы Nematostella невозможно по морфологическим признакам определить, как проходит орально-аборальная ось.
В то же время, накопилось достаточное количество экспериментальных данных, не состыковывающихся с принятой гипотезой о том, что материнский β-катенин участвует в спецификации орального полюса и регуляции гаструляционных морфогенезов у Nematostella. Во-первых, было показано, что при нокдауне β-катенина энтодермальный маркер SnailA начинает равномерно экспрессироваться вдоль всего эмбриона, при том, что экспрессия аборальных маркеров Six3/6 и FoxQ2a исчезает полностью (Lebedeva et al., 2021; Leclere et al., 2016). Во-вторых, при фармакологической активации канонического Wnt каскада до начала гаструляции, эмбрионы были неспособны начать гаструляционные морфогенезы и оставались сферической формы. Однако эти сферические эмбрионы продолжали экспрессировать маркеры оральной эктодермы Brachyury, FoxA и FoxB, но не маркеры энтодeрмы (Niedermoser et al., 2022; Leclere et al., 2016). И, в-третьих, нокдаун компонентов рецепторных комплексов канонического Wnt каскада LRP5/6 и Fz не нарушал спецификацию эндодермы и гаструляционные морфогенезы, несмотря на полную аборализацию эктодермы эмбрионов. В сумме, перечисленные данные могут свидетельствовать о том, что спецификация энтодермы у Nematostella подавляется Wnt-β-катенин сигнальным путем, а не активируется им. Они также ставят вопрос, действительно ли материнский β-катенин локализуется на оральном полюсе.
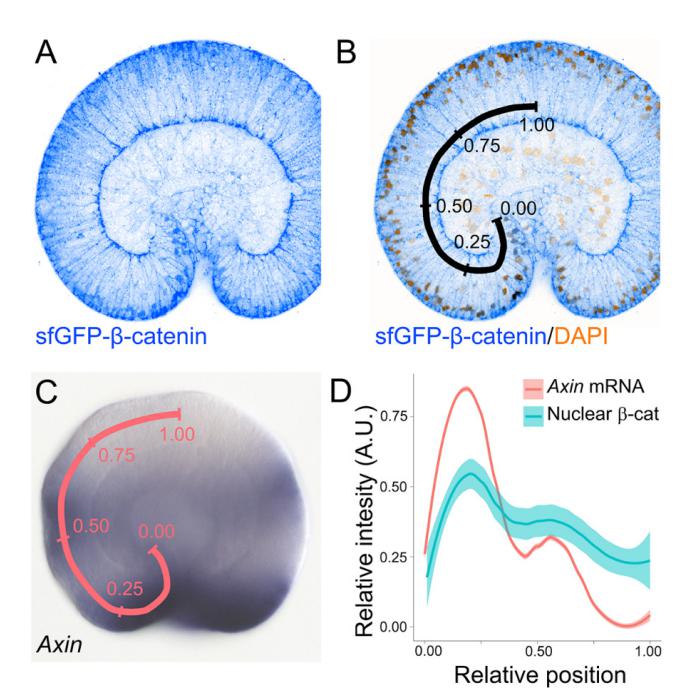
Для получения ответов на поставленные вопросы группа исследователей под руководством Григория Гениховича (Dr. Grigory Genikhovich) (Университет Вены) решила подробно исследовать динамику локализации материнского β-катенина in vivo и выяснить его роль в спецификации энтодермы у стрекающих. Для этого авторами исследования была создана трансгенная линия Nematostellа с отредактированным с помощью CRISPR/Cas9 геномом, у которой β-катенин был помечен флуоресцентным белком GFP.
Наличие градиента ядерного β-катенина вдоль орально-аборальной оси эмбриона на стадии гаструлы было показано с помощью антител к GFP. Это решило проблему выявления ядерного β-катенина, так как сигнал эндогенного белка на данной стадии развития был очень слабым. У выявленного градиента β-катенина было обнаружено два пика: один - на изгибе губы бластопора, а второй - на границе аборального домена и срединной линии эмбриона (Рис. 2). Оба этих пика совпадают с пиками экспрессии аксина, гена, являющегося прямой мишенью сигнального пути сWnt. Это подтверждает ранее высказанное авторами предположение, что гены, которые экспрессируются вдоль орально-аборальной оси и регулируют её разметку, сами зависят от градиента ядерного β-катенина (Lebedeva et al., 2021).
Далее авторы проверили, вовлечён ли материнский ядерный β-катенин в спецификацию энтодермы у Nematostella. Для этого была проведена прижизненная съёмка эмбрионов трансгенной линии с флуоресцентным β-катенином. На стадии дробления эти эмбрионы были заключены в гель из легкоплавкой агарозы. Начиная со стадии 32-64 клеток и до стадии средней бластулы, ядерный β-катенин, как и предполагалось, был локализован на одном из полюсов эмбриона. Однако, к началу гаструляции стало понятно, что у всех исследуемых эмбрионов ядерный β-катенин локализован на аборальном полюсе, тогда как формирование преэнтодермальной пластинки и гаструляционные морфогенезы происходят на противоположном, оральном полюсе эмбриона. Полученные результаты позволяют объяснить следующие факты. (1) При подавлении активности сигнального пути Wnt/β-катенин, во всех клетках эмбриона начинает экспрессироваться ген-маркёр энтодермы SnailA. (2) При активации Wnt/β-катенин сигнального пути до начала спецификации энтодермы все клетки эмбриона начинают экспрессировать маркеры оральной эктодермы. По всей видимости, у Nematostella, в отличие от билатерально-симметричных животных, β-катенин не способствует спецификации энтодермы, а наоборот её подавляет.
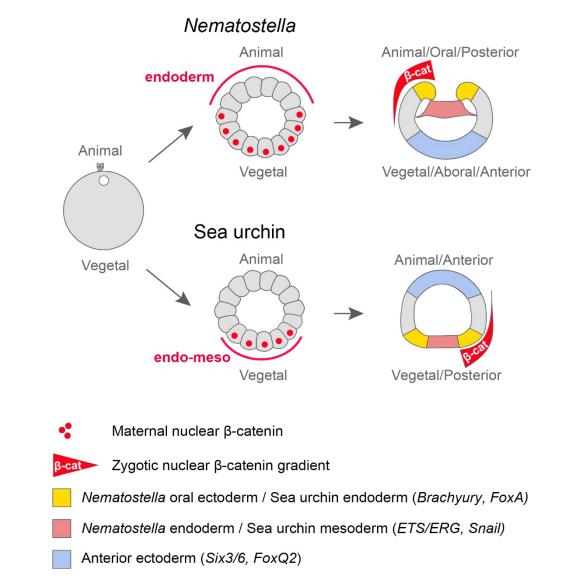
Итак, авторы исследования показали, что в эмбрионе стрекающих на стадии гаструлы действительно существует градиент ядерного β-катенина вдоль орально-аборальной оси. Этот результат, казалось бы, подтверждает гипотезу о гомологии основных осей тела книдарий и билатерально-симметричных животных. Но не всё так просто.
Напомним о гипотезе, в соответствии с которой эволюция билатерий была связана с «переворотом оси»: предполагалось, что их материнский β-катенин поменял полюс локализации по сравнению с книдариями (Salinas-Saavedra et al., 2018). Новые данные показывают, что никакого «переворота оси» не было: материнский β-катенин накапливается в ядрах вегетативного полюса как у Nematostella, так и у Bilateria. Эти же данные меняют наш взгляд на роль β-катенина в спецификации зародышевых листков и гаструляции. У Cnidaria локализация материнского ядерного β-катенина никак не связана с сайтом гаструляции. Кроме того, у книдарий спецификация энтодермы либо ингибируется β-катенином (как у Nematostella), либо вообще не контролируется β-катенином (как у книдарий с аполярным способом гаструляции). Вероятно, это одна из причин разнообразия способов гаструляции, наблюдаемого в этом типе. В случае аполярной гаструляции ни спецификация зародышевых листков, ни гаструляционные морфогенезы не связаны пространственно с орально-аборальной осью, разметка которой находится под контролем сWnt каскада. Это было показано в нашем исследовании по развитию гидроидного полипа Dynamena (Vetrova et al., 2022).
Отсюда следует, что билатерии могли кооптировать (вовлечь) β-катенин, исходно использовавшийся для разметки оси тела, в спецификацию региона формирования энтомезодермы, который у них как раз и находится на вегетативном полюсе (рис.3).
Полученные результаты поднимают много дополнительных вопросов: Какие факторы регулируют спецификацию энтодермы и последующие гаструляционные морфогенезы у Nematostella и у стрекающих с аполярным типом гаструляции? Почему область гаструляционных морфогенезов у билатерий оказалась связана с вегетативным полюсом и регионом аккумуляции β-катенина в ядрах клеток? Ясно одно, современный взгляд на консервативность участия β-катенина в спецификации энтодермы и регуляции гаструляционных морфогенезов у животных нуждается в пересмотре.
Обсуждаемая статья была выложена авторами на сайт bioRxiv.org в виде препринта (Lebedeva et al., 2022).
Lebedeva, T., Bostroem, J., Moersdorf, D., Niedermoser, I., Genikhovich, E., Adameyko, I., & Genikhovich, G. (2022). β-catenin-dependent endomesoderm specification appears to be a Bilateria-specific co-option. bioRxiv (https://www.biorxiv.org/...)
Lee, P. N., Kumburegama, S., Marlow, H. Q., Martindale, M. Q., & Wikramanayake, A. H. (2007). Asymmetric developmental potential along the animal–vegetal axis in the anthozoan cnidarian, Nematostella vectensis, is mediated by Dishevelled. Developmental biology, 310(1), 169-186.
Salinas-Saavedra, M., Rock, A. Q., & Martindale, M. Q. (2018). Germ layer-specific regulation of cell polarity and adhesion gives insight into the evolution of mesoderm. Elife, 7, e36740.
Wikramanayake, A. H., Hong, M., Lee, P. N., Pang, K., Byrum, C. A., Bince, J. M., ... & Martindale, M. Q. (2003). An ancient role for nuclear β-catenin in the evolution of axial polarity and germ layer segregation. Nature, 426(6965), 446-450.
Momose, T., Derelle, R., & Houliston, E. (2008). A maternally localised Wnt ligand required for axial patterning in the cnidarian Clytia hemisphaerica.
Leclère, L., Bause, M., Sinigaglia, C., Steger, J., & Rentzsch, F. (2016). Development of the aboral domain in Nematostella requires β-catenin and the opposing activities of S ix3/6 and F rizzled5/8. Development, 143(10), 1766-1777.
Lebedeva, T., Aman, A. J., Graf, T., Niedermoser, I., Zimmermann, B., Kraus, Y., ... & Genikhovich, G. (2021). Cnidarian-bilaterian comparison reveals the ancestral regulatory logic of the β-catenin dependent axial patterning. Nature communications, 12(1), 1-12.
Niedermoser, I., Lebedeva, T., & Genikhovich, G. (2022). Sea anemone Frizzled receptors play partially redundant roles in oral-aboral axis patterning. Development (Cambridge, England), 149(19), dev200785.
Vetrova, A. A., Lebedeva, T. S., Saidova, A. A., Kupaeva, D. M., Kraus, Y. A., & Kremnyov, S. V. (2022). From apolar gastrula to polarized larva: Embryonic development of a marine hydroid, Dynamena pumila. Developmental Dynamics, 251(5), 795-825.
Новость представили ©А.А. Ветрова и С.В. Кремнёв
15.11.2022