Inhibition of Proteasome LMP2 Activity Suppresses Chil3 Expression in Mouse Colon Adenocarcinoma Tissue and Restrains Tumor Growth//Oncol Res. 2025 Aug 28;33(9):2573-2595.
doi: 10.32604/or.2025.066611.

Область научных интересов: протеасомы, иммунная система, протеасомные механизмы онтогенеза и злокачественного процесса.

Область научных интересов: протеолитическая регуляция внутриклеточных процессов и межклеточных взаимодействий с участием протеасом в норме и при онкопатологии.
Протеасомы – мультисубъединичные комплексы, в которых гидролизуется большая часть внутриклеточных белков. У млекопитающих и человека выявлено семь различных протеолитических субъединиц протеасом: β1, β2, β5 (конститутивные), β1i, β2i, β5i (иммунные), β5t ¬(тимусная), которые кодируются разными генами. β5t обнаруживается в составе протеасом тимуса, остальные – в клетках всех органов, но в разном соотношении. В определенных условиях (при воспалении, появлении в организме чужеродных белков и др.) соотношение форм протеасом меняется: усиливается экспрессия всех трех иммунных субъединиц, и собираются новые комплексы, содержащие иммунные протеолитические субъединицы вместо конститутивных субъединиц β1i, β2i и β5i . Иммунные протеасомы обладают высокой химотрипсинподобной активностью и более эффективно, чем конститутивные протеасомы, образуют пептиды, подходящие для встраивания в ГКГ класса 1. Поскольку субъединица LMP7 проявляет выраженную химотрипсинподобную активность и катализирует гидролиз белков после гидрофобных аминокислот, которые образуют специфическую С-концевую структуру, необходимую для связывания пептидов с молекулами ГКГ класса I, именно она считается ключевой субъединицей в образовании антигенных эпитопов.
Данная парадигма утверждалась в мировой науке в течение нескольких десятилетий. При этом вновь появляющиеся результаты ее подтверждали. Так, были обнаружены смешанные формы протеасом, содержащие и иммунные, и конститутивные субъединицы: LMP7-LMP2-β2, LMP7-β1-β2 (Guillaume et al., 2010). Поскольку субъединица LMP7 была выявлена в составе всех вновь открытых форм протеасом, ей по-прежнему отводилась первостепенная роль, а существование смешанных форм связывали с увеличением репертуара антигенных эпитопов, ими продуцируемых (Guillaume et al., 2010).
LMP2 (low molecular mass protein 2) или β1i-субъединица является одной из трех иммунных субъединиц протеасом млекопитающих и человека. Несмотря на то, что она также проявляет химотрипсинподобную активность, ей придают второстепенное значение в иммунном процессе. Так показано, что ее структура, но не активность, способствует образованию антигенных эпитопов LMP7-субъединицей (Basler et al., 2012). Мало того, у половозрелых животных не было обнаружено формы протеасом, содержащей LMP2-субъединицу в отсутствие LMP7-субъединицы. Образование такой формы удалось индуцировать в клетках в нефизиологических условиях LMP7-нокаута при воспалении в низких количествах по сравнению с другими формами (Joeris T et al., 2012). Этот факт подтверждал существующую парадигму о второстепенной роли LMP2-субъединицы.
Аннотируемая статья Астаховой Т.М. с соавторами меняет парадигму иммунных протеасом и взгляд на LMP2-субъединицу.
Во-первых, было показано существование формы протеасом, содержащей субъединицу LMP2 в отсутствие субъединицы LMP7.
Во-вторых, было выявлено участие протеасом, содержащих субъединицу LMP2, в образовании опухолевых конгломератов.
В-третьих, была открыта ключевая роль протеасом с субъединицей LMP2 в развитии иммунологической толерантности.
Рассмотрим экспериментальные доказательства этих трех новых положений по порядку.
1. В опухолевых клетках С26 присутствуют протеасомы, содержащие субъединицу LMP2 без субъединицы LMP7.
Клетки С26 – клетки аденокарциномы толстой кишки мыши Balb/с – при подкожной транспланции мышам этой же линии в 100% случаев образуют опухоли, которые, как и многие солидные опухоли, характеризуются повышенным содержанием иммунных субъединиц LMP7 и LMP2. При этом степень прироста LMP2-субъединицы по сравнению с контрольными тканями значительно превосходит этот показатель для LMP7-субъединицы. Этот факт указывает на возможное содержание в опухоли протеасом с субъединицей LMP2 без LMP7, функция которых связана с опухолевым процессом.
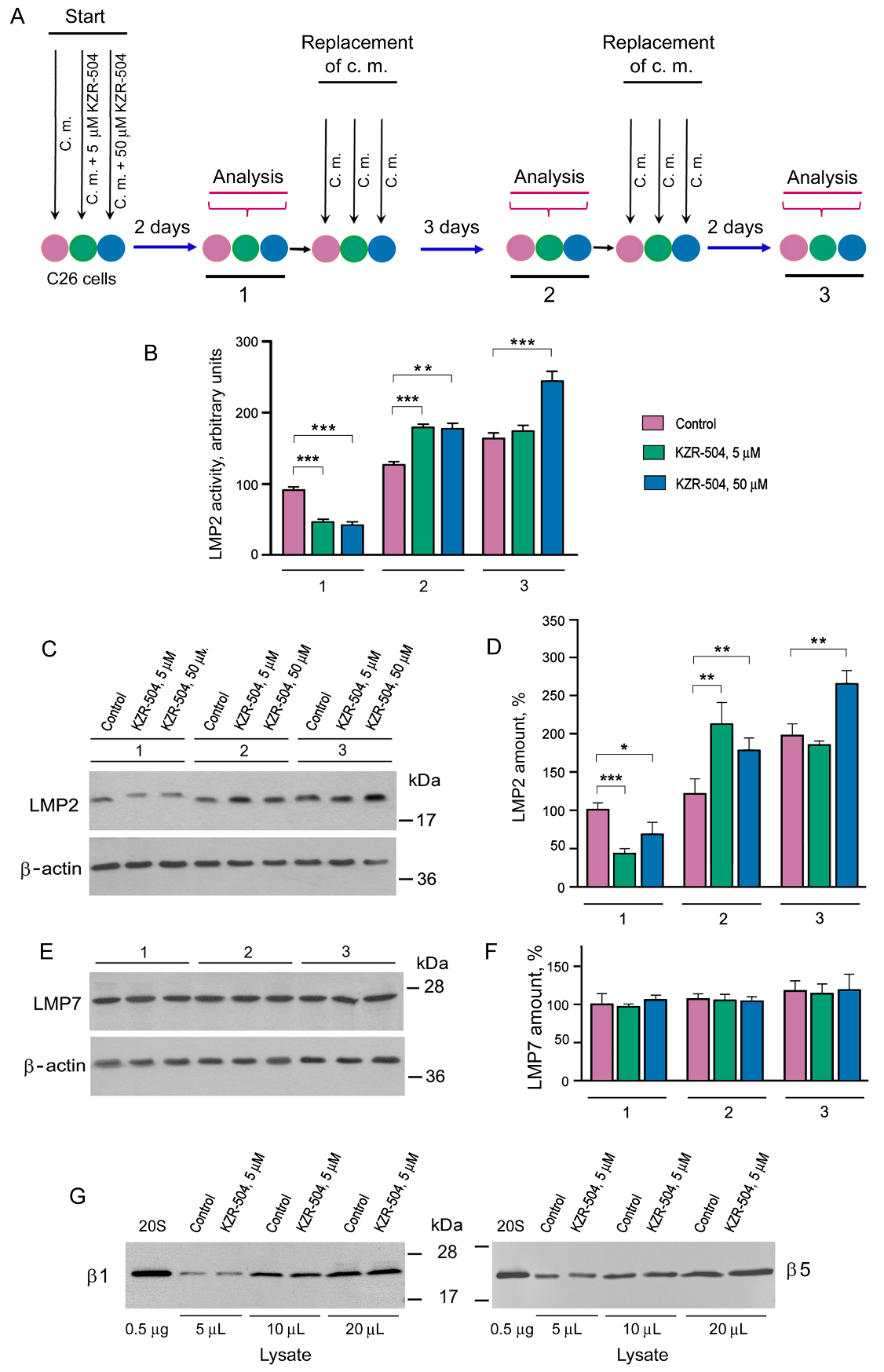
Клетки С26 культивировали в присутствии и в отсутствие необратимого ингибитора LMP2-активности, KZR-504, в двух концентрациях – 5 мкМ и 50 мкМ и анализировали физиологическое состояние клеток, длительность действия ингибитора при смене среды культивирования и специфичность действия этого ингибитора на субъединицу LMP2 (рис. 1). После 48 часов культивирования с ингибитором клетки С26 не теряют жизнеспособности и активно пролиферируют. При этом субъединица LMP2, связываясь с KZR-504, меняет физико-химические свойства и электрофоретическую подвижность (рис. 1С), а ее гидролитическая активность по отношению к флуорогенному коммерческому субстрату падает до 50% (5 мкМ) и 56% (50 мкМ) (рис. 1А. В, стадия 1). При дальнейшем трехдневном культивировании клеток, преинкубированных с ингибитором, в среде без ингибитора, активность LMP2 возрастает до одинакового уровня в обоих образцах (рис. 1А, В, стадия 2), а еще через два дня сравнивается с контрольными значениями в образцах, преинкубированных с 5 мкМ KZR-504, но остается повышенной в образцах с начальной концентрацией 50 мкM KZR-504 (рис. 1А, В, стадия 3). Динамика активности соответствует динамике содержания LMP2-субъединицы в исследуемых образцах (рис. 1С, D).
Изменения, выявленные для LMP2-субъединицы, не затрагивают LMP7-субъединицу, что говорит о наличии в клетках С26 протеасом с LMP2-субъединицей без LMP7-субъединицы. В противном случае динамика изменения содержания этих субъединиц не отличалась бы столь разительно (рис. 1). А именно, все изменения, вызванные ингибитором, затрагивают протеасомы с субъединицей LMP2: происходит уничтожение структур с испорченной LMP2-субъединицей и последующая сборка новых протеасом с нормальной LMP2-субъединицей – сначала в излишне высоком количестве, которое со временем приходит в норму. Вся эта сложная динамика выявляется на фоне неизменного содержания протеасом с субъединицей LMP7 (рис. 1E, F). Следует отметить, что всплеск экспрессии протеасом с субъединицей LMP2, но не LMP7, ранее был детектирован в перинатальный период развития кишечника крысы (Karpov et al., 2022).
Важно, что KZR-504 не связывался также с конститутивными субъединицами и не менял их подвижности в геле (рис. 1G), что указывает на высокую его специфичность по отношению к субъединице LMP2 и на правомочность его использования для исследования функций этой субъединицы.
Тот факт, что подавление активности LMP2 с помощью KZR-504 не влияет на жизнеспособность клеток С26, предполагает значение этой субъединицы для межклеточных взаимодействий при формировании опухолевых конгломератов после трансплантации клеток животным.
Рис. 1. Определение продолжительности действия KZR-504 на субъединицы протеасом в клетках С26. (А) Схема эксперимента. C. m. – культуральная среда. 1, 2, 3 — первая, вторая и третья стадии анализа. Стадия 1: два дня после начала культивации С26-клеток в отсутствие (control) и присутствии 5 мкM and 50 мкM KZR-504. Стадия 2: Три дня после исключения KZR-504 из культуральной среды. Стадия 3: Пять дней после исключения KZR-504 из культуральной среды. (B) Активность LMP2-субъединицы (гидролиз Ac-Pro-Ala-Leu-AMC). (C) Вестерн-блоты субъединицы LMP2. (D) Относительное количество субъединицы LMP2. (E) Вестерн-блоты субъединицы LMP7. (F) Относительное количество субъединицы LMP7. (G) Вестерн-блоты субъединиц β1 и β5 через два дня культивации клеток С26 в отсутствие (control) и присутствии 5 мкM KZR-504. 20S – очищенная конститутивная 20S протеасома, 0,5 мкг. Количество субъединиц в клетках С26 после их культивации в течение первых двух дней в отсутствие KZR-504 взято за 100%. Показано стандартное отклонение. Достоверная разница при at p < 0.05 (*), p < 0.01 (**) и p < 0.001 (***), n = 4.
2. Протеасомы, содержащие субъединицу LMP2, участвуют в образовании опухолевых конгломератов.
На основании полученных данных о динамике изменения содержания и активности субъединицы LMP2 были разработаны две in vivo модели развития С26 аденокарциномы (таблица 1).
Модель 1 была полезна для проверки возможной вовлеченности протеасом с LMP2-субъединицей, локализованных в С26 клетках и/или клетках микроокружения, в развитие опухоли. Модель 2 позволила проверить возможность участия протеасом с LMP2-субъединицей, локализованных именно в С26 клетках, в формировании опухолевых конгломератов.
Как в контроле, так и в моделях 1 и 2, опухолевые конгломераты формировались в области бедра у самок мышей Balb/c на 4-й день после подкожной трансплантации клеток С26 в эту область. Однако в модели 1 средний объем конгломератов был в 4 раза меньше (при пониженной активности LMP2), а в модели 2 – в 3 раза больше (при повышенной активности LMP2), по сравнению с контролем (рис. 2А и В). Этот эксперимент указывает на участие протеасом с субъединицей LMP2 в формировании опухолевых конгломератов. Отметим, что результаты, полученные на модели 2, представляют собой строгое доказательство вовлеченности протеасом с LMP2-субъединицей, локализованных именно в опухолевых клетках, в процесс формирования опухолевых конгломератов.
На 21-й день активность LMP2-субъединицы была почти на 60% ниже в опухоли в модели 1, чем в контроле (рис. 2С). Средний вес опухоли при этом был в два раза меньше (рис. 2D). Кроме того, было исследовано микроокружение – экспрессия mRNA гена Chil3 (chitinase-3-like protein 3), ключевого маркера иммуносупрессорных М2 макрофагов, и mRNA гена IL-6, провоспалительного цитокина. Хотя IL-6 является маркером М1 макрофагов с противоопухолевой функцией, он может экспрессироваться и в других клетках, включая инфильтрованные иммунные клетки, стромальные клетки и опухолевые клетки. Оказалось, что в модели 1 экспрессия mRNA Chil3 подавлена в 10 раз по сравнению с контролем (рис. 2Е). Однако экспрессия mRNA IL-6 достоверно при этом не изменялась (рис. 2F). В модели 2 все рассмотренные показатели не изменялись на 21-й день по сравнению с контролем, очевидно из-за того, что активность LMP2-субъединицы успевала к этому моменту сравняться с нормальным уровнем.
Таким образом, модель 1 позволила установить, что протеасомы с субъединицей LMP2 вовлечены в поддержание функциональности клеток микроокружения, по крайней мере, М2 макрофагов.
Рис. 2. Влияние измененной LMP2-активности на формирование и развитие опухолевых конгломератов. (A) Объем опухолевых конгломератов на 4-й день после трансплантации клеток С26 мышам. (B) LMP2-активность в опухолевых конгломератах на 4-й день. (C–F) Характеристики опухоли на 21-й день после трансплантации клеток С26 мышам. (C) LMP2-активность в опухоли. (D) Вес опухоли. (E) Экспрессия mRNA Chil3 в опухолевой ткани. (F) Экспрессия mRNA IL-6 в опухолевой ткани. Показано стандартное отклонение. Достоверная разница при p < 0.01 (**) и p < 0.001 (***), n = 10 и n = 4 (a). Chil3 - chitinase-3-like protein 3.
3. Протеасомы с субъединицей LMP2 играют ключевую роль в развитии иммунологической толерантности.
В связи с полученными результатами было важно ответить на вопрос: не участвуют ли протеасомы с субъединицей LMP2 в поляризации М0 макрофагов в М2 макрофаги? Или только поддерживают активность уже поляризованных М2 макрофагов? Эта задача была решена при получении макрофагов из клеток костного мозга мышей Balb/c и инкубации их с ингибитором KZR-504 в разной последовательности с цитокинами, вызывающими определенную поляризацию (рис. 3).
Показано, что KZR-504 тормозит экспрессию mRNA Chil3 и белка Chil3 в М2 макрофагах (рис. 3А, В, образец 2) и блокирует ее при попытке перевести М0 в М2 макрофаги (рис. 3А, В, образец 3). Важно отметить, что Chil3 является маркером М2 макрофагов мыши. Для того, чтобы связать полученные результаты с ситуацией у человека, была исследована экспрессия mRNA гена Arginase 1 (Arg1), который присутствует в М2 макрофагах и мыши, и человека. KZR-504 подавлял экспрессию mRNA Arg1 в поляризованных М2 макрофагах десятикратно (рис. 3С). Интересно, что на экспрессию mRNA IL-6 в поляризованных М1 макрофагах KZR-504 влияния не оказывал. В данной системе in cellulo IL-6 является истинным маркером М1 макрофагов в отличие от ткани опухоли in vivo.
Рис. 3. Влияние KZR-504 на экспрессию макрофагальных маркеров. (A) Экспрессия mRNA гена Chil3. (B) Содержание белка Chil3 (Вестерн-блоты и относительное количество). Приведена молекулярная масса стандартных белков. (C) Экспрессия mRNA гена Arg1 (Arginase 1). (D) Экспрессия mRNA гена IL-6.1: M2 макрофаги, поляризованные из M0 макрофагов в культуральной среде, содержащей 20 нг/мл коктейля IL-4 и IL-10. 2: M2 макрофаги в той же самой культуральной среде + 5 мкM KZR-504, инкубация 48 ч. 3: M0 макрофаги + 5 мкM KZR-504, инкубация 48 ч, исключение KZR-504 (новая порция культуральной среды) + 20 нг/мл коктейля IL-4 и IL-10, инкубация 24 ч. 4: M1макрофаги, поляризация из M0 макрофагов в культуральной среде, содержащей 100 нг/мл LPS, инкубация 3 ч. 5: M0 макрофаги + 100 нг/мл LPS и 5 мкM KZR-504, инкубация 3 ч. 6: M1 макрофаги, поляризованные из M0 макрофагов в культуральной среде, содержащей 100 нг/мл LPS, инкубация 27 ч. 7: M0 макрнофаги + 100 нг/мл LPS, инкубация 3 ч, + 5 мкМ KZR-504, инкубация 24 ч. Показано стандартное отклонение. Достоверная разница при p < 0.05 (*), p <0.01 (**), and p < 0.001 (***); для (A) и (C) n = 6, для (B) n = 4, для (D) n = 5.
Таким образом, протеасомы с субъединицей LMP2 важны для перехода макрофагов из М0 типа в М2 тип и для поддержания последних в активном состоянии.
Присутствие М2 макрофагов в ткани опухоли было подтверждено иммуногистохимией с использованием антител к мембранному маркеру CD163 (рис. 4А). С помощью Вестерн-блоттинга выявлено, что KZR-504 уменьшает количество CD163-маркера в опухолевой ткани, иными словами, сокращает содержание нормально функционирующих М2 макрофагов (рис. 4В).
Рис. 4. Детектирование М2 макрофагов, инфильтрованных в опухолевую ткань, с использованием антител к CD163. (A) Иммуногистохимический анализ опухоли на 10-й день после трансплантации клеток С26 мышам. Шкала 50 мкм. (B) Анализ содержания CD163 в контрольных опухолевых образцах и в опухолевых образцах в модели 1 на 21-й день с помощью Вестерн-блоттинга. Показано стандартное отклонение. Достоверная разница при p < 0.05 (*); n = 5.
В заключение можно сказать, что ингибирование LMP2-сбъединицы подавляет активность иммуносупрессорных М2 макрофагов в опухолевом микроокружении и тормозит опухолевый рост. Очевидно, что LMP2-субъединица может быть подходящей мишенью противоопухолевого воздействия. В то же время результаты анонсируемой работы указывают на необходимость непрерывного лечения с помощью необратимых LMP2-ингибиторов до достижения ожидаемого результата.
Список литературы
Basler M et al. Why the structure but not the activity of the immunoproteasome subunit low molecular mass polypeptide 2 rescues antigen presentation//J Immunol. 2012;189(4):1868–77. doi:10.4049/jimmunol.1103592.
Guillaume B et al. Two abundant proteasome subtypes that uniquely process some antigens presented by HLA class I molecules//Proc Natl Acad Sci U S A. 2010;107(43):18599–604. doi:10.1073/pnas.1009778107.
Joeris T et al. The proteasome system in infection: impact of β5 and LMP7 on composition, maturation and quantity of active proteasome complexes//PLoS One. 2012;7(6):e39827. doi:10.1371/journal.pone.0039827.
Karpov NS, Erokhov РА, Sharova NP, Astakhova TM. How Is the Development of the Rat’s Small Intestine Related to Changes in the Proteasome Pool?// Russ J Dev Biol. 2022;53(1):41–50. doi:10.1134/S1062360422010040.
Новость подготовили
Шарова Наталья Петровна, заведующий лабораторией биохимии процессов онтогенеза ИБР РАН, гнс, дбн.
Астахова Татьяна Михайловна, кбн, внс лаборатории биохимии процессов онтогенеза ИБР РАН.
15.10.2025