 © Новокрещенова Анна Никитична,
© Новокрещенова Анна Никитична,
аспирант лаборатории клеточных и молекулярных основ гистогенеза ИБР РАН
Сахарный диабет – тяжелое заболевание, связанное с повышенной опасностью образования хронических язв конечностей. По данным медицинской статистики, в 84% случаев развития хронических язв пациентам впоследствии требуется ампутация.
Гипергликемия пагубно влияет на ряд клеточных процессов и приводит к образованию и накоплению активных форм кислорода (АФК) за счет нарушения метаболизма глюкозы и синтеза NADPH. В свою очередь, избыток АФК приводит к гиперактивации экспрессии провоспалительного транскрипционного фактора NF-κB. При хроническом воспалении замедляется ангиогенез, снижается синтез внеклеточного матрикса фибробластами и усиливается его деградация матричными металлопротеазами; происходит постоянная активация нейтрофилов, которые также выделяют АФК и усугубляют окислительный стресс. В условиях непрерывного воспаления становится невозможным полноценное заживление ткани.
В настоящей работе авторы исследуют влияние гемопоэтических стволовых клеток (ГСК) с иммунофенотипом CD34+ на заживление хронических ран на модели NOD/SCID мышей с индуцированным диабетом. CD34 — трансмембранный фосфогликопротеин, обеспечивающий межклеточную адгезию и связь стволовых клеток с внеклеточным матриксом костного мозга на раннем этапе кроветворения. У человека CD34 является маркером ранних гемопоэтических стволовых клеток.
Модельным объектом служили NOD/SCID мыши, диабет у которых вызывали серийным введением стрептозотоцина. Выделенные из пуповинной крови человека и размноженные in vitro CD34+ клетки трансфецировали GFP и внутривенно вводили мышам на вторые сутки после нанесения полнослойных кожных ран. Влияние введенных клеток оценивали как иммуногистохимически, так и на молекулярном уровне, анализируя уровни экспрессии медиаторов воспаления.
Самым наглядным результатом, полученным авторами, является значительно более эффективное заживление кожных ран после введения CD34+ ГСК по сравнению с контролем (Рис.1). Также при исследовании срезов кожной ткани в области ранения отмечалось значительное ускорение реэпитализации. Иммуногистохимически был выявлен рост суммарной площади капилляров в поврежденной области после введения CD34+ клеток, а трехцветное окрашивание срезов по Массону выявило повышенное отложение коллагена во внеклеточном матриксе по сравнению с контролем. Помимо прочего, было отмечено увеличение общего числа фибробластов и снижение активности ММП-1 (коллагеназы) и ММП-3 (желатиназы).
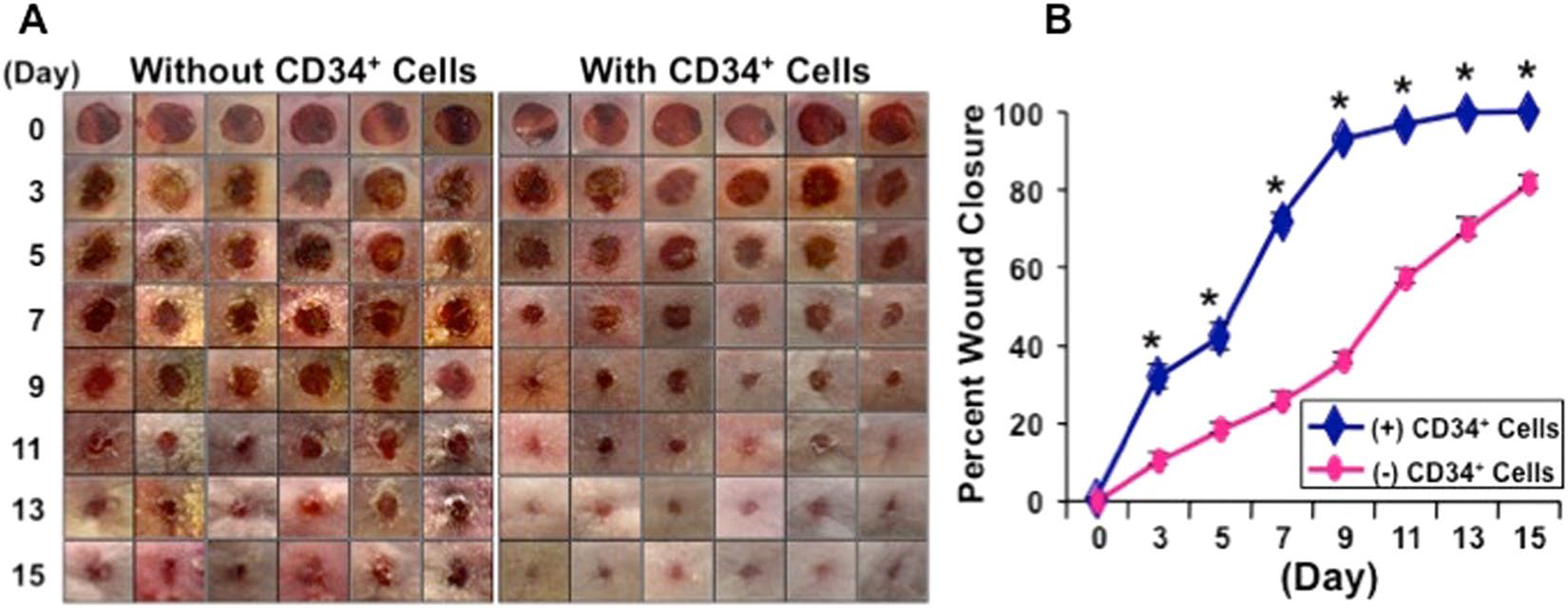
Рис.1. Процесс заживления кожных ран мышей в контроле и после внутривенного введения CD34+ клеток. Было отмечено значительное ускорение заживления ран в опыте.
Реакцией на миелопероксидазу в ткани выявлялось число активированных нейтрофилов, которое было значительно снижено после введения CD34+ клеток по сравнению с контролем. Также при введении CD34+ ГСК в ткани снизилась экспрессия провоспалительных цитокинов TNF-α и IL-1β и повысилась экспрессия противовоспалительного IL-10.
В литературе уже описана роль NF-κB в активации матричных металлопротеаз (ММП) за счет связывания NF-κB со специальным локусом в промоторе ММП. Используя метод ChIP, в данной работе авторы также доказали, что это связывание является TNF-α-зависимым, так как в присутствии TNF-α NF-κB гораздо активнее связывался с промотором ММП-1, чем в необработанном контроле (Рис.2). При сокультивировании обработанных TNF-α фибробластов с CD34+ клетками степень связывания NF-κB с промотором ММП-1 значительно снижалась. Это указывает на способность CD34+ ГСК непосредственно влиять на пути активации экспрессии некоторых генов.
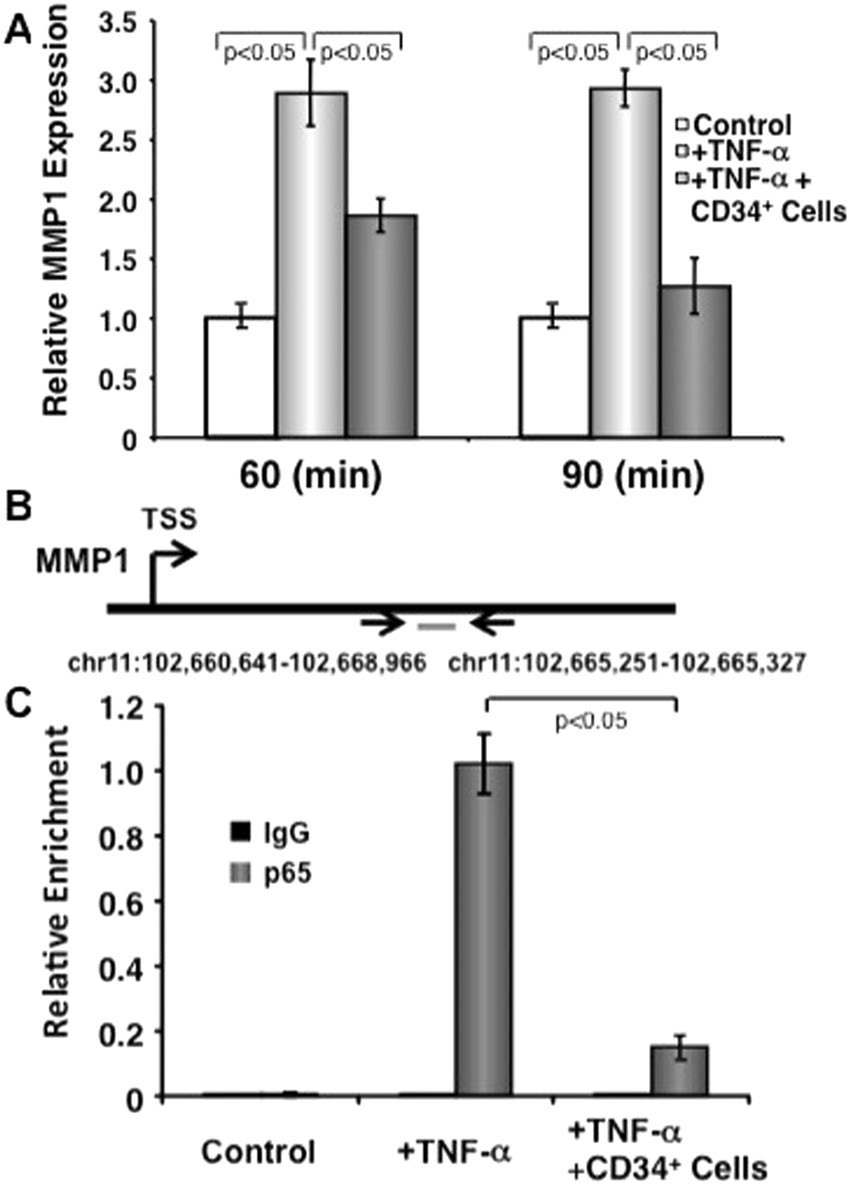
Рис.2. Регуляция NF-κB-опосредованной экспрессии ММП-1 клетками CD34+. A. Относительная экспрессия ММП-1 в культуре дермальных фибробластов, обработанных только TNF-α или обработанных TNF-α и сокультивированных с CD34+ клетками. B. Схема гена ММП-1 с отмеченным сайтом старта транскрипции и с предполагаемым сайтом связывания NF-κB. C. Степень связывания NF-κB в области промотора ММП-1.
Данные, полученные Kanji, S. et al. (2019), свидетельствуют о том, что CD34+ клетки обладают противовоспалительным действием и могут способствовать регенерации повреждений ткани. В настоящей работе показано, что заживление диабетических язв на модели мыши протекало достаточно эффективно, о чем свидетельствуют ускоренные процессы васкуляризации, реэпитализации и снижение воспаления. Исходя из этого, авторы считают целесообразной дальнейшую разработку методов терапии хронических диабетических язв на основе CD34+ ГСК.
Новость подготовила © Измайлова Л.Ш.
07.10.2019