В августе 2025 года в Science вышла работа группы Лорен Мёрфи и коллег из Оксфорда, которая полностью меняет представление о тромбоцитах. До сих пор считалось, что эти безъядерные клетки крови могут содержать только РНК, унаследованную от мегакариоцитов, а с ДНК они никак не связаны. Однако авторы показали, что тромбоциты способны захватывать фрагменты внеклеточной ДНК (cell-free DNA, cfDNA) прямо во время циркуляции и хранить их внутри мембранных везикул. Исследование началось с простого вопроса: если тромбоциты способны к поглощению вирусных нуклеиновых кислот, не способны ли они к поглощению эндогенной ДНК, которая появляется в плазме при апоптозе или злокачественном росте? Используя окраску ДНК-специфическими красителями и флуоресцентную микроскопию, авторы убедились, что часть тромбоцитов действительно содержит фрагменты ядерной ДНК (рис. 1B). Количественный анализ показал, что примерно 8% тромбоцитов у здоровых доноров интенсивно накапливают ДНК. Более того, при выделении ДНК из тромбоцитов её выход был выше, чем из стандартной «тромбоцитарно-очищенной» плазмы, которая используется для жидкостных биопсий.
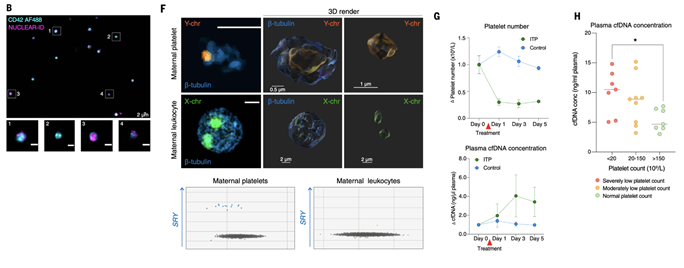
Для проверки того, что данная ДНК не наследуется от мегакариоцитов, а именно захватывается в крови, исследовали образцы беременных женщин. В тромбоцитах матерей, вынашивающих мальчиков, удалось визуализировать фрагменты Y-хромосомы с помощью FISH, тогда как в лейкоцитах и эритроцитах тех же образцов их не было (рис. 1F). Это доказывает, что тромбоциты способны забирать циркулирующую фетальную ДНК. Функция «очистки» плазмы от cfDNA подтвердилась в модели иммунной тромбоцитопенической пурпуры у мышей: при искусственном снижении числа тромбоцитов концентрация cfDNA в плазме резко возрастала (рис. 1G, H). То же самое наблюдалось у пациентов с низким числом тромбоцитов
Рис. 1 Захват внеклеточной ДНК тромбоцитами во время циркуляции. (B) Тромбоциты здорового донора (CD42, циан) демонстрируют внутриклеточный флуоресцентный сигнал красителя NUCLEAR-ID, интеркалирующегося в двунитевую ДНК (пурпурный); белыми рамками обозначены увеличенные области. Масштаб: 2 мкм. (C) Поточная цитометрия выявила, что приблизительно 8% циркулирующих тромбоцитов имеют высокую интенсивность окраски ДНК-специфическим красителем DRAQ5 (n = 20). (F) Методами FISH и ddPCR выявлены фрагменты гена SRY Y-хромосомы в материнских тромбоцитах, но не в лейкоцитах женщин, беременных мужским плодом. Контрастное окрашивание β-тубулином (синий), визуализация с использованием ZEISS LSM900 при увеличении ×63. (G) У мышей после индуцированного антителами снижения числа тромбоцитов зафиксировано достоверное повышение концентрации cfDNA (n = 20). (H) У пациентов с иммунной тромбоцитопенической пурпурой и выраженной тромбоцитопенией уровень плазменной cfDNA был значительно выше по сравнению с нормальными показателями (*P < 0,05).
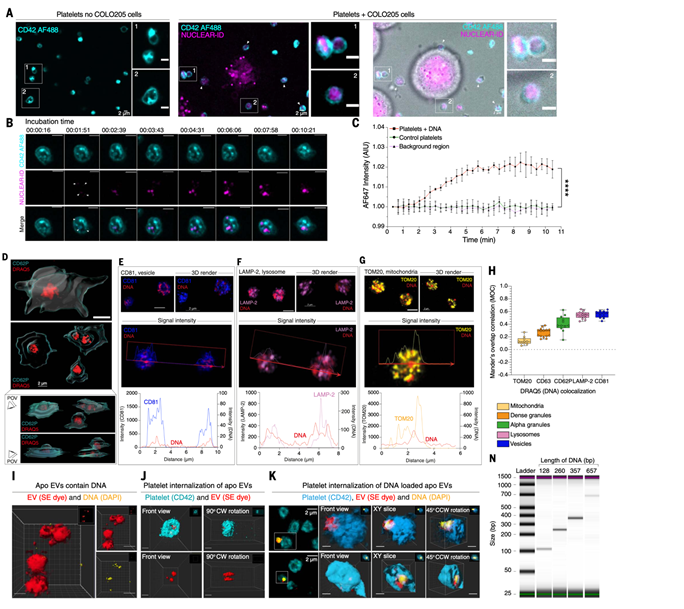
С помощью live-cell имиджинга авторы показали, что тромбоциты активно захватывают ДНК, выделенную опухолевыми клетками, и что процесс занимает всего несколько минут (рис. 2A–C). При этом ДНК может поступать как в составе внеклеточных везикул, выделяемых апоптотическими клетками (рис. 2I–K), так и в виде свободных фрагментов различной длины (рис. 2N). Захваченная ДНК локализуется во внутриклеточных везикулах, а не просто прикрепляется к поверхности (рис. 2D–H).
Рис. 2 Быстрая интернализация внеклеточной ДНК тромбоцитами. (A–C) Тромбоциты здоровых доноров (CD42, циан) после коинкубации с клетками COLO205, меченными красителем NUCLEAR-ID (пурпурный), поглощают клеточную ДНК, что подтверждается живым тайм-лапс имиджингом и количественным анализом флуоресценции. Масштаб: 2–3 мкм. (D–H) Высокое разрешение (ZEISS LSM980) и 3D-визуализация показали, что ДНК локализуется во внутриклеточных везикулах (CD81) и лизосомах (LAMP-2), но не в митохондриях (TOM20). (I–K) Тромбоциты интернализуют внеклеточные везикулы, выделенные апоптотическими клетками BL2, содержащие ДНК, что подтверждается 3D-реконструкцией. Масштаб: 0,5–2 мкм. (N) С помощью электрофореза было показано, что тромбоциты способны захватывать также синтетические фрагменты ДНК длиной 128–657 п.н.
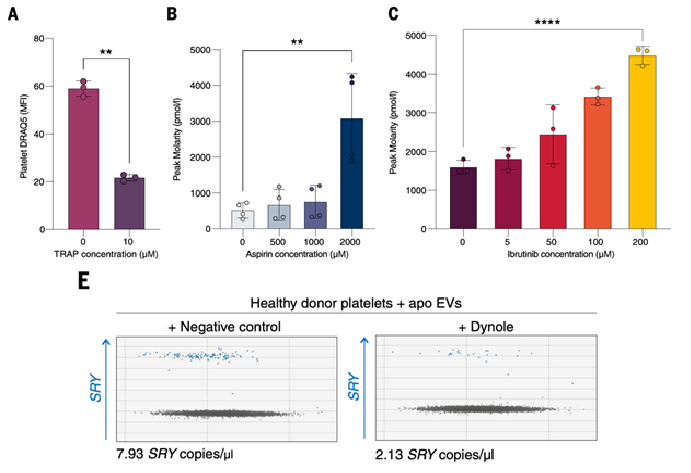
Интересно, что данный процесс захвата ДНК можно модулировать фармакологически. При активации тромбоцитов с помощью пептида, активирующего тромбиновый рецептор – TRAP-6, ДНК высвобождалась наружу, а при блокаде активации аспирином или ингибитором тирозинкиназы Брутона (BTK) – ибрутинибом - наоборот, удерживалась внутри клеток (рис. 3A–C). Также показано, что ДНК в тромбоцитах защищена от деградации ДНКазами (рис. 4E).
Рис. 3 Фармакологическая регуляция содержания ДНК в тромбоцитах. (A) Поточная цитометрия ДНК (DRAQ5) в тромбоцитах здоровых доноров при отсутствии и при активации TRAP-6 (10 мкМ); n = 3. (B, C) Ингибирование активации тромбоцитов аспирином (B) или ибрутинибом (C) увеличивает выход ДНК из тромбоцитарных пеллетов; n = 3–4 независимых эксперимента. (E, F) ddPCR-количественная оценка копий гена SRY в ДНК тромбоцитов женщин после инкубации с апоптотическими везикулами при наличии или отсутствии Dynole; ингибирование динамин-зависимого эндоцитоза снижает число копий SRY.
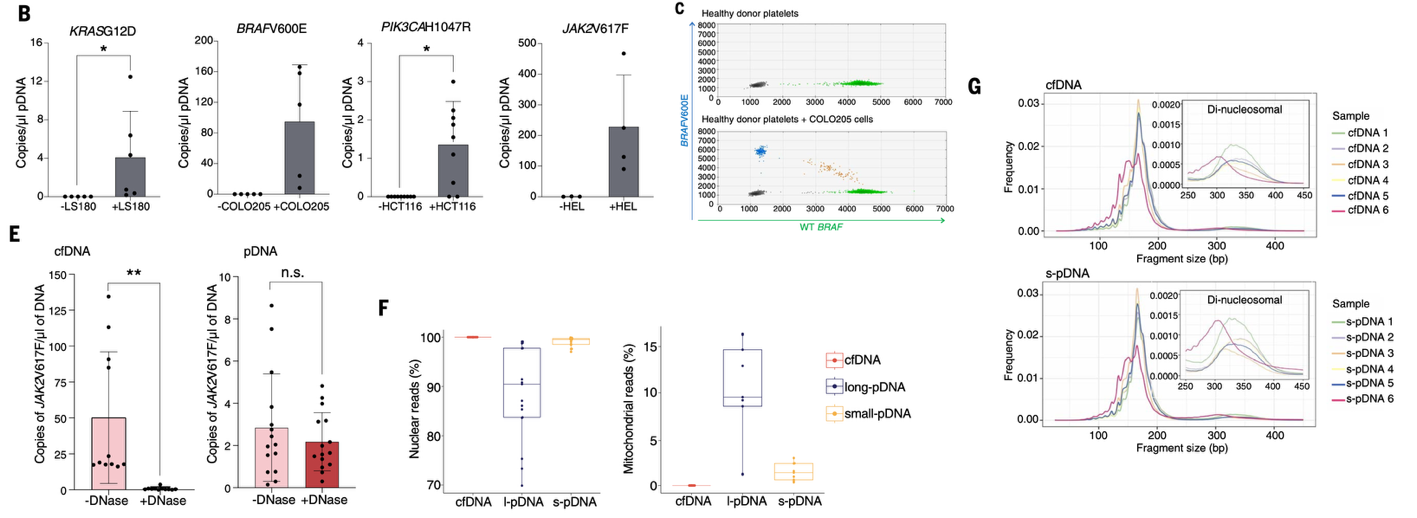
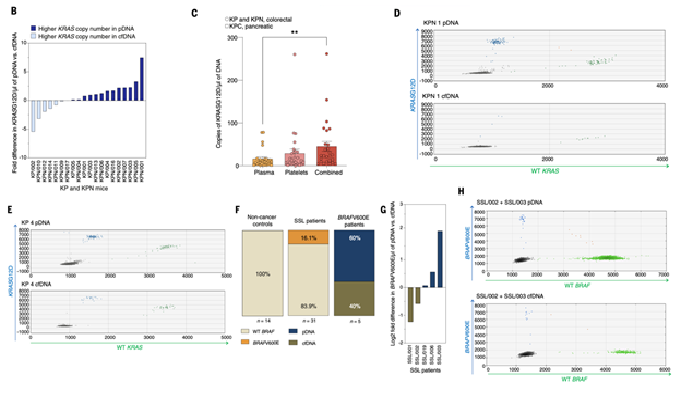
Ключевой момент статьи - обнаружение опухолевой ДНК в тромбоцитах пациентов. При инкубации с различными клеточными линиями тромбоциты захватывали характерные мутации (KRAS∧G12D, BRAF∧V600E, PIK3CA∧H1047R, JAK2∧V617F) (рис. 4B–C). У больных колоректальным и панкреатическим раком, а также у пациентов с предраковыми полипами, удалось выявить мутантные аллели именно в ДНК тромбоцитов, причём иногда в большем количестве, чем в классическом cfDNA из плазмы (рис. 5B–H). Это означает, что значительная часть циркулирующей опухолевой ДНК фактически «прячется» внутри тромбоцитов.
Рис. 4 Тромбоциты содержат спектр фрагментов ДНК, покрывающих ядерный геном человека, включая опухолевую ДНК с мутациями, ассоциированными с раком. (B) Количество копий мутантных аллелей в ДНК, выделенной из тромбоцитов после коинкубации с клеточными линиями колоректального рака (LS180, COLO205, HCT116) и эритролейкоза (HEL); каждая точка соответствует отдельному эксперименту, столбцы — среднее ± SD; *P < 0,05. (C) Представительный анализ ddPCR: количественное определение аллелей дикого типа BRAF и мутации BRAFV600E в ДНК тромбоцитов до и после коинкубации с клетками COLO205. (E) Влияние обработки ДНКазой на выявление мутантного аллеля JAK2 в ДНК тромбоцитов и в плазменной cfDNA после коинкубации с клетками HEL; данные приведены как среднее ± SD, n = 5; **P < 0,01. (F) Доля фрагментов, соответствующих ядерному и митохондриальному геному, в cfDNA и в коротких (100–600 п.н.) и длинных (>600 п.н.) фрагментах pDNA; n = 15 пациентов с гастроинтестинальной карциномой. (G) Распределение длин фрагментов для cfDNA (верхняя панель) и короткой pDNA (нижняя панель); у пациентов после терапии наблюдается основной пик ≈165 п.н. и меньший ≈325 п.н., тогда как у пациента с нелечёной панкреатической аденокарциномой фрагменты короче.
Геномный анализ показал, что ДНК в тромбоцитах повторяет свойства классической cfDNA - имеет нуклеосомные отпечатки, характерную длину фрагментов и метилирование, указывающее на происхождение в основном из лейкоцитов и мегакариоцитов, а также частично из печени (рис. 4F–J).
Рис. 5 Обнаружение драйверных мутаций в ДНК тромбоцитов (pDNA) и плазмы (cfDNA) у мышей с колоректальной аденокарциномой и у пациентов с предраковыми колоректальными поражениями. (B–E) ddPCR показал, что число копий KRAS∧G12D чаще выше в pDNA, чем в cfDNA у мышей после имплантации опухолевых клеток. (F–H) У пациентов с высокорисковыми предраковыми поражениями (SSL, n = 31) BRAFV600E выявлен в 16,1% случаев, тогда как в контрольной группе (n = 14) не обнаружен; в ряде случаев мутантные аллели определялись преимущественно в pDNA.
Таким образом, работа Murphy и соавторов демонстрирует, что тромбоциты - это не просто безъядерные клетки свёртывания, а активные участники обмена генетическим материалом в крови. Они способны поглощать и сохранять фрагменты ДНК, включая фетальную и опухолевую, защищать их от деградации и высвобождать при активации. Это открывает новые диагностические перспективы: включение анализа ДНК тромбоцитов в жидкостные биопсии может существенно повысить чувствительность выявления раннего рака или предраковых изменений. Более того, полученные данные открывают новое измерение в понимании роли тромбоцитов - они выступают активными регуляторами гомеостаза внеклеточной ДНК. Это имеет два ключевых следствия. Во-первых, физиологическое: тромбоциты снижают провоспалительный потенциал cfDNA, ограничивая её концентрацию в циркуляции, и, возможно, высвобождают ДНК в местах активации, модулируя локальные иммунные реакции. Во-вторых, клиническое: тромбоциты становятся новым объектом для жидкой биопсии, позволяя повысить чувствительность выявления опухолевой ДНК при низкой опухолевой нагрузке и использовать их в пренатальной диагностике. Эти результаты открывают перспективы для развития новых диагностических технологий и ставят вопросы о роли тромбоцитов в иммунном контроле и межклеточной коммуникации.
Новость подготовил
Ручко Е.С.
15.09.2025