 © Косых Анастасия Валерьевна,
кандидат биологических наук, младший научный сотрудник лаборатории клеточной биологии
© Косых Анастасия Валерьевна,
кандидат биологических наук, младший научный сотрудник лаборатории клеточной биологииПри разработке терапии для больных диабетом (1 типа и поздних стадий 2 типа) используется два подхода: технологический и клеточный. В первом случае, пациенту устанавливается система, инъецирующая инсулин в соответствии с показателями уровня глюкозы в крови. В другом варианте - применение клеточных технологий - контроль уровня глюкозы осуществляется трансплантированными инсулин-продуцирующими клетками. Несмотря на то, что технологический подход на данный момент является более простым, дешевым и распространенным, ряд проблем (скачкообразная регуляция обмена глюкозы, повреждения организма от гипогликемии, возможность отказа оборудования и отторжения имплантированных датчиков) приводит к тому, что разработка клеточных продуктов, как более физиологичного решения, все еще остается актуальной. Классическим донорским материалом являются островки, полученные после смерти. Основными минусами в их применении являются часто низкое качество, а также необходимость применения иммуносупрессоров для сохранения трансплантата. Множество исследований посвящены созданию оптимальной конфигурации хорошо функционирующих секреторных клеточных продуктов из подходящего, легко масштабируемого и доступного источника клеток, способного длительное время сохраняться в теле реципиента.
Авторы данной статьи применили комплексный подход при создании своего клеточного продукта, в основу которого они взяли ИПСК (индуцированные плюрипотентные стволовые клетки).
В первую очередь в композиции трансплантата были использованы несколько типов клеток в полисахаридном геле, для формирования 3D структуры формой, строением и размерами аналогичной нативным островкам поджелудочной железы, получившей название HILO (human islet-like organoid). Для воссоздания клеточной архитектуры и клеточного разнообразия нативных островков авторы включили в состав стволовые клетки жировой ткани и эндотелиальные клетки пупочной вены человека в качестве аналогов фибробластов и эндотелия поджелудочной железы.
В качестве доказательства функциональности полученных сфероидов авторы приводят данные увеличения экспрессии рецептора ERRγ, участвующего в регуляции постнатального метаболического созревания β-клеток в культуре, а также нормализацию показателей уровня глюкозы у NOD/SCID мышей с индуцированным стрептозотоциновым диабетом в течение 40 дней после трансплантации сфероидов под капсулу почки. Дополнительно, авторы показали, что именно трансплантат реагирует на увеличение уровня глюкозы, исходя из изменений уровня человеческого С-петида – предшественника инсулина.
Во-вторых, особое внимание, они уделили процессам, происходящим с клетками сфероидов при созревании в процессе дифференцировки in vitro. Исходя из ранее полученных данных, авторы включили в многоуровневый протокол дифференцировки ИПСК WNT4, как необходимый фактор для функционального созревании β-клеток ex vivo (Рис. 1). Органоиды, полученные в результате обработки WNT4 получили название wHILOs.
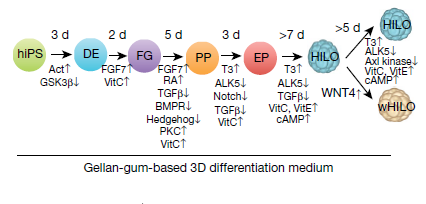
Рис. 1. Протокол дифференцировки HILO. Показаны ключевые факторы этапов. Стрелками вверх и вниз указаны агонисты и ингибиторы, соответственно. DE - дефинитивная энтодерма; EP - эндокринные предшественники; FG - задняя часть передней кишки; PP- предшественник поджелудочной железы; Act - активин А; РА – ретиноевая кислота; VitC - витамин C; VitE - витамин E; ALK5 - TGFBR1.
Для подробного изучения они модифицировали свои ИПСК с помощью системы CRISPR – Cas9, добавив ген GFP под инсулиновый промотер и RFP под промотер урокортина-3 (регулятора секреции соматостатина δ-клетками) для визуализации секреторной активности дифференцирующихся клеток. Полученные сфероиды были иммуногистохимически охарактеризованы по множеству панкреатических маркеров (Рис.2).
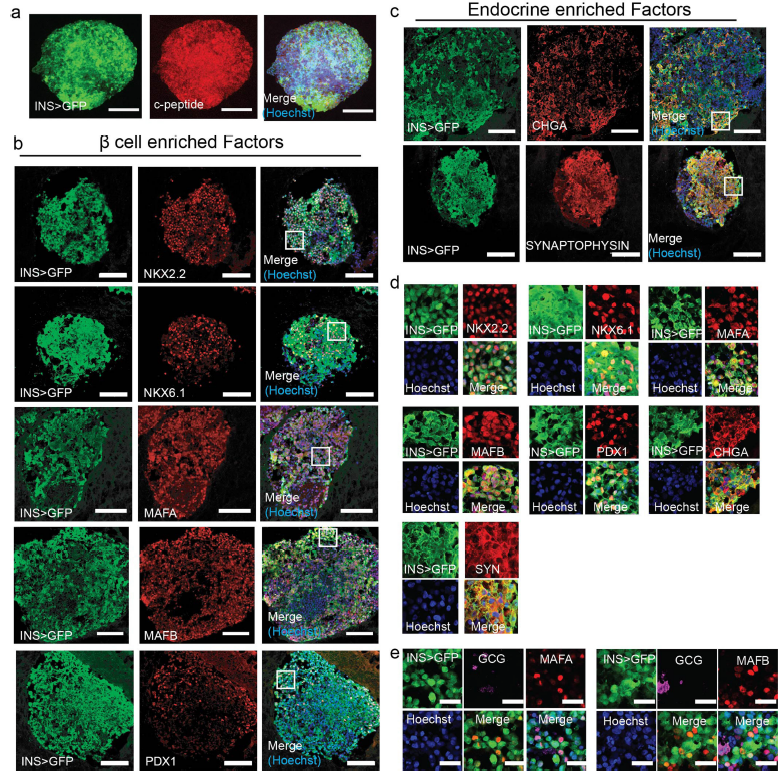
Рис. 2. Иммуногистохимическая характеристика wHILOs. (а-c) конфокальные изображения wHILO, окрашенные на C-пептид (a), маркеры β-клеток NKX2-2, NKX6-1, MAFA, MAFB, PDX1 (b) и эндокринные маркеры хромогранин A (CHGA), синаптофизин (красный) с GFP-визуализацией инсулина (зеленый) (в). (d) увеличение для (b) и (c) 75x75 мкм. (е) иммунофлуоресцентные изображения HILO, показывающие экспрессию инсулина (GFP), β-клеточных маркеров MAFA и MAFB, а также α-клеточного маркера глюкагона. Окрашивание ядер - Hoechst (синий). Масштабная линейка: 100 мкм (a – c), 10 мкм (e). Изображения получены от 3 независимых экспериментов.
Также с помощью электронной микроскопии было визуально подтверждено наличие секреторных гранул инсулина и глюкагона. Кроме того, была подтверждена нормализация показателей уровня глюкозы у диабетических NOD/SCID мышей в течение 42 дней после трансплантации wHILOs.
Сравнительный транскрипционный анализ подтвердил аналогичность wHILOs нативным островкам человека по экспрессии специфичных генов β-клеток (NKX6-1, NEUROD1, RFX6, GCK, ISL1, SYT4 и PDX1) и α-клеток (ARX-генов). Авторы отметили, что WNT4 дозозависимо увеличивал экспрессию ESRRG, а также компонентов митохондриальной дыхательной цепи NDUFA7 и COX7A2 в HILOs, что привело их к выводу, что в присутствии WNT4 у клеток повышается окислительный метаболизм, как было подтверждено показателями увеличения скорости потребления кислорода и снижением скорости внеклеточного закисления, что соответствует метаболическим характеристикам островков поджелудочной железы у здорового человека. Также авторы пришли к выводу, что в процессе созревания HILOs участвует неканонический WNT-сигналинг, поскольку использование ингибитора β-катенина XAV939 не влияло на глюкозо-зависимую секрецию инсулина. Для анализа WNT4-завимых процессов (100 нг/мл в течение 26–33 дней) авторы провели транскрипционный анализ и показали увеличение экспрессии 1581 гена и снижение для 1354. По результатам дальнейшего анализа, включающего в себя генную онтологию, сортинг клеток, ATAC-seq, авторы приходят к выводу, что неканонический WNT4-сигналинг усиливает митохондриальную активность, в значительной степени за счет индукции через ERRγ, что и приводит в результате к метаболическому созреванию β-подобных клеток.
На третьем этапе исследования для защиты трансплантата от иммунной системы реципиента авторы при помощи лентивирусной конструкции стимулировали экспрессию PD-L1 (programmed cell death protein ligand 1) – известного фактора толерантности β-клеток. При трансплантации иммуннокомпетентным мышам C57Bl со стрептозотоциновым диабетом было показано, что PD-L1+ HILOs регулируют уровень глюкозы до 50 дней после операции, в отличие от PD-L1- HILOs, функционировавших в организме около 10-15 дней. С помощью проточной цитометрии трансплантатов авторы показали снижение количества CD45+ иммунных клеток (Т-клеток, Т-киллеров) для PD-L1+ HILOs, а также незначительное количество инсулин-полижительных клеток в PD-L1- HILOs на 27 сутки после трансплантации. Функционал трансплантата был также подтвержден с помощью удаления почки, содержащей PD-L1+ HILOs, и демонстрации увеличения уровня глюкозы в крови животного. Параллельно было показано, что оверэкспрессия PD-L1 не влияет на статус и секреторный функционал дифференцированных ИПСК.
Кроме того, авторами был предложен альтернативные метод индукции экспрессии PD-L1 с помощью повторяющихся кратковременных воздействий IFN-γ (интерфероном- γ) в концентрации 10нг/мл. Исходя из полученных результатов, обработанные таким образом HILOs были защищены от IL-1β-индуцированной дедифференцировки β-клеток, демонстрировали хроматиновые изменения, устойчивое повышение уровней экспрессии целевых генов (PDL1, IRF9, JUNB и JUND) (данные ATAC-seq). Для этих органоидов была также показана и подтверждена функциональность при трансплантации мышам C57Bl в течение 40 дней; снижение количества CD45+ клеток. В результате авторы приходят к выводу, что такая стимуляция IFN-γ вызывает возникновение эпигенетической памяти, что приводит к формированию толерантности к цитокинам и устойчивой экспрессии PD-L1 de novo в HILOs, облегчая терапию диабета.
Таким образом, авторами был собран клеточный конструкт, симулирующий островки поджелудочной железы; разработан протокол дифференцировки для получения работающих клеток, чувствительных к глюкозе; применен метод защиты ксено- и аллотрансплантата от иммунной системы реципиента без использования иммуносупрессоров. В результате авторы разработали сложный и, как они сами признают, дорогостоящий для клинического применения клеточный продукт. Основной смущающий в этой работе момент – работоспособность трансплантата показана на срок в 50 суток, что в сравнении с имеющимися результатами по работе донорских островков на человеке (2 года), довольно небольшой. Несомненно, нативные островки обладают оптимальной клеточной архитектурой, а значит способны к более длительному функционированию, однако авторы просто не указывают, что происходит с их HILOs после этого срока в организме реципиента. Однако, статья опубликована совсем недавно, содержит большой набор протоколов, контролей, будет интересно узнать, к чему в дальнейшем придут авторы в изучении полученной конструкции.
Новость подготовила © Косых А.В.
15.09.2020