
 © Александра Ветрова, аспирантка лаборатории эволюции морфогенезов. Область научных интересов: биология развития беспозвоночных, EvoDevo, роль сигнальных путей в развитии.
© Александра Ветрова, аспирантка лаборатории эволюции морфогенезов. Область научных интересов: биология развития беспозвоночных, EvoDevo, роль сигнальных путей в развитии.
© Станислав Кремнёв, кандидат биологических наук, старший научный сотрудник, лаборатория эволюции морфогенезов ИБР РАН. Научные интересы: морфогенез, эволюция эмбрионального развития.
Т-боксный ген Brachyury давно известен биологам развития. Ещё в 1927 году Н. А. Добровольская-Завадская, работая во Франции, описала у мышей специфический фенотип мутации, которой дала название brachyury. Мыши, в геноме которых есть только одна мутантная аллель, обладают укороченными хвостами, а вот гомозиготы погибают ещё во время эмбрионального развития. Дело в том, что у хордовых животных транскрипционный фактор Brachyury исключительно важен для нормального развития хорды и мезодермы сомитов.
Впоследствии выяснилось, что ген Brachyury крайне консервативен. Он обнаружен не только у большинства Metazoa, но и у их одноклеточных родственников из супергруппы Opisthokonta. Если у организма в геноме есть только один Т-боксный ген, то это будет Brachyury. Эволюционно все остальные гены этой группы произошли именно от него.
Транскрипционный фактор Brachyury регулирует многие процессы развития у животных. Он необходим для формирования мезодермы не только у хордовых, но и у прочих Bilateria. Кроме того, он принимает участие в разметке осей тела животного и регулирует морфогенетические процессы в ходе гаструляции. Так, у многих организмов область активности Brachyury во время гаструляции расположена вокруг бластопора.
Вероятно, именно формирование осей тела, а также демаркация зародышевых листков в ходе гаструляции являются консервативными функциями Brachyury. Для исследования консервативных функций гена Brachyury многообещающими модельными объектами оказались стрекающие, представители типа Cnidaria. Связано это с тем, что они являются сестринской группой ко всем билатерально-симметричным животным. В исследованиях, проведённых на коралле Acropora digitifera, было показано, что Brachyury принимает участие в демаркации экто- и энтодермы во время гаструляции. Кроме того, исследования эмбрионального развития Nematostella, а также работы, посвящённые регенерации и бесполому размножению Hydra, продемонстрировали, что Brachyury необходим для спецификации орального полюса тела у стрекающих.
В ходе исследований Brachyury у Hydra выяснилось, что в её геноме есть две копии этого гена. Позднее несколько копий Brachyury было обнаружено у другого гидроида, Clytia chemisphaerica. Помимо гидроидов, несколько копий гена Brachyury было обнаружено у ланцетника, костистых рыб и лягушек рода Xenopus. Эти дупликации у хордовых произошли независимо друг от друга, но что насчёт гидроидов? Произошла ли дупликация у Hydra и C. hemisphaerica независимо друг от друга или же она случилась у их общего предка? Сколько вообще Brachyury у гидроидов?
Чтобы ответить на эти вопросы мы реконструировали филогенетическое древо Brachyury у книдарий (Vetrova et al., 2023). Мы проанализировали транскриптомы 16 видов книдарий, где обнаружили 33 последовательности Brachyury. К ним мы прибавили последовательности Brachyury всех прочих крупных клад животных за исключением губок. Поскольку Brachyury принадлежит к семейству транскрипционных фаторов с Т-бокс доменом, мы использовали гены Tbx в качестве аутгруппы. В итоге мы получили дерево, на котором ясно видно, что в типе Cnidaria произошли две последовательные дупликации гена Brachyury. Первая дупликация случилась у общего предка клады Medusozoa, к которой принадлежат классы Scyphozoa, а также Cubozoa, Staurozoa и Hydrozoa. Затем, одна из копий (Brachyury2/3) у общего предка гидроидов ещё раз дуплицировалась. Таким образом, в большинстве исследованных нами транскриптомов гидроидов мы обнаружили три копии гена Brachyury: Brachyury1, 2 и 3. Исключением является Hydra, которая потеряла ген Brachyury3 в ходе эволюции (рис.1)
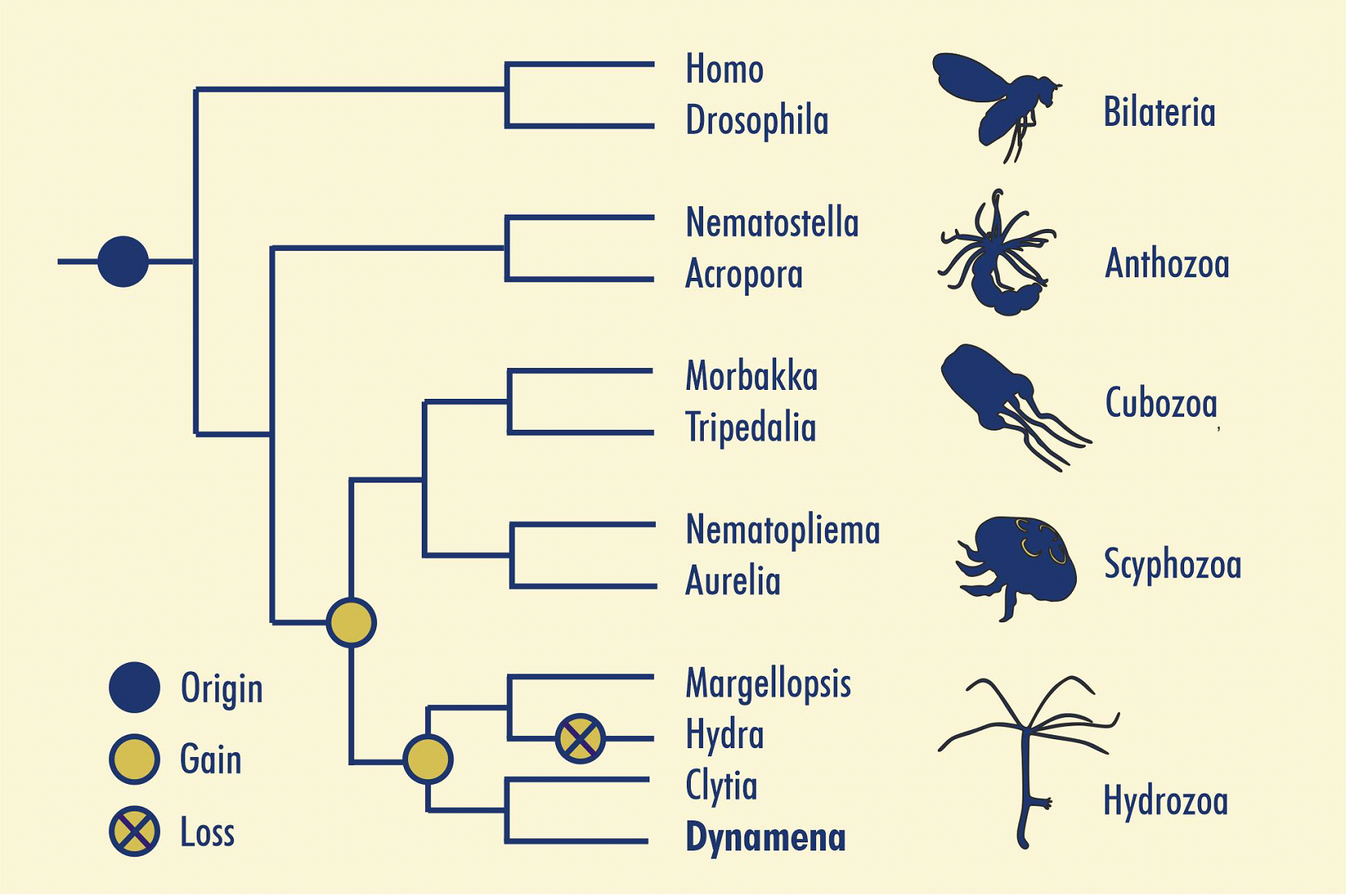
Сравнение аминокислотных последовательностей Brachyury у гидроидов показало, что последовательности Brachyury1 являются наиболее консервативными. Последовательности Brachyury3 наименее консервативны: они различаются как по аминокислотному составу, так и по длине.
Далее мы решили исследовать, к каким функциональным последствиям привели дупликации Brachyury у гидроидов. Всего возможно несколько сценариев. Во-первых, дуплицированная копия может вовсе потерять какую-либо функциональную нагрузку, стать псевдогеном и исчезнуть. Возможно, именно это произошло с утраченным Brachyury3 у Hydra. Два других возможных исхода - это субфункционализация и неофункционализация.
В случае субфункционализации дуплицированные копии “делят” между собой функцию изначального гена. На уровне экспрессии подобный исход часто выражается в том, что области экспрессии копий дополняют друг друга и вместе отражают исходную область экспрессии изначального гена. Именно это произошло после дупликации Brachyury у костистых рыб. У них только в случае мутации по обоим копиям гена Brachyury проявляется фенотип, похожий на тот, что был описан у мышей Добровольской-Завадской.
В случае неофункционализации одна из копий приобретает функцию, которой не было у исходного гена. Это становится возможным из-за того, что другая копия гена полностью обеспечивает исходную функцию, так что давление отбора на копию, проходящую через неофункционализацию, падает. На уровне экспрессии неофункционализации часто выражается в виде возникновения новой области активности гена. Неофункционализация стала последйствием дупликации Brachyury у Xenopus laevis.
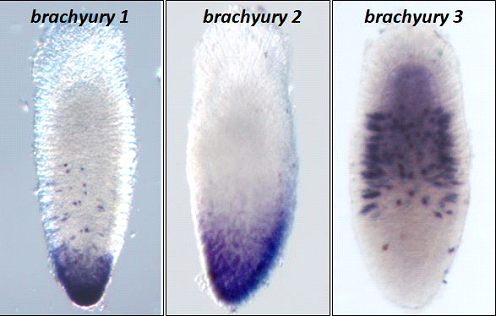
Чтобы оценить, к каким последствиям для функций гена привели дупликации Brachyury у гидроидов, мы изучили пространственные паттерны экспрессии трёх паралогов (так называются копии прошедшего через дупликацию гена в геноме одного организма) Brachyury у беломорского гидроидного полипа Dynamena pumila.
Выяснилось следующее. На стадии личинки планулы Brachyury1 и Brachyury2 у D. pumila экспрессируются на оральном полюсе. Однако мы не увидели этот консервативный паттерн экспрессии в случае Brachyury3. Вместо орального полюса этот ген экспрессируется в эктодермальных клетках в центральном домене личинки. Форма экспрессирующих Brachyury3 клеток очень характерна и позволяет предположить, что они являются нервными клетками (рис. 2). Что интересно, в одном из исследований у другого гидроида, Podocoryne carnea, также была показана экспрессия Brachyury не на оральном полюсе личинки. У P. carnea он экспрессируется на аборальном полюсе и, согласно нашему филогенетическому анализу, этот Brachyury является геном Brachyury3.
Мы предположили, что если у Brachyury3 отличается паттерн экспрессии (и, вероятно, функция), то может и регуляция у него другая по сравнению с остальными Brachyury? Известно, что ген Brachyury является прямым таргет-геном канонического сигнального пути Wnt (cWnt) у большинства исследованных животных. Таким образом, воздействуя на активность данного каскада, можно модулировать уровень экспрессии Brachyury. У D. pumila эта закономерность выполняется для Brachyury1 и Brachyury2. Если гипер-активировать cWnt при помощи фармакологического агента азакенпауллона, их области экспрессии расширяются. При подавлении активности данного каскада с помощью другого агента, iCRT14, области паттернов их экспресии наоборот сокращаются. А вот в случае Brachyury3 мы такого не наблюдаем. Область его экспрессии сдвигается из-за изменения формы личинки под действием модуляторов, но сама экспрессия не становится ни слабее, ни сильнее.
Разница в паттернах экспрессии и регуляции позволяет нам предположить, что у D. pumila произошла неофункционализация Brachyury3. Впрочем, на других этапах жизненного цикла разница в паттернах уже не является столь яркой. Например, в гипостоме (ротовом конусе) гидранта экспрессируются все три Brachyury. Сходным образом в гипостоме экспрессируются оба Brachyury у Hydra. Вероятно, в гидранте роль всех трёх Brachyury осталась консервативной. Поделив между собой эту функцию, они участвуют в поддержании орально-аборальной оси тела.
Ещё одним регионом колонии D. pumila, где мы исследовали экспресcсию генов Brachyury, стала верхушка роста побега. Колония D. pumila устроена сложно, она состоит из стелящихся по субстрату столонов и несущих гидранты побегов. Каждый побег состоит из отдельных модулей, узлов, несущих по бокам два гидранта. Новый модуль образуется на верхушке побега, где в верхушке роста происходят циклические морфогенетические процессы. В активной верхушке роста мы обнаружили экспрессию Brachyury1 в её апикальной эктодерме, которую можно считать производной от орального домена личинки. А вот Brachyury2 экспрессируется тоже в апикальной эктодерме, но только по бокам, в тех регионах, где будут формироваться гидранты нового модуля. Вероятно, у него есть некая ассоциированная именно с гидрантами функция. А вот экспрессию Brachyury3 мы в верхушке роста не обнаружили вовсе.
Изучив пространственные паттерны экспрессии и проверив регуляцию генов Brachyury со стороны сигнального пути cWnt, мы решили проверить их функциональную консервативность. Для этого мы задействовали известную экспериментальную систему; анимальную шапочку гаструлы у лягушки Xenopus. Как известно, неиндуцированные клетки анимальной шапочки лягушки должны формировать эпидермис. Однако инъекция мРНК Brachyury1 D. pumila в эмбрион лягушки на стадии 2-4 клеток вызывала в клетках анимальной шапочки экспрессию мезодермальных маркёров шпорцевой лягушки. Этот результат показывает, что Brachyury1 действительно очень консервативный ген. Кстати, подобного результата можно добиться, если заколоть лягушке ген Brachyury из одноклеточной Capsaspora. А вот инъекция Brachyury2 и 3 к подобному результату не приводит.
Подведём итоги. Мы показали, что в ходе эволюции стрекающих произошли две последовательные дупликации гена Brachyury. У кораллов Brachyury только один, у сцифоидных и кубоидных медуз по два, а вот у гидроидов мы обнаружили целых три Brachyury. Из них Brachyury1 оказался самым консервативным на уровне последовательности, на уровне паттернов экспрессии и функционально. Brachyury 2 и 3 демонстрируют признаки суб- и неофункционализации. Функционально они не столь консервативны как Brachyury1, а у Brachyury3 ещё и изменилась регуляция по сравнению с остальными Brachyury. При этом граница между суб- и неофункционализацией оказалась не чёткой и зависит от стадии развития и части колонии. Случай последовательной дупликации Brachyury у стрекающих представляется многообещающим для исследования последствий дупликации генов.
Vetrova, A.A., Kupaeva, D.M., Kizenko, A., Lebedeva, T.S., Walentek, P., Tsikolia, N. and Kremnyov, S.V., 2023. The evolutionary history of Brachyury genes in Hydrozoa involves duplications, divergence, and neofunctionalization. Scientific Reports, 13(1), p.9382.
Новость подготовили
© Александра Ветрова и Станислав Кремнёв
15.06.2023