Работа Guixian Liang и коллег направлена на разработку подхода для получения гемопоэтических стволовых и прогениторных клеток путём кокультивирования гемогенных клеток с модифицированными клетками линии HUVEC. Ранее было показано, что клетки линии ОР9-DL1, полученные из костного мозга, при культивации с клетками гемогенного эндотелия из аорто-гонадо-мезонефрального (АГМ) региона способны репрограммировать последние в гемопоэтические стволовые клетки (ГПСК) 1. Однако при пересадке в костный мозг, полученные таким образом клетки, со временем вырождаются, так как теряют способность к самовоспроизводству.
Похожими способностями к запуску репрограммирования обладают клетки HUVEC с трансдуцированным в них геном E4ORF1 (HUVEC-E4). Кроме этого клетки HUVEC-E4 способны запускать перепрограммирование мышиных зрелых эндотелиальных клеток в гематопоэтические клетки. В то же время OP9-DL1 не способны перепрограммировать зрелые мышиные эндотелиальные клетки, что говорит о том, что сигнальные пути, активируемые клетками OP9-DL1 и HUVEC-E4, запускающие процессы связанные с репрограммированием клеток отличаются.
Для подтверждения данной гипотезы о различии этих путей был взят гемогенный эндотелий АГМ региона (аНЕ) и компоненты плацентарных сосудов (рНЕ). При помощи сортировки клеток была выделена популяция гемогенных клеток положительных по CD44. Через 7 дней культивирования данных клеток в присутствии HUVEC-E4ORF1 было показано, что гемогенные клетки приобрели характерную для гемопоэтических клеток морфологию и стали экспрессировать ключевой для данного типа клеток маркёр CD45. В данной популяции клеток авторами было отмечено увеличение экспрессии участвующих в гемопоэзе генов: Runx1, Ly6a, Gfi1, Cmyb и снижение экспрессии эндотелиальных генов Flk1 и Cdh5. Ставшие положительными по CD45 клетки смогли образовывать гранулоцито-моноцитарные, миелойдные, эритройдные колонии и колонии мегакариоцитов. Более того in vivo трансплантация и оценка приживаемости через 4, 6, 12 и 20 недель клеток АГМ региона, кокультивируемых с HUVEC-E4 (aHE-iHSPC) показала, что данные клетки имеют как короткоживущую (4 недели), так и долгоживущую (20 недель) способность к восстановлению кроветворения. Дальнейшую свою работу исследовательская группа разделила на несколько пунктов.
Пункт 1. Выявление механизма образования образование aHE-iHSPC клеток.
Для понимания механизмов, позволяющих клеткам HUVEC-E4 стимулировать образование aHE-iHSPC клеток были проведены Bulk РНК секвенирования, показавшие, что в клетках HUVEC-E4 снижены экспрессии генов пролиферации. В тоже время была отмечена оверэкспрессия генов, участвующих в регуляции ангиогенеза и морфогенеза кровеносных сосудов. Также была значительно увеличена экспрессия гена BMP4, который способствует запуску эндотелиально-гемопоэтического перехода (ЭГП) клеток. Кроме этого Gene Set Enrichment Analysis показал, что в клетках HUVEC-E4 активен путь, задействующий Toll-подобные рецепторы. Активация данного пути, согласно литературным данным2, на которые ссылаются авторы, способствует генерации гемопоэтических стволовых клеток (ГСК). Более того гены, связанные с Notch сигнальным путем, например, Jag1 и Hes4 участвующие в ЭГП, также имели повышенную экспрессию. Такие наблюдения позволили исследователям предположить, что клетки HUVEC-E4 способствуют образованию гемогенного эндотелия и образованию гемопоэтических клеток. Помимо генетического пути, отвечающего за гемопоэтическое развитие, в клетках HUVEC-E4 была отмечена активация генов, участвующих в повышенной экспрессии цитокинов и иммунном ответе клеток. Например, был повышен ген, отвечающий за экспрессию IL-33, играющего важную роль в дифференцировке гемогенного эндотелия. Кроме этого транскрипомный анализ показал увеличение экспрессии IL1A и CX3CL1. Блокировка данных белков (пептидов) снижала количество получаемых ГПСК клеток. Что говорит, о вовлеченности IL1A и CX3CL1 в образование и дифференцировку гемопоэтических стволовых клеток. Таким образом E4ORF1 в HUVEC-E4 клетках способствует их перестройке и позволяет оказывать влияние на генерацию гемопоэтических клеток из гемогенного эндотелия.
Пункт 2. Дифференцировка клеток pHE в клетки pHE-iHSPC.
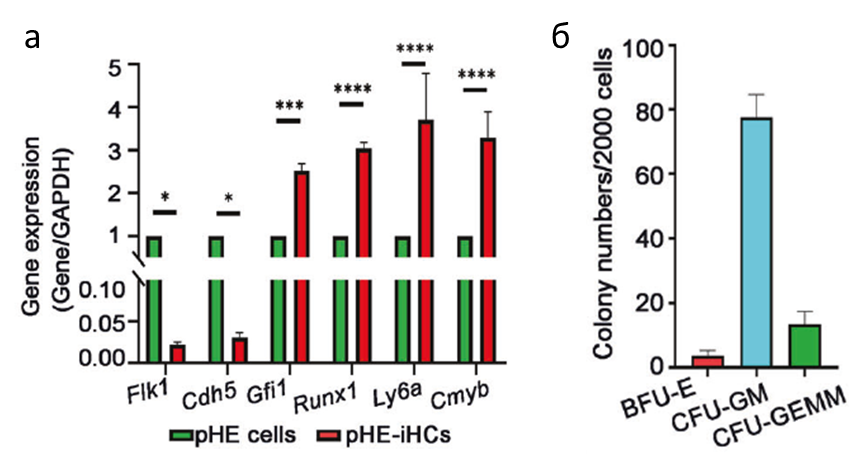
Коллектив также задался вопросом, возможно ли в in vitro условиях получить гемопоэтические стволовые клетки из плацентарного гемогенного эндотелия (pHE). Полученная при помощи сортировки чистая фракция рНЕ клеток при ко-культивировании с HUVEC-E4. Так через неделю полученные в ходе ко инкубации клетки pHE-iHSPC стали экспрессировать маркёр CD45 и принимать фенотип гемопоэтических клеток, тогда как экспрессия эндотелиальных генов снизилась. Кроме этого они также, как и aHE-iHSPC стали образовывать эритройдные (BFU-E), грануло- и моноцитарные колонии (CFU-GM), а также смешанные колонии, состоящие из миелойдных, эритройдных клеток и мегакариоцитов (CFU-GEMM) (Рис. 1). Полученные таким образом клетки pHE-iHPSC при трансплантации способны приживаться, однако в меньшей степени чем aHE- iHPSC, что характеризуется низким уровнем химеризма после трансплантации. Из чего можно сделать то, что pHE-iHPSC и aHE- iHPSC разные, а способность к самообновлению у pHE-iHPSC ниже.
Рисунок 1 а. Изменение экспрессии генов связанных с эндотелиальными и гематопоэтическими свойствами клеток рНЕ и pHE-iHPSС (n = 3.) б. Результат CFU теста pHE-iHPSC, отсортированных с помощью FACS (GFP+CD45+c-Kit). n = 3.
Пунтк 3. Отличия в клеточных типах, полученных из aHE и рНЕ клеток, выявленные транскриптомом единичных клеток.
Для определения причин разницы в продуцировании гемопоэтических клеток было проведено РНК секвенирование единичных GFP+CD45+ клеток, полученных при кокультивировании аНЕ либо рНЕ клеток с HUVEC-E4.
Так среди аНЕ клеток при помощи UMAP анализа было выявлено 6 популяций: aHE-iHSPC1, характеризующейся наличием экспрессии генов Mpo, Runx1 и Kit; aHE-iHSPC2, характеризующаяся экспрессией генов Myb, Cd34 и Hoxa9; aHE-индуцированные моноциты/макрофаги, имеющие высокую экспрессию гена Ccr2; aHE-миелоидные предшественники, экспрессирующие Cd33; и две субпопуляции aHE-индуцированных макрофагов, экспрессирующие либо Mpeg1, либо Adgre1.
Среди клеток, полученных после кокультивации рНЕ с HUVEC-E4 были выделены pHE-iHSPC, характеризующейся экспрессией Runx1; pHE-iHPC, экспрессирующие Kit, Itga2b, Ly6a и Cd34; pHE-iMyeP - миелоидные предшественники, экспрессирующие либо Cd33, либо Cebpe; pHE-индуцированные гранулоциты (pHE-iGranu), экспрессирубщие Ceacam1; pHE-iMac экспрессирующие Mpeg1.
Основываясь на более детальном UMAP анализе исследователями был сделан вывод, что aHE клетки в большей степени дифференцируются в моноциты и макрофаги, в то время как из pHE клеток получаются миелоидные предшественники.
Пункт 4. Сравнительный транскриптомный анализ выявил недостаток в экспрессии генов, отвечающих за самообновление в pHE-iHSPC клетках.
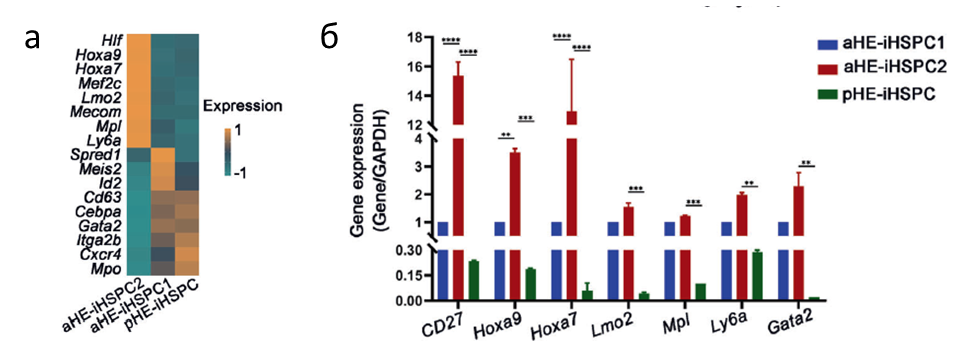
Кроме этого авторами статьи были показано, что одной из причин менее эффективного приживления клеток после трансплантации является низкая экспрессия генов, участвующих в процессе самообновления клеток. Сравнение транскриптомов полученных линий показало, что pHE-iHSPCs имеют не достаточные уровни экспрессии таких генов как Hoxa9, Hoxa7, Lmo2, Mpi, Ly6a, Gata2, прямо либо косвенно участвующих в процессах поддержания уровня клеток, что также было подтверждено при помощи ПЦР.
Рисунок 2. а. Тепловая карта, показывающая экспрессию генов, связанных с самообновлением ГПСК, и других генов, связанных с гемопоэтическими клетками, в pHE-iHSPC, aHE-iHSPC1 и aHE-iHSPC2. б. Анализ методом ПЦР в реальном времени, показывающий экспрессию генов, связанных с самообновлением HSC, в aHE-iHSPC и pHEiHSPC соответственно, n = 3. Планки погрешностей, средние значения ± SD. **P < 0,01, ***P < 0,001, ****P < 0,0001. Значения P рассчитывали с помощью непарного t-критерия Стьюдента.
Пункт 5. Обработка клеток ретиноевой кислотой способствует увеличению уровня экспрессии генов, связанных с самообновление в HSPC клетках, полученных из pHE клеток.
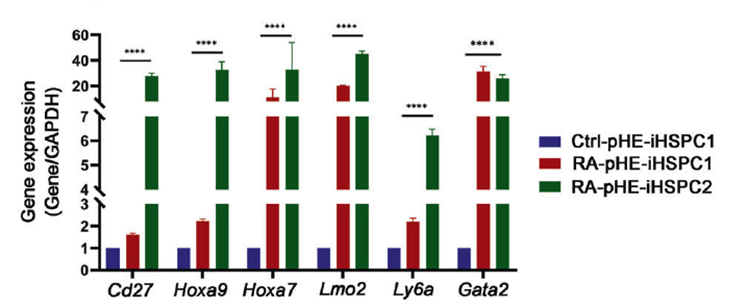
В попытке увеличить способности pHE iHSPC клеток к самовосстановлению, авторы прибегли к обработке клеточных культур ретиноевой кислотой. Кокультивация рНЕ и HUVEC-E4 в присутствии РК привела к увеличению выхода количества CD45 положительных клеток и увеличению экспрессии генов, отвечающих за самообновление гемопоэтических клеток. Кроме этого, увеличилась экспрессия генов Hoxa9, Hoxa7, Lmo2, Ly6a, Gata2. Также клетки, культивированные в присутствии РК смогли прижиться и восстановить часть гемопоэтической системы мыши.
Ри
сунок 3 qPCR анализ экспрессии генов отвечающих за самообновление ГПСК при добавлении ретиноевой кислоты, n = 3. Данные представлены в виде среднего ± SD. ***P < 0.001, ****P < 0.0001. Значения P рассчитывали с помощью непарного t-критерия Стьюдента.Таким образом, в работе Guixian Liang показано, что гемогенный эндотелий в зависимости от его локализации даёт начало различным форменным элементам крови. Путём кокультивирования гемогенных клеток с модифицированными получилось преобразовать aHE и рНЕ клетки мыши в iHSPC. Более того, научный коллектив, опубликовавший данную статью, выяснил, что aHE-iHSPC обладают долгосрочным восстановлением и способностью к самообновлению. Также показано, что клетки pHE могут быть успешно преобразованы в iHSPC, однако обладают ограниченной способностью к самообновлению. Сравнительный анализ субпопуляций полученных таким образом клеток aHE-iHSPC и pHE-iHSPC показал, что гены, ассоциированные с самообновлением, специфично экспрессируются в aHE-iHSPC2, а функциональная экспериментальная проверка показала, что обработка клеток ретиноевой кислотой способствует преобразованию pHE в pHE-iHSPC, способных к самообновлению. Проведённые исследования открывают как новые фундаментальные аспекты в понимании образования гемопоэтических стволовых клеток в развитии, так затрагивают и прикладные вопросы, например, позволяют рассматривать плаценту как источник гемогенных клеток для дальнейшего использования.
- Li Z, Zhou F, Chen D, He W, Ni Y, Luo L, Liu B. Generation of hematopoietic stem cells from purified embryonic endothelial cells by a simple and efficient strategy. J Genet Genomics. 2013 Nov 20;40(11):557-63. doi: 10.1016/j.jgg.2013.09.001. Epub 2013 Sep 20. PMID: 24238609.
- Capitano ML. Toll-like receptor signaling in hematopoietic stem and progenitor cells. Curr Opin Hematol. 2019 Jul;26(4):207-213. doi: 10.1097/MOH.0000000000000511. PMID: 31033704.
Новость подготовил
© Блохин Виктор, н.с. ЦКП ИБР РАН.
15.05.2025