 © Игнатюк Василина Михайловна, кандидат биологических наук, младший научный сотрудник лаборатории биохимии процессов онтогенеза.
© Игнатюк Василина Михайловна, кандидат биологических наук, младший научный сотрудник лаборатории биохимии процессов онтогенеза.
Область научных интересов: клеточные и молекулярные механизмы нейроэндокринных и иммунных взаимодействий в онтогенезе.
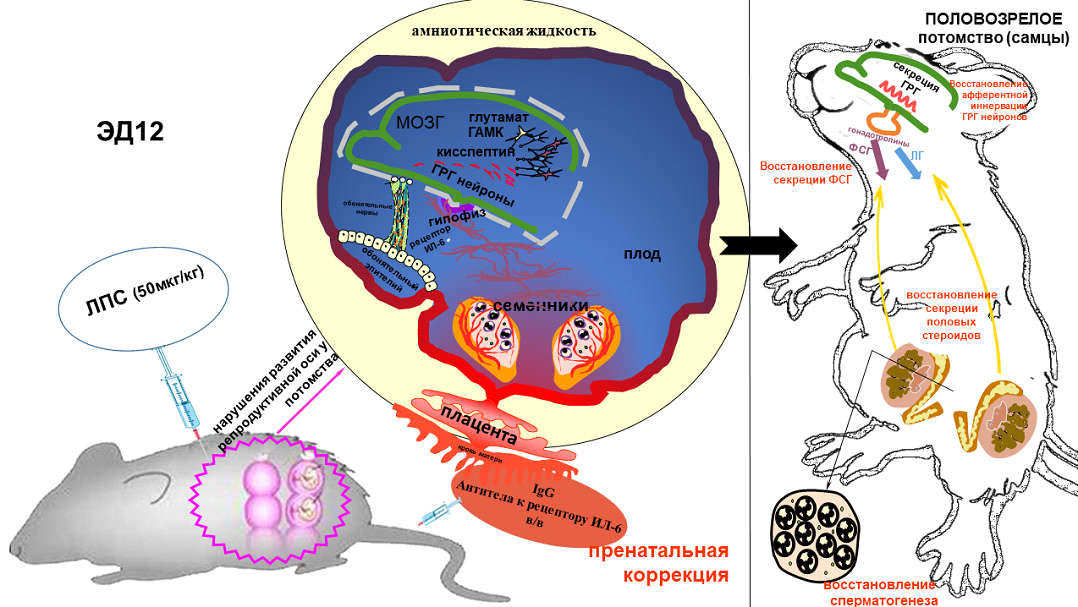
По данным ВОЗ, около 12%-15% семейных пар страдают бесплодием различной этиологии. Изучение причин бесплодия и подходов к его коррекции является не только научной, но и социальной проблемой. Однако проводимая в половозрелом возрасте терапия зачастую не позволяет устранить выявленные нарушения, поскольку становление репродуктивной оси начинает закладываться с раннего развития. Ключевым регулятором гипоталамо-гипофизарно-гонадной или репродуктивной оси является гонадотропин-рилизинг-гормон (ГРГ), продуцируемый нейронами гипоталамуса (ГРГ нейроны). От частоты пульсации ГРГ зависит синтез лютеинизирующего и фолликулостимулирующего гормонов аденогипофиза и, следовательно, секреция половых гормонов гонадами. Отличительной особенностью развития ГРГ нейронов является их внемозговое происхождение из эпителия обонятельных плакод и последующая миграция вдоль проростающих нервов из носа в мозг. В гипоталамусе они образуют сеть афферентных синаптических связей, которые необходимы для регуляции частоты пульсации выбросов ГРГ в кровь.
В процессе развития репродуктивная ось отвечает на воздействия различных неблагоприятных факторов, включая воспалительные процессы, вызванные инфекционными агентами. Ранее нами было показано, что активный компонент грамотрицательных бактерий липополисахарид (ЛПС) вызывает системное воспаление, сопровождающееся резким повышением содержания провоспалительных цитокинов как у матери, так и плодов грызунов (Sharova et al., 2015). Повышенный уровень цитокинов на начальных этапах миграции ГРГ нейронов в мозг (12-й день эмбрионального развития, ЭД12) приводит к их задержке в носу. Несмотря на то, что к рождению все ГРГ нейроны успевают мигрировать в мозг, у половозрелого потомства происходят нарушения полового созревания и репродуктивных функций (Izvolskaia et al., 2019). В опубликованной работе была выдвинута гипотеза, что нарушения миграции ГРГ нейронов, вызванные воспалением в пренатальном периоде, могут привести к нарушениям их афферентной синаптической иннервации и, следовательно, полового созревания.
У половозрелых самцов крыс, подвергавшихся воздействию ЛПС на ЭД12, на ГРГ нейронах обнаружено снижение числа синаптических контактов, а также содержания циркулирующего фолликулостимулирующего гормона гипофиза и нарушения структуры и функций гонад. Следует отметить, что воздействие ЛПС на начальных этапах внутримозговой миграции ГРГ нейронов (ЭД18) не приводило к подобным нарушениям.
Поскольку отдалённые негативные последствия пренатального воспаления плохо поддаются лечению в половозрелом возрасте, были предприняты попытки провести коррекцию противовоспалительными препаратами непосредственно после индукции воспаления у матери на ранних сроках беременности. Среди препаратов, подавляющих продукцию провоспалительных цитокинов, выделяют тоцилизумаб, полученный на основе рекомбинантных гуманизированных моноклональных антител к рецептору интерлейкина (ИЛ) 6 (Berardicurti et al., 2020). В настоящее время этот препарат применяется в терапии тяжёлой формы коронавирусной инфекции Covid-19 с цитокиновым штормом, связанным с недостаточным синтезом интерферона и выбросом провоспалительных цитокинов. В опубликованной работе авторами показано, что блокада ИЛ-6-рецептора специфическими антителами (IgG1) через 40 минут после воздействия ЛПС, когда синтез ИЛ-6 ещё не достиг своего пика, предотвращала нарушения афферентной иннервации ГРГ нейронов у половозрелого потомства. Наблюдалась также коррекция нарушений структуры и функции гонад. Отмечено, что концентрация тоцилизумаба, использованная в эксперименте, была снижена в 4 раза по сравнению с рекомендованной терапевтической дозой, вызывающей высокую эмбриональную смертность. Подобной противовоспалительной активностью обладал и поликлональный иммуноглобулин (IgG), который в настоящее время активно применяют в качестве иммуномодулятора в акушерской практике при привычном невынашивании беременности [Han, Lee, 2018]. При этом, корригирующее действие поликлонального IgG было более выражено, чем действие моноклональных антител к рецептору ИЛ-6, что предполагает участие и других провоспалительных цитокинов. В литературе предложено несколько взаимоисключающих механизмов противовоспалительного действия IgG: связывание его Fc-фрагмента с Fc-рецепторами на клетках врождённого иммунитета, взаимодействие с системой комплемента и цитокиновым каскадом, а также участие в регуляции пролиферации и выживаемости клеток (Chaigne and Mouthon, 2017).
Таким образом, полученные данные доказывают роль системного воспаления, опосредованного одним из цитокинов, ИЛ-6, в развитии нарушений гипоталамо-гипофизарно-гонадной оси. Показано также противовоспалительное действие поликлонального иммуноглобулина (IgG) и рекомбинантных моноклональных антител к рецептору ИЛ-6, проявляющееся уже в раннем онтогенезе, что открывает возможности коррекции нарушений и сохранения репродуктивного здоровья у потомства матерей, перенесших воспалительные заболевания.
Новость подготовила
© Игнатюк В.М.
15.05.2023