 © Подгорный Олег Владимирович, кандидат биологических наук, лаборатория проблем регенерации. Область интересов: развитие ЦНС, стволовые клетки мозга, разработка практических подходов к применению лазерной микродиссекции в клеточной и молекулярной биологии, применение современных методов флуоресцентной визуализации для изучения механизмов действия бактериальных токсинов на клетки эукариот.
© Подгорный Олег Владимирович, кандидат биологических наук, лаборатория проблем регенерации. Область интересов: развитие ЦНС, стволовые клетки мозга, разработка практических подходов к применению лазерной микродиссекции в клеточной и молекулярной биологии, применение современных методов флуоресцентной визуализации для изучения механизмов действия бактериальных токсинов на клетки эукариот.
Возможность проследить судьбу делящихся клеток и их потомков с помощью встраивания модифицированных нуклеотидов в новосинтезированную ДНК в S фазе клеточного цикла позволяет восстановить хронологию рождения клеток и их участие в формировании тканей как в развивающемся, так и во взрослом организме. Панель доступных сегодня модифицированных нуклеотидов включает радиоактивно меченный 3Н-тимидин, визуализируемые с помощью антител галогенпроизводные тимидина (5-бромо-2’-деоксиуридин, 5-хлоро-2’-деоксиуридин, 5-йодо-2’-деоксиуридин) и 5-этинил-2’-деоксиуридин, который выявляется методами клик-химии. С помощью импульсного или накопительного маркирования одним модифицированным нуклеотидом с последующим анализом фенотипов клеток через различные промежутки времени определяли пролиферативную активность в тканях, прослеживали судьбу и изучали дифференцировку новорожденных клеток. Позже область применения метода была расширена, когда исследователи смогли анализировать сразу две метки, введенные в организм с некоторым интервалом времени. Это позволило отслеживать судьбу клеток, рожденных в разное время, и оценивать длительность клеточного цикла и S фазы. Маркирование же с тремя и более модифицированными нуклеотидами очевидно открывает новые возможности для изучения клеточного цикла, анализа кинетики деления клеток и определения хронологии их рождения.
Главной проблемой тройного маркирования до настоящего времени оставалось неспецифическое связывание антител против галогенпроизводных тимидина (5-хлоро-2’-деоксиуридина и 5-йодо-2’-деоксиуридина) с теми основаниями 5-этинил-2’-деоксиуридина, которые не прореагировали с флуоресцентным азидом во время проведения клик-реакции. Ни пролонгированная клик-реакция, ни увеличение концентрации флуоресцентного азида не позволяли полностью избавится от неспецифического окрашивания антителами оснований 5-этинил-2’-деоксиуридина. Преодолеть проблему международной группе под руководством профессора Григория Ениколопова удалось благодаря проведению второй клик-реакции с нефлуоресцентным азидом, азидометил фенил сульфидом, которая полностью блокировала неспецифическое связывание антител при последующем иммунофлуоресцентном окрашивании. Этот прием позволил использовать для маркирования новосинтезированной ДНК три модифицированных нуклеотида.
Чтобы проверить пригодность метода тройного маркирования для количественных измерений, мышам последовательно вводили три различных нуклеотида в эквимолярных дозах с двухчасовым интервалом. Поскольку известно, что прогениторные клетки зубчатой извилины гиппокампа представляют собой достаточно однородную по длительности S фазы популяцию, то последовательное введение трех маркеров показывает прохождение клеток через S фазу. В этом случае, зная примерно длительность S фазы и временные интервалы между введением маркеров, можно предсказать, как будут соотноситься размеры фракций клеток с различными комбинациями маркеров. И действительно, экспериментальные данные показали ожидаемое распределение размеров клеточных фракций, подтверждая эквивалентность маркирования разными нуклеотидами и, следовательно, пригодность метода для количественных измерений.
Далее в работе был предложен способ тройного маркирования, позволяющий отличить те прогениторные клетки зубчатой извилины гиппокампа, которые после митоза покинули клеточный цикл и перешли в состояние покоя, от тех, что продолжают делиться. Подсчет количества клеток в этих двух субпопуляциях дал возможность вычислить долю клеток, которые подвергаются новому раунду деления. Это позволило определить число делений, которое проходят прогениторные клетки зубчатой извилины прежде, чем они прекратят размножаться и начнут дифференцироваться. До появления тройного маркирования определять такие параметры, которые характеризуют кинетику деления клеток, было просто невозможно без использования нескольких групп экспериментальных животных. Новый метод позволяет это сделать, имея всего одну экспериментальную группу.
Наконец, метод тройного маркирования был использован для демонстрации хронологии рождения клеток в семенных канальцах и тонком кишечнике, тканях с быстрым самообновлением. Для этого три метки последовательно вводились с интервалом в 24 часа. На срезах семенников можно было обнаружить делящиеся клетки со всеми возможными комбинациями трех меток. Как правило, комбинации в соседних канальцах различались, что свидетельствует о нескоординированном распространении волн сперматогенеза по отдельным канальцам. В кишечнике тройное маркирование позволило в явном виде продемонстрировать работу конвейера по воспроизводству энтероцитов (Рис. 1), которые, как известно, рождаются в криптах, а затем мигрируют вдоль ворсинки на самый ее верх. Так клетки, включившие первую метку, т.е. рожденные раньше всего, располагались на самом верху ворсинки. Клетки, включившие вторую метку, обнаруживались в середине и у основания ворсинки. Те же клетки, которые включили последнюю метку, находились исключительно в криптах.
Таким образом, маркирование тремя различными нуклеотидами открывает новые возможности для анализа клеточных делений в нишах стволовых клеток различных органов и тканей. Помимо измерения кинетики деления клеток и «раскрашивания» фракций клеток, рожденных в разное время, три метки позволяют свободно комбинировать импульсное и накопительное маркирование, расширяя панель параметров, по которым можно оценивать пролиферативную активность в обновляемых тканях.
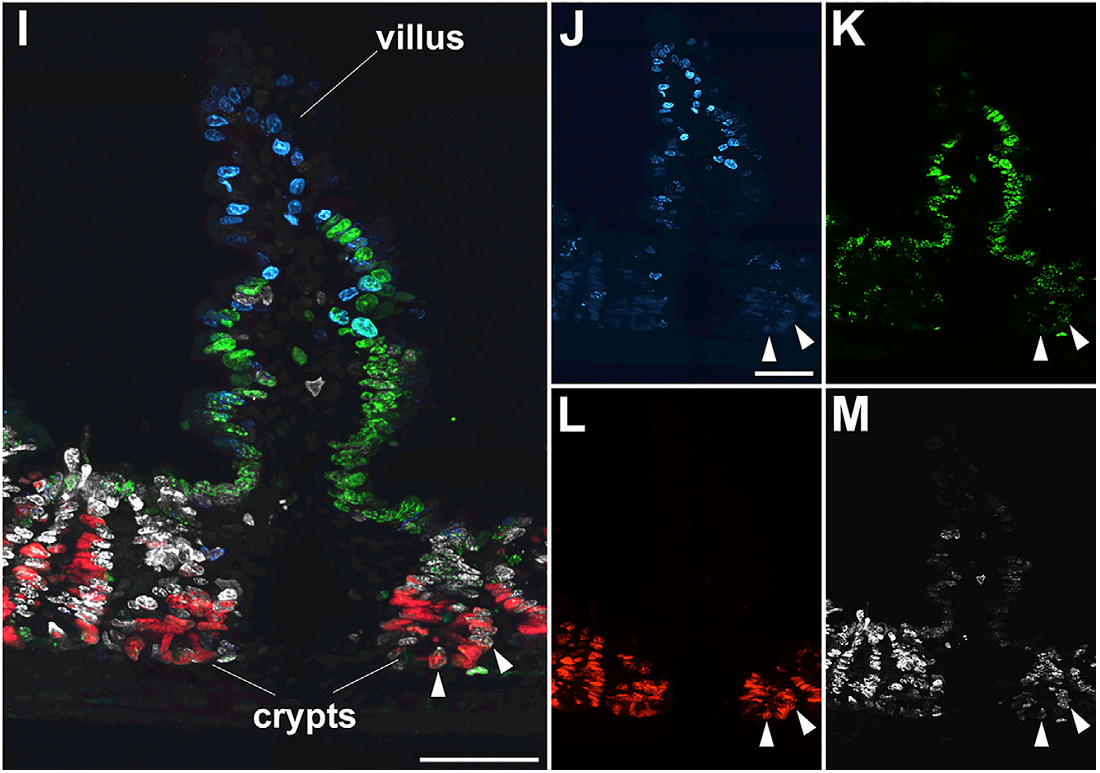
Рис.1. Маркирование тремя модифицированными нуклеотидами в тонком кишечнике иллюстрирует работу конвейера по воспроизводству энтероцитов. Сначала мышам вводили 5-йодо-2’-деоксиуридин (голубой), затем через 24 ч – 5-хлоро-2’-деоксиуридин (зеленый) и еще через 24 ч – 5-этинил-2’-деоксиуридин (красный). Ткани кишечника были взяты на анализ через 2 ч после введения последней метки. Препараты докрашены антителами против Ki67 (белый), маркера делящихся клеток. Рисунок взят из оригинальной статьи.
Научно-исследовательские организации на базе которых выполнялась работа:
- Кафедра анестезиологии и Центр генетики развития Университета Стони Брука (США)
- Московский физико-технический институт
- Института биологии развития им. Кольцова РАН
- Лаборатория Колд Спринг Харбор (США)
- Национальный исследовательский центр Курчатовский институт
Новость подготовил © 15.02.2018 Подгорный О.В.