 © Межерицкий Максим Игоревич, аспирант лаб. нейробиологии развития ИБР РАН.
© Межерицкий Максим Игоревич, аспирант лаб. нейробиологии развития ИБР РАН.Область научных интересов: нейроэтология, когнитивная психология, нейротрансмиттеры.
Продуцирование нейронов и размер неокортекса регулируются численностью и пролиферативной способностью нейрональных клеток-предшественников во время эмбрионального развития. Важную роль в эволюционном расширении неокортекса у млекопитающих отводят внешней субвентрикулярной зоне эмбрионального мозга, содержащей большое количество клеток радиальной глии (Рис. 1). Повышенная численность и пролиферативная способность клеток базальной радиальной глии приводит к увеличению внешней субвентрикулярной области. Известно влияние на пролиферацию нейрональных предшественником со стороны факторов роста, гормонов и т.д., однако мало известно о регуляции пролиферативной активности нейротрансмиттерами. Недавно вышедшая работа Xing L et al., 2020 существенно дополняет наше знание по данному вопросу.
Исследователи обратили внимание в первую очередь именно на серотонин (5-НТ) так как, несмотря на имеющиеся данные о роли серотонина в развитии мозга плода [Cheng et al., 2010; Bonnin et al., 2011; Toda et al., 2013; Mayer et al., 2019], не было ни объяснения его влияния на повышение пролиферативной активности базальных предшественников (БП), ни рассмотрения данного явления в контексте увеличения неокортекса в эволюционном развитии. Авторы исследовали влияние серотонина на пролиферацию БП неокортекса в развитии мыши, хорька и человека, демонстрируя ключевую роль HTR2A (рецептор серотонина второго типа А) в этом процессе с учетом эволюционного контекста.
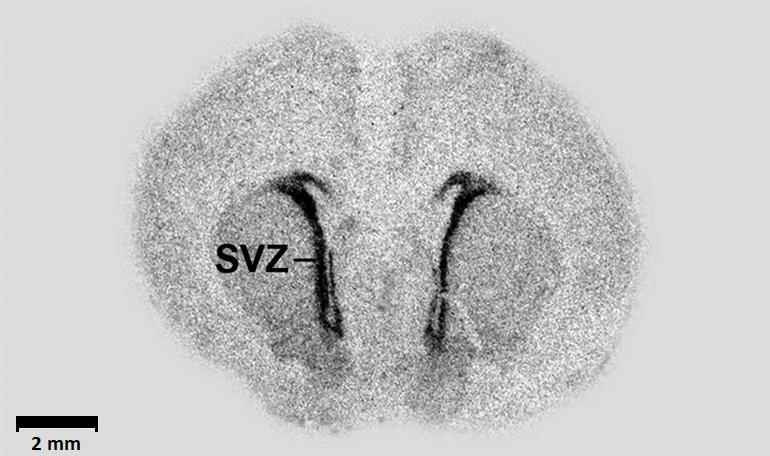
Рис. 1. Субвентрикулярная зона (SVZ) на срезе мозга эмбриона крысы. Изображение взято из статьи Popp et al., 2009.
Следует отметить, что под понятием БП «базальных предшественников» авторы подразумевают клетки базальной радиальной глии (basal (or outer) radial glia), о которых уже упоминалось, и промежуточных предшественников (basal intermediate progenitors), которые располагаются в разных слоях субвентрикулярной зоны эмбриональной коры. Как клетки базальной глии так и промежуточные предшественники могут воспроизводить сами себя и давать новые нейроны, при этом радиальная глия способна к образованию и новых клеток промежуточных предшественников.
Было показано, что 5-НТ усиливал пролиферацию БП человеческого неокортекса ex vivo и неокортекса эмбрионов хорька. Однако исследователи установили отсутствие влияния 5-НТ на пролиферацию БП в неокортексе мышиных эмбрионов (Рис 2).
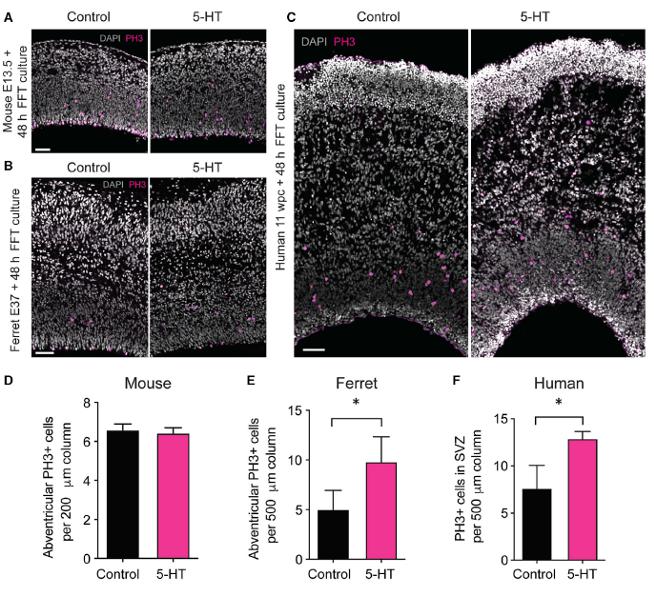
Рис. 2. Увеличение фосфогистон Н3-положительных клеток (фосфогистон Н3 - маркер митотической активности) в неокортексе человека (С, F) и хорька (B, E) после введения 5-НТ и отсутствии изменений в неокортексе мыши (рис. A, D). Рисунок из статьи Xing L et al., 2020.
Выяснилось, что эти различия могут объясняться отсутствием экспрессии HTR2A в БП мышей, характеризующихся также сглаженным неокортексом по сравнению с хорьками и человеком. Искусственное внедрение (эктопическая экспрессия) человеческого HTR2A в неокортекс эмбрионов мыши увеличило пролиферацию БП в ответ на серотонин. Авторы подчеркивают, что наличие HTR2A уже достаточно для удвоения пула базальных предшественников у мышей.
Нокаут HTR2A у эмбрионов хорьков уменьшил пролиферацию БП в неокортексе. Таким образом, нокаут гена HTR2A выявил необходимость наличия исправного работающего рецептора к серотонину для поддержания нормального уровня деления клеток БП в развитии складчатого неокортекса. В дополнение на культуре клеток неокортекса плода человека показано, что агонист HTR2A увеличивал количество деления БП, а антогонист блокировал данный эффект.
При всем при этом данные манипуляции с 5-НТ и HTR2A не влияли на онтогенетически более ранние нейрональные предшественники, такие как клетки апикальной радиальной глии. Основываясь на литературных данных, авторы статьи предполагают, что дело не в отсутствии HTR2A у этого вида клеток, а в том, что на данном этапе развития коры они уже использовали свой максимальный потенциал.
Таким образом, материнский серотонин (плацентарный и содержащийся в крови), действует как один из возможных факторов роста в развивающемся мозге. 5-НТ выступил в качестве важного внешнего пролиферативного сигнала для БП, который, возможно, способствовал эволюционной экспансии неокортекса. Вполне вероятно, что экспрессия HTR2A у базальных предшественников нейронов, обеспечившая их ответ на циркулирующий 5-НТ, могла сыграть одну из ключевых ролей в развитии коры у видов, демонстрирующих относительно большое содержание нейронов в неокортексе.
В данной статье авторы успешно показали необходимость серотонина и его рецептора для пролиферации базальных предшественников субвентрикулярной зоны коры развивающегося эмбриона. Вместе с тем, чтобы приблизится к подтверждению эволюционной гипотезы и уточнить роль HTR2A в формировании складчатой коры, необходимо провести более обширное сравнительное исследование развивающегося неокортекса у разных видов животных с внедренным или выключенным в эмбриональном периоде геном HTR2A с последующим анализом изменений укладки неокортекса и поведения.
Cheng A, Scott AL, Ladenheim B, Chen K, Ouyang X, Lathia JD, Mughal M, Cadet JL, Mattson MP, Shih JC. Monoamine oxidases regulate telencephalic neural progenitors in late embryonic and early postnatal development. J Neurosci. 2010 Aug 11;30(32):10752-62. doi: 10.1523/JNEUROSCI.2037-10.2010.
Bonnin A, Goeden N, Chen K, Wilson ML, King J, Shih JC, Blakely RD, Deneris ES, Levitt P. A transient placental source of serotonin for the fetal forebrain. Nature. 2011 Apr 21;472(7343):347-50. doi: 10.1038/nature09972.
Mayer S, Chen J, Velmeshev D, Mayer A, Eze UC, Bhaduri A, Cunha CE, Jung D, Arjun A, Li E, Alvarado B, Wang S, Lovegren N, Gonzales ML, Szpankowski L, Leyrat A, West JAA, Panagiotakos G, Alvarez-Buylla A, Paredes MF, Nowakowski TJ, Pollen AA, Kriegstein AR. Multimodal Single-Cell Analysis Reveals Physiological Maturation in the Developing Human Neocortex. Neuron. 2019 Apr 3;102(1):143-158.e7. doi: 10.1016/j.neuron.2019.01.027.
Toda T, Homma D, Tokuoka H, Hayakawa I, Sugimoto Y, Ichinose H, Kawasaki H. Birth regulates the initiation of sensory map formation through serotonin signaling. Dev Cell. 2013 Oct 14;27(1):32-46. doi: 10.1016/j.devcel.2013.09.002.
Новость подготовил © Межерицкий М.И.
14.11.2020