к.б.н. доцент кафедры эмбриологии
МГУ им. М.В. Ломоносова,
с.н.с. лаборатории проблем
регенерации (группа эмбриофизиологии) ИБР РАН.
Область научных интересов: раннее эмбриональное развитие.

ст.лаб. лаборатории проблем регенерации (группа эмбриофизиологии) ИБР РАН.
Область научных интересов: раннее эмбриональное развитие, оогенез.
Созревание ооцитов и раннее эмбриональное развитие — одни из критических периодов развития, находящихся под пристальным вниманием современной биологии. В связи с этим, особое место занимает исследование побочных эффектов лекарственных препаратов, широко используемых женщинами репродуктивного возраста. Одним из самых распространенных медикаментов является флуоксетин, селективный ингибитор обратного захвата серотонина (СИОЗС), который применяется для терапии широкого спектра психических расстройств, включая депрессию. Несмотря на имеющиеся данные о незначительном влиянии данного препарата на репродуктивную функцию, молекулярные механизмы его воздействия на процессы оогенеза и раннего эмбриогенеза остаются малоизученными. Актуальность данного вопроса подчеркивается тем, что его молекулярная мишень – переносчик серотонина SERT – экспрессируется и проявляет функциональную активность в ооцитах и преимплантационных эмбрионах млекопитающих.
В новом исследовании, опубликованном в журнале International Journal of Molecular Sciences, наша группа предприняла попытку восполнить пробелы, используя мышиную модель для изучения влияния хронического воздействия флуоксетина на оогенез, овуляцию и развитие эмбрионов. В работе мы использовали модель хронического поступления флуоксетина с питьевой водой, что позволяет имитировать длительное воздействие препарата на организм. Для оценки влияния флуоксетина на репродуктивную функцию мы использовали комплексный подход, включающий анализ количества и качества овулировавших ооцитов, оценку созревания ооцитов in vitro, анализ развития эмбрионов и оценку овариального резерва потомства.
С целью комплексной оценки влияния флуоксетина на ключевые стадии оогенеза и раннего эмбриогенеза в исследовании была использована комбинация морфологических и молекулярных методов. Для визуализации веретена деления и хроматина в MII-ооцитах мы использовали иммуногистохимический анализ и конфокальную микроскопию, что позволило получить детальную информацию о структуре мейотического веретена и выявить возможные нарушения цитоскелета, вызванные воздействием флуоксетина. Количественная ПЦР использовалась для оценки экспрессии генов, участвующих в регуляции созревания ооцитов и развития эмбрионов. Оценка качества ооцитов, проводилась по следующим морфологическим критериям: форма ооцита и первого полярного тельца, размер перивителлинового пространства и отсутствие фрагментации цитоплазмы.
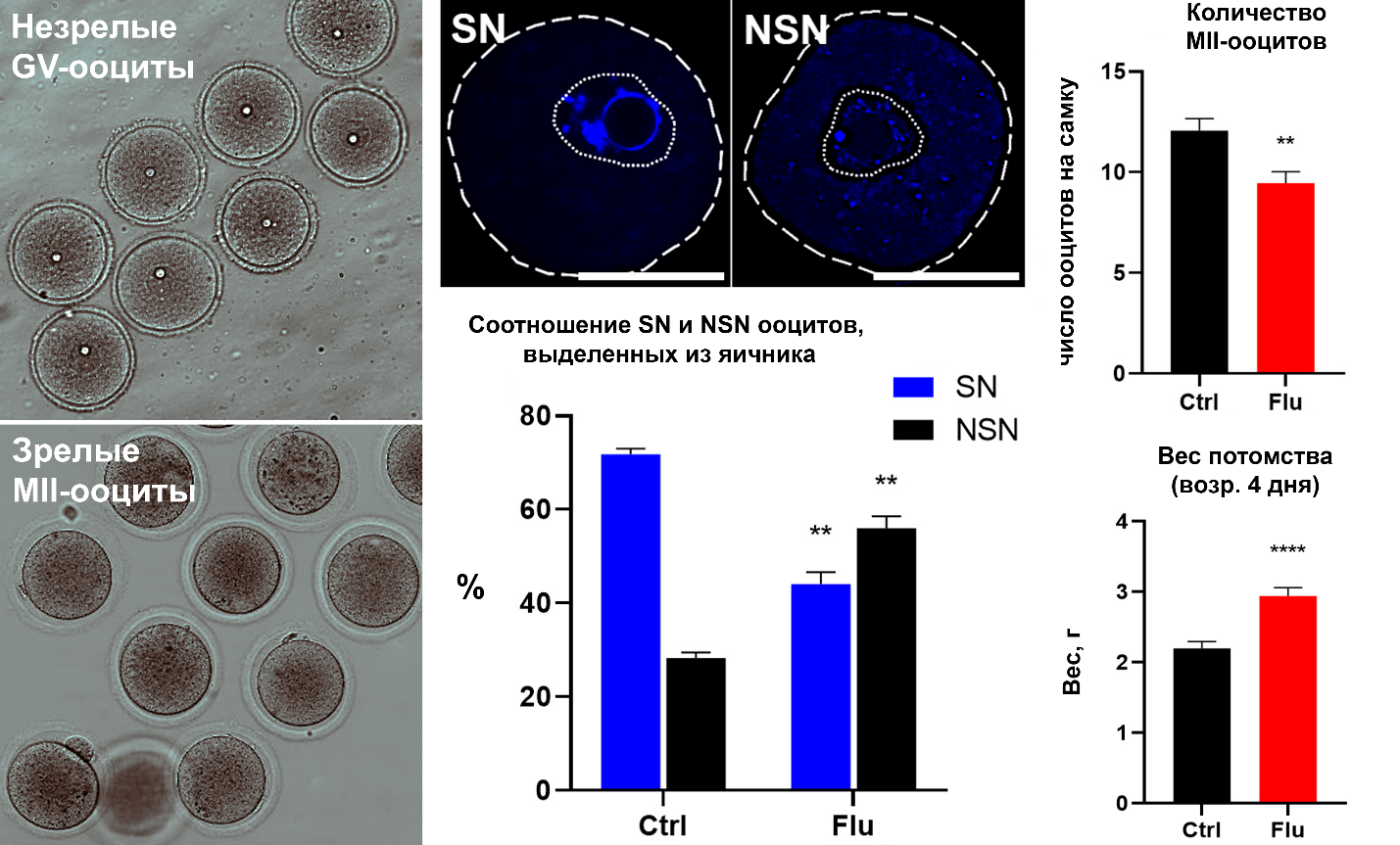
Рисунок 1. Влияние флуоксетина, потребляемого самками с питьевой водой на созревание ооцитов и репродуктивную функцию. Слева изображены морфологические особенности незрелых GV-ооцитов и зрелых овулировавших MII-ооцитов. В центре GV-ооцита видно крупное ядро (зародышевый пузырек) с плотным ядрышко-подобным тельцем. MII-ооциты имеют гомогенную цитоплазму и отделившееся редукционное тельце. По центру показана морфология SN (хроматин окружает ядрышко) и NSN (хроматин распределен диффузно в ядре) ооцитов, выделенных из яичника, а также влияние флуоксетина на их соотношение. Справа отображены данные о влиянии флуоксетина на число овулировавших ооцитов и вес потомства.
В работе было выявлено, что хроническое воздействие флуоксетина приводит к значительному снижению количества овулировавших зрелых ооцитов MII. В естественном цикле наблюдалось достоверное снижение количества овулировавших MII-ооцитов на 21,6% (с 12 до 9,4 ооцитов на животное). Еще более выраженное снижение (25,5%) было зарегистрировано при индукции суперовуляции - с 29,8 ооцитов в контроле до 22,2 в опытной группе. Примечательно, что несмотря на снижение количества овулировавших ооцитов, их морфологическое качество не изменялось — соотношение нормальных и деградирующих MII-ооцитов оставалось сопоставимым между группами. Мы также показали, что флуоксетин не оказывает существенного влияния на структуру веретена деления и количество фосфорилированной MAPK в MII-ооцитах. Однако анализ незрелых GV-ооцитов, выделенных из яичника, выявил значимые изменения: доля более зрелых ооцитов с SN-конфигурацией хроматина снизилась с 72% в контроле до 42% при воздействии флуоксетина. Это нарушение созревания подтвердилось в экспериментах in vitro, где в опытной группе отмечалось снижение доли достигших MII-стадии ооцитов и увеличение процента деградирующих клеток. Последствия этих нарушений прослеживались и на более поздних стадиях развития: количество бластоцист в матке снизилось на 17,8% (с 10,7 до 8,8). Интересно, что размер помета не отличался между группами, а экспрессия гена Zp3 в яичниках потомства, отражающая размер овариального резерва, также не различалась между группами. Наиболее неожиданным результатом стало значительное увеличение (на 31,8%) массы тела новорожденных мышат от самок, получавших флуоксетин.
Данные результаты свидетельствуют о том, что хроническое воздействие флуоксетина оказывает негативное влияние на репродуктивную функцию самок мышей, что проявляется в снижении количества овулировавших ооцитов и нарушении созревания ооцитов на стадии GV. Эти данные указывают на то, что флуоксетин может влиять на ранние этапы оогенеза, нарушая процессы, необходимые для приобретения ооцитом компетентности к созреванию и оплодотворению. Важно отметить, что флуоксетин не оказывает существенного влияния на качество созревших MII-ооцитов, структуру веретена деления и организацию хромосом, что позволяет предположить, что препарат действует на процессы, предшествующие завершению мейоза. Мы полагаем, тем не менее, что флуоксетин нарушает цитоплазматическое созревание ооцитов на стадии GV, что приводит к снижению их способности к созреванию и овуляции. Наблюдаемое увеличение веса потомства, возможно, является следствием метаболических изменений в организме матери под воздействием флуоксетина.
Результаты, полученные в нашем исследовании, открывают новые перспективы для дальнейших исследований в области репродуктивной биологии развития. В частности, еще предстоит выяснить молекулярные механизмы, лежащие в основе нарушений созревания ооцитов под воздействием флуоксетина. Перспективным направлением является изучение влияния флуоксетина на экспрессию генов, участвующих в регуляции созревания ооцитов, а также на метаболические процессы в ооцитах и эмбрионах. Мы полагаем, что в ооцитах наблюдаемые эффекты могут быть не связаны с нарушением канонической рецептор-опосредованной серотонинергической сигнализации. Возможно, они связаны с нарушением серотонилирования белков, которое может приводить к изменениям в эпигенетических паттернах и, как следствие, к нарушениям экспрессии генов, необходимых для нормального созревания ооцитов. Кроме того, серотонин является известным модулятором митохондриальной функции. Поэтому, флуоксетин-индуцированное снижение уровня серотонина может приводить к нарушению митохондриальной функции в ооцитах, что также может способствовать наблюдаемым дефектам в цитоплазматическом созревании.
Полученные результаты не только вносят вклад в понимание фундаментальных процессов биологии развития, но могут иметь и практическое значение для клинической медицины, в частности, при разработке стратегии минимизации репродуктивных рисков при терапии СИОЗС.
Новость подготовили
© Никишин Денис Александрович, к.б.н., доцент кафедры эмбриологии МГУ им. М.В. Ломоносова, с.н.с. лаборатории проблем регенерации (группа эмбриофизиологии) ИБР РАН.
Ткаченко Мария Дмитриевна, ст.лаб. лаборатории проблем регенерации (группа эмбриофизиологии) ИБР РАН.
14.07.2025