 © Дьяконова Варвара Евгеньевна, доктор биологических наук, профессор РАН. Ведущий научный сотрудник. Лаборатория нейробиологии развития. Область научных интересов: нейроэтология, нейробиология, нейротрансмиттеры, поведение.
© Дьяконова Варвара Евгеньевна, доктор биологических наук, профессор РАН. Ведущий научный сотрудник. Лаборатория нейробиологии развития. Область научных интересов: нейроэтология, нейробиология, нейротрансмиттеры, поведение.В последние годы появились работы, меняющие сложившийся взгляд на механизмы памяти. Согласно традиционному представлению, сохранение памятного следа происходит посредством изменения синаптических весов («Hebbian synapse») и последующей перестройки нейронной сети. Новые результаты, в том числе наши, свидетельствуют о том, что способность к сохранению памятного следа присуща и индивидуальной нервной клетке [1-10].
При всем разнообразии нейробиологических объектов, немногие позволяют напрямую изучать распределение ролей между отдельным нейроном и нейрональным ансамблем. Возможно, идеальной моделью для таких исследований является моллюск большой прудовик с крупными нейронами с известной функцией в поведении. Еще в конце девяностых годов прошлого века был разработан метод изоляции нейронов из нервной системы в остром опыте, позволяющий непрерывно регистрировать активность клетки до, во время и после изоляции. Такие изолированные клетки стали использовать и как подвижные биосенсоры, позволяющие увидеть функциональные изменения в межклеточной среде определенного ганглия или его области.
Этими преимуществами объекта мы воспользовались, чтобы выяснить, как недавний опыт меняет активность клеток и состав межклеточной среды, сохраняется ли память о нем после возвращения животного к привычным условиям жизни. Мы рассматривали наиболее простой вид клеточной памяти, который может встречаться не только у нервных, но и других видов клеток. Речь идет о сохранении следа их активности во время недавнего необычного поведенческого опыта.
Таким «необычным» опытом для водных улиток стала интенсивная локомоция на мелководье (Рис.1). Активность локомоторных серотониновых нейронов оказалась сходна в нервной системе улиток, находившихся все время в аквариуме (control, С), и у улиток, которые провели в аквариуме два часа после двухчасовой локомоции на мелководье (exercise than rest. ER). Однако при изоляции нейронов из нервной системы выяснилось, что эндогенная активность и уровень мембранного потенциала выше у нейронов из нервной системы ER животных. Дальнейший анализ показал, что в нервной системе эти различия компенсируются благодаря экстрасинаптической секреции дофамина, притормаживающей локомоторные нейроны у улиток с опытом наземной локомоции. Различия в активности C и ER изолированных нейронов исчезали, когда клетки помещались в химическое микроокружение своего ганглия. Исследование эффектов микроокружения педального ганглия при помощи подвижных клеток-биосенсоров у C и ER улиток подтвердило различие между ними. Антагонист дофаминовых рецепторов сульпирид повышал электрическую активность локомоторных нейронов в ЦНС ER, но не C улиток. Дофамин снижал частоту электрической активности локомоторных нейронов и у C, и у ER улиток. Таким образом, наши данные предполагают участие двух механизмов во взаимодействии прошлого и настоящего опыта на клеточном уровне: изменения биофизических свойств клеточной мембраны и изменения в межклеточной модулирующей среде (Рис.2).
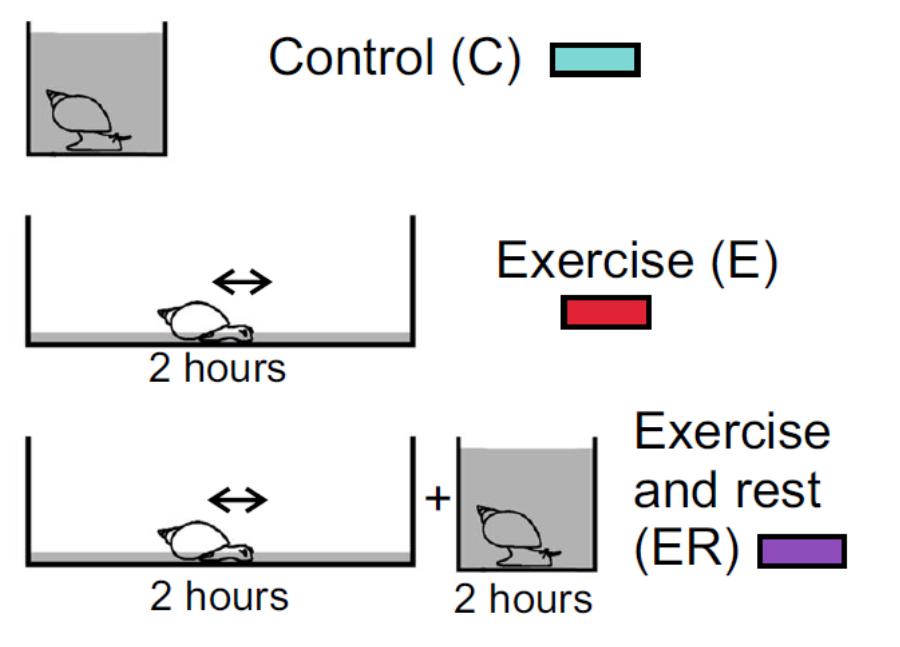
Рис 1. Схема поведенческого эксперимента.
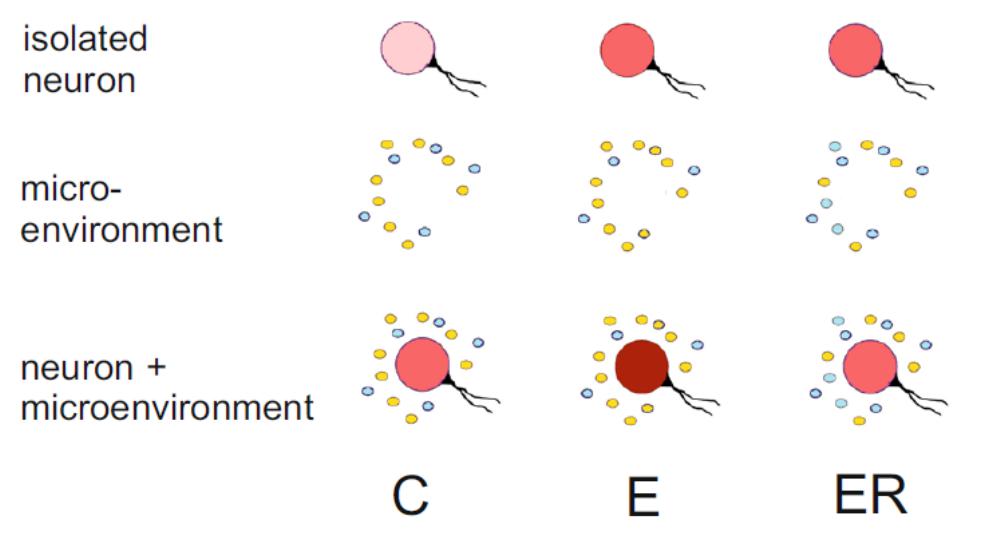
Рис 2. Схематическое изображение полученных результатов. Интесивность красного цвета соответствует регистрируемому уровню электрической активности клеток. Микроокружение символически представлено голубыми (тормозными) факторами и желтыми (возбуждающими). Интенсивная локомоция приводит к изменению эндогенной активности клеток и сооотношению возбуждающих/тормозных нейромодуляторов в среде.
Тот факт, что сходное поведение (выходной паттерн) может обеспечиваться разными конфигурациями нейронного ансамбля, подтвержден экспериментально и формально обоснован в работах группы Ив Мардер по изучению и математическому моделированию центральных генераторов паттерна беспозвоночных [11-12]. “Multiple solutions produce similar outputs” (цит. по Marder, Taylor 2011). В последнее время к подобным выводам приходят и при исследовании более сложного мозга млекопитающих и человека при решении когнитивных задач, например, С.В. Медведев (лекция на восьмой международной конференции по когнитивной науке 18–21 октября 2018 г., Светлогорск, Россия). Полученные нами результаты впервые свидетельствуют о том, что даже в тех случаях, когда мы регистрируем сходный уровень электрической активности нейронов в ЦНС, этот уровень может обеспечиваться разными комбинациями свойств нейронов и их микроокружения.
Очевиден вопрос о функциональном смысле этого явления, почему существует множество возможных комбинаций генерации одного выходного паттерна? Можно предположить, что разные варианты генерации одного выхода имеют разный потенциал перехода в другое состояние для обеспечения другого выходного паттерна. Мы предполагаем, что выбор конфигурации нейронного ансамбля для данного поведения зависит от прогнозируемого поведения (Рис. 3).
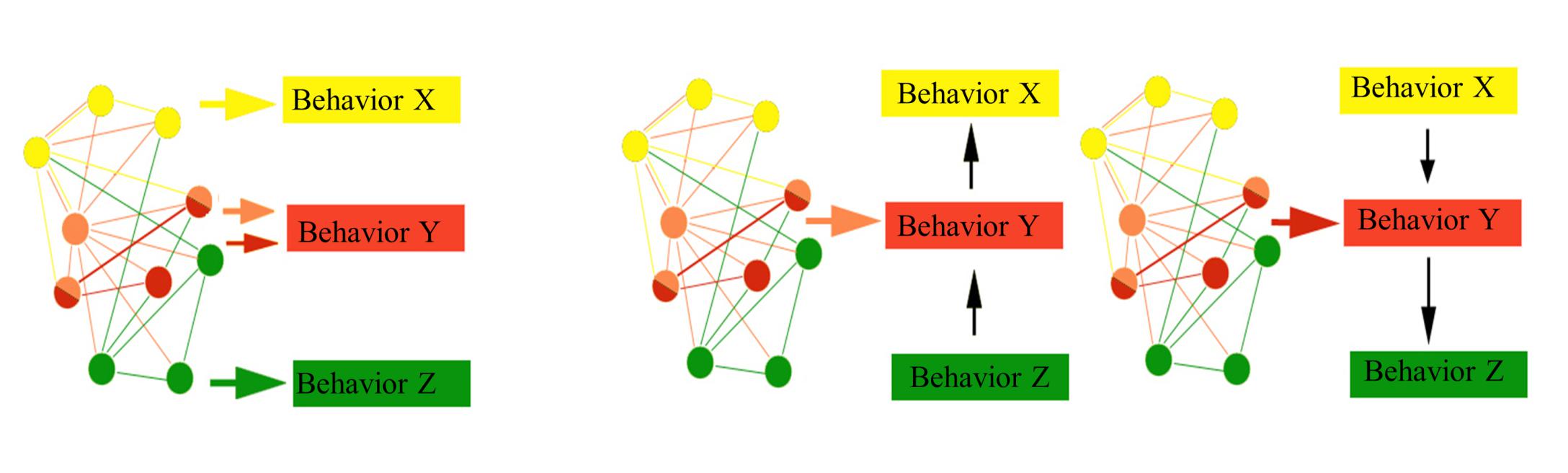
Рис 3. Зачем использовать разные конфигурации для генерации красного поведения? Схематическое изображение гипотезы. Выбор конфигурации будет зависеть от прошлого опыта и прогнозируемого поведения.
Полученные нами экспериментальные данные косвенно согласуются с этой гипотезой. Во-первых, новая комбинация нейронных свойств (для генерации той же формы поведения) проявлялась закономерно, как следствие определенного опыта животного. Во-вторых, животные с «сохраненной памятью об интенсивной локомоции в прошлом» характеризовались более быстрым локомоторным эраузалом, когда вновь помещались в условия наземной локомоции. Высказанное предположение о неслучайном выборе конфигурации нейронной сети (ансамбля) для генерации одного поведения или решения одной и той же задачи доступно для проверки и на других объектах исследования, от мышей до человека.
1. Nikitin, E.S., Vavoulis, D.V., Kemenes, I., Marra, V., Pirger, Z., Michel, M., Feng, J., O'Shea, M., Benjamin, P.R. and Kemenes, G. Persistent sodium current is a nonsynaptic substrate for long-term associative memory. Curr. Biol. 2008. 18, 1221-1226.
2. Johansson F, Jirenhed DA, Rasmussen A, Zucca R, Hesslow G. Memory trace and timing mechanism localized to cerebellar Purkinje cells. Proc Natl Acad Sci U S A. 2014. Oct 14;111(41):14930-4. doi: 10.1073/pnas.1415371111.
3. Chen S, Cai D, Pearce K, Sun PY, Roberts AC, Glanzman DL. Reinstatement of long-term memory following erasure of its behavioral and synaptic expression in Aplysia. Elife. 2014 Nov 17;3:e03896. doi: 10.7554/eLife.03896.
4. Ryan TJ, Roy DS, Pignatelli M, Arons A, Tonegawa S. Engram cells retain memory under retrograde amnesia. Science. 2015 May 29;348(6238):1007-13. doi: 10.1126/science.aaa5542. Epub 2015 May 28.
5. Dyakonova VE, Hernádi L, Ito E, Dyakonova TL, Chistopolsky IA, Zakharov IS, Sakharov DA. The activity of isolated neurons and the modulatory state of an isolated nervous system represent a recent behavioural state. J Exp Biol. 2015 Apr;218(Pt 8):1151-8. doi: 10.1242/jeb.111930. Epub 2015 Feb 24. PMID: 25714568
6. Johansson F, Hesslow G, Medina JF. Mechanisms for motor timing in the cerebellar cortex. Curr Opin Behav Sci. 2016 Apr;8:53-59.
7. Sandler U, Tsitolovsky L. Neural Cell Behavior and Fuzzy Logic. Springer, 2008. — 478 с
8. Johansson F, Hesslow G. Theoretical considerations for understanding a Purkinje cell timing mechanism. Commun Integr Biol. 2014 Dec 31;7(6):e994376. doi: 10.4161/19420889.2014.994376.
9. Gallistel CR, Matzel LD. The neuroscience of learning: beyond the Hebbian synapse. Annu Rev Psychol. 2013;64:169-200.
10. Gallistel CR, Balsam PD. Time to rethink the neural mechanisms of learning and memory. Neurobiol Learn Mem. 2014 Feb;108:136-44.
11. Marder E., Taylor, A.L. Multiple models to capture the variability in biological neurons and networks // Nat. Neurosci. 2011. Vol. 14. P. 133-138.
12. Prinz A.A., Bucher D., Marder E. Similar network activity from disparate circuit Parameters // Nat. Neurosci. 2004. Vol. 7. P. 1345–1352 .
Новость подготовила © 2020 Дьяконова В.Е.
14.01.2020