 © Сухинич Кирилл Константинович
- младший научный сотрудник лаборатории проблем регенерации группы экспериментальной нейробиологии
© Сухинич Кирилл Константинович
- младший научный сотрудник лаборатории проблем регенерации группы экспериментальной нейробиологии
История изучения регенерации в центральной нервной системе насчитывает уже более ста лет. Метод нейротрансплантации фетальной ткани по праву можно назвать классическим подходом. За это время были достигнуты значительные успехи, как в области фундаментальной науки, так и клинической трансплантации. В 2016 году выходит статья в Nature, привлекшая особое внимание общественности: "Transplanted embryonic neurons integrate into adult neocortical circuits" (Falkner et al. Nature. 2016. Vol. 539(7628). P. 248-253). Авторы статьи поставили перед собой цель максимально подробно изучить возможность интеграции трансплантированных клеток эмбрионального неокортекса в нейронные сети мозга реципиента после повреждения зрительной коры. Стоит отметить, что работы, в которых показаны способности клеток трансплантатов фетальной ткани интегрироваться в нейронные сети зрительной коры проводились и ранее, в частности сотрудниками Института Биологии Развития, и авторы рассматриваемой статьи ссылаются на одну из этих работ “Afferents to visually responsive grafts of embryonic occipital neocortex tissue implanted into V1 (Oc1) cortical area of adult rats” (Gaillard F., Girman S.V., Gaillard A. Restor Neurol Neurosci. 1998. Vol. 12(1). P.13-25.).
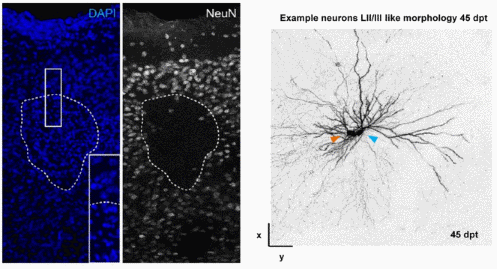
Особенностью работы Фалкнер и коллег является применение наиболее технически продвинутых и сложных методических подходов, которые, в частности, позволяют визуализировать процессы интеграции единичных клеток в реальном времени. Для получения локального повреждения нейронов II/III слоя первичной зрительной коры в мозг взрослого животного инъецировали специальные частицы, их последующая фотоактивация лазером приводила к гибели нейронов. Через неделю после повреждения в эту область трансплантировали суспензию клеток, маркированных флуоресцентными белками. Клетки для трансплантации получали путем механической диссоциации фрагментов неокортекса эмбрионов мышей 18,5 суток развития. Клетки, полученные из эмбрионов мышей трансгенных линий, а также эмбрионов после электропорации in utero, не подвергались предварительному культивированию перед трансплантацией. Для визуализации нейронных сетей также использовались методы трансдукции in vitro. Имплантация покровного стекла вместо фрагмента черепа дала возможность вести наблюдение за индивидуальными клетками in vivo с помощью двухфотонного микроскопа. Совмещение такого подхода с методами кальциевого имиджинга позволило оценить функциональный ответ трансплантированных клеток.
В результате было показано, что через 4 недели после трансплантации пересаженные клетки приобретали морфологию зрелых нейронов II/III слоя зрительной коры. Процесс морфологического созревания трансплантированных клеток был схож с нормальным развитием нейронов. Морфологически дифференцированные клетки присутствовали на протяжении всего эксперимента (11 месяцев). Для проверки возможности слияния трансплантированных клеток и клеток реципиента проводилась трансплантация клеток с зеленым флуоресцентным белком в мозг мышей c красным флуоресцентным белком. Отсутствие клеток с двойной меткой свидетельствовало о том, что слияния клеток не было. Паттерн распределения отростков, идущих от трансплантированных клеток был характерен для нейронов первичной зрительной коры, т.е. схож с распределением отростков клеток ткани мозга реципиента окружающей трансплантат. В свою очередь, клетки мозга реципиента также специфически иннервировали трансплантаты. Предъявление зрительного стимула приводило к специфическому функциональному ответу трансплантированных клеток. Через 9 недель после трансплантации клетки заканчивали свое функциональное развитие и ничем не отличались от окружающих клеток первичной зрительной коры мозга реципиента.
Таким образом, авторам удалось показать, что трансплантированные клетки эмбрионального неокортекса интегрируются в уже существующие нейронные сети мозга реципиента после повреждения. Они приобретают характерную морфологию, устанавливают реципрокные связи со специфическими мишенями, и их функциональная активность ничем не отличается от клеток соответствующей зоны мозга реципиента.
Существует значительное количество работ в той или иной степени подтверждающих возможность интеграции трансплантированных клеток. Однако появление комплексной и выполненной на высочайшем методическом уровне работы расширяет наши знания в этой области и заставляет снова обратить внимание на возможность замены погибших клеток клетками трансплантата. Совершенствование подходов и изучение вопросов интеграции трансплантированных клеток позволит также выйти и на новый уровень клинической трансплантации.
|
Новость подготовил © 13.12.2016 Сухинич К.К.