 © Паюшина Ольга Викторовнастарший научный сотрудник лаборатории клеточных и молекулярных основ гистогенеза, доктор биологических наук.
© Паюшина Ольга Викторовнастарший научный сотрудник лаборатории клеточных и молекулярных основ гистогенеза, доктор биологических наук.
Как образуются стволовые кроветворные клетки (СКК) в эмбриогенезе млекопитающих? Известно, что их источником является специализированный гемогенный эндотелий, локализованный прежде всего в аорте. Вступая на путь гемопоэза, его клетки претерпевают эндотелиально-кроветворный переход и образуют интрааортальные кластеры, где формируются предшественники стволовых клеток – так называемые пре-СКК I типа, которые затем через стадию пре-СКК II типа созревают в СКК (последних, впрочем, в аорте крайне мало). Однако многие детали этого процесса остаются неясными. Его исследование методами функционального анализа, позволяющего оценивать способность кроветворных клеток к самоподдержанию и дифференцировке, затруднено малочисленностью изучаемых клеток и гетерогенностью популяции. Авторы статьи, вышедшей в 2018 г. в журнале «Nature Communications», применили для анализа гемопоэза в аорте новый и весьма перспективный подход, включающий секвенирование РНК индивидуальной клетки, что позволило им определить клеточный состав интрааортальных кластеров и приблизиться к пониманию молекулярных механизмов, контролирующих различные стадии их формирования.
В работе были использованы клетки, выделенные из аорто-гонадо-мезонефральной области (АГМ) эмбрионов мыши. Как известно, у данного вида животных СКК в этой области впервые появляются на 10,5 сутки эмбриогенеза. Для прояснения молекулярных событий, ведущих к их образованию, авторы сравнили экспрессию генов различными популяциями клеток аорты у 10- и 11-суточных эмбрионов. Проведение транскриптомного анализа требовало выделения клеток интрааортальных кластеров в виде чистой популяции, без примеси клеток окружающей мезенхимы или циркулирующей крови. Эта задача, практически невыполнимая при обычном сортинге по поверхностным маркерам, была решена путем очистки изучаемой популяции in silico, с помощью специального алгоритма компьютерной обработки данных. Примененный к результатам секвенирования РНК индивидуальных клеток, выделенных из АГМ, этот алгоритм позволил разбить их на несколько групп по экспрессии генов и выбрать для дальнейшего анализа только те клетки, которые по транскрипционному профилю соответствовали клеткам интрааортальных кластеров.
Чтобы понять, какие молекулярные изменения происходят в процессе формирования этих кластеров, авторы проанализировали транскрипционный профиль клеток АГМ, относящихся к обычному и гемогенному эндотелию, клеткам в процессе эндотелиально-кроветворного перехода, пре-СКК I и II типов. Соответствующие популяции были идентифицированы по экспрессии известных маркеров. Сравнение их транскриптомов показало, что в ходе спецификации эндотелия, эндотелиально-кроветворного перехода и формирования интрааортальных кластеров происходят изменения экспрессии генов, связанные с подавлением эндотелиальной и активацией кроветворной программы. Наиболее масштабное ремоделирование транскриптома отмечается на стадии эндотелиально-кроветворного перехода, тогда как не гемогенный и гемогенный эндотелий различаются между собой экспрессией лишь немногих генов, так же как пре-СКК I и II типов. Какую роль эти по-разному экспрессируемые гены играют в процессе созревания клеток, и можно ли использовать их продукты в качестве новых маркеров для выделения специфических популяций – еще предстоит выяснить.
Использованные подходы позволили также прояснить клеточный состав интрааортальных кластеров, данные о котором ранее были противоречивы. В них были обнаружены клетки в состоянии эндотелиально-кроветворного перехода, пре-СКК обоих типов и коммитированные кроветворные клетки, способные к эритроидной и миелоидной дифференцировке. При этом если у 10-суточных эмбрионов в кластерах была велика доля клеток в состоянии эндотелиально-кроветворного перехода, то на 11-е сутки в них преобладали пре-СКК. С помощью флуоресцентной гибридизации in situ, позволяющей выявлять единичные молекулы РНК (smRNA-FISH), на срезах эмбрионов удалось визуализировать различные популяции клеток интрааортальных кластеров. Клетки кластеров при этом отличали от окружающих мезенхимных и прочих клеток по экспрессии специфичного для них гена Gpr56, в качестве кроветворного маркера использовали транскрипт гена миелопероксидазы (Mpo), а в качестве эндотелиального - транскрипт гена фактора фон Виллебранда (Vwf). Среди Gpr56+ клеток обнаруживались как коммитированные кроветворные предшественники с высоким уровнем экспрессии Mpo, так и пре-СКК, которые могли быть выявлены по отсутствию или малочисленности транскриптов этого гена. Что же касается Vwf, то он экспрессировался не только в эндотелии аорты, но и в некоторых клетках кластеров, очевидно, находящихся на ранних стадиях эндотелиально-кроветворного перехода. Клетки, сохраняющие экспрессию этого маркера, преимущественно располагались вблизи эндотелия, что может отражать их происхождение (см. рисунок).
Однако главный вопрос состоит в том, какими регуляторными программами контролируется происходящий в аорте процесс формирования СКК из эндотелия. Проанализировав экспрессию различных транскрипционных факторов, авторы выделили среди них три группы с максимумом экспрессии на ранней, промежуточной и поздней стадиях созревания клеток. Факторы первой группы, отвечающие за развитие сосудов, на высоком уровне экспрессировались в эндотелии, в том числе гемогенном; повышенная экспрессия факторов второй группы, контролирующих инициацию кроветворной программы (в частности, самоподдержание и дифференцировку стволовых клеток), отмечалась в клетках на стадии эндотелиально-кроветворного перехода и пре-СКК, а третьей группы, участвующей в регуляции дефинитивного гемопоэза – в пре-СКК (кроме того, высокий уровень экспрессии факторов этой группы был характерен для стволовых и родночальных кроветворных клеток желточного мешка). Таким образом, был сделан первый шаг к выяснению молекулярных механизмов, обеспечивающих смену эндотелиальной программы в клетках интрааортальных кластеров на кроветворную.
Характеризуя работу в целом, следует отметить, что применение метода секвенирования РНК индивидуальной клетки в сочетании с современными алгоритмами компьютерного анализа позволило авторам получить ценные данные для углубленного изучения путей инициации кроветворной программы в эмбриональной аорте. Дальнейшие исследования в этой области могут не только дать важные для фундаментальной науки результаты, но и способствовать разработке стратегии получения СКК in vitro для использования в медицинских целях.
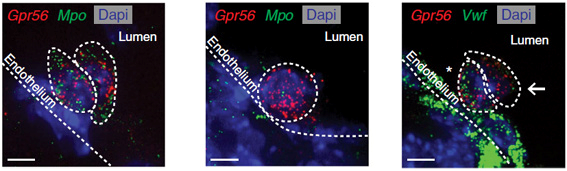
Рисунок. Криосрезы 11-суточных эмбрионов мыши, гибридизованные in situ с зондами для выявления транскриптов Gpr56 (красные точки), и Mpo либо Vwf (зеленые точки). Ядра клеток окрашены DAPI (синие). Положение интрааортальных кроветворных кластеров и эндотелия аорты отмечено пунктирной линией. Звездочкой показаны клетки интрааортальных кластеров с высоким уровнем экспрессии Vwf, стрелкой – клетки, не экспрессирующие его либо экспрессирующие на низком уровне.
Новость подготовила © Паюшина О.В.
13.07.2018