© Тамбовцева Валентина Георгиевна, младший научный сотрудник лаборатории эволюции генома и механизмов видоообразования ИБР РАН
© Тамбовцева Валентина Георгиевна, младший научный сотрудник лаборатории эволюции генома и механизмов видоообразования ИБР РАН
Статья Wang и соавторов в журнале Science посвящена хромосомной инженерии млекопитающих - не только безусловно выдающемуся факту получения новых запрограммированных устойчивых кариотипов мышей, но и анализу широкого спектра возможных последствий, онтогенетических и эволюционных.
В ряде таксонов виды имеют сильно различающееся количество хромосом при относительно одинаковых размерах генома (например, у насекомых, грызунов). Это, несомненно, является следствием таких мутаций геномного масштаба, как дупликации, а также слияния теломерных участков негомологичных хромосом, центрические слияния (робертсоновские транслокации, Rb). Такой момент зафиксирован и в истории формирования человеческого генома: у человека (2n = 46) метацентрическая хромосома 2 была образована в результате Rb-слияния двух акроцентрических хромосом, которые остались отдельными у человекообразных обезьян (2n = 48). В связи с этим возникает вопрос: насколько видовые геномы устойчивы к изменениям числа хромосом без существенных изменений их содержимого?
Этот вопрос ранее был успешно исследован на дрожжах Saccharomyces cerevisiae. Luo и соавторы добились слияния хромосом дрожжей с использованием CRISPR–Cas9, создав почти изогенную серию штаммов с прогрессивно меньшим количеством хромосом в диапазоне от шестнадцати до двух. Штамм, несущий только две хромосомы примерно по шесть мегабаз каждая, демонстрировал умеренные транскриптомные изменения и рос без серьезных дефектов. При скрещивании штамма с шестнадцатью хромосомами со штаммами с меньшим количеством хромосом наметились две тенденции. Когда число хромосом стало ниже шестнадцати, жизнеспособность спор заметно снизилась, достигнув менее 10% для генотипа двенадцати хромосом. По мере дальнейшего уменьшения числа хромосом споруляция дрожжей фактически останавливалась: скрещивание штамма с шестнадцатью хромосомами и штамма с восемью хромосомами показало значительно сниженную вероятность образования полной тетрады и менее 1% споруляции, причём получить жизнеспособные споры не удалось. Однако гомотипические скрещивания между парами штаммов с восемью, четырьмя или двумя хромосомами приводили к отличной споруляции и получению жизнеспособных спор. Эти результаты указывают на то, что восьми событий слияния хромосом достаточно для репродуктивной изоляции штаммов у дрожжей. В целом, как отмечают авторы, почкующиеся дрожжи неожиданно хорошо переносят уменьшение числа хромосом, являясь ярким примером устойчивости генома к подобным изменениям.
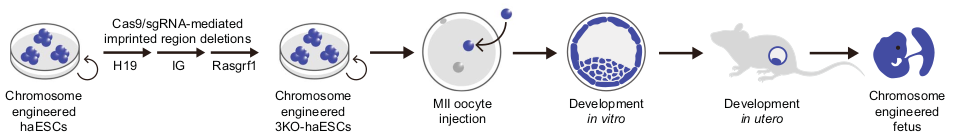
Лабораторная мышь сохранила кариотип с 40 хромосомами после более чем сотни лет искусственного разведения с участием нескольких видов мышей. Однако на более значительных временных отрезках изменения кариотипа, вызванные хромосомными перестройками, являются обычным явлением: считается, что у грызунов происходит от 3,2 до 3,5 хромосомных перестроек за миллион лет (у приматов, для сравнения, 1,6 хромосомных перестроек за миллион лет). Подходы генной инженерии, разработанные на дрожжах, позволили получить гаплоидные эмбриональные стволовые клетки (haESCs) млекопитающих - сначала из неоплодотворенных эмбрионов мыши, а затем от аналогов крысы, обезьяны и человека.
В анализируемой статье Wang и соавторы отмечают, что геномный импринтинг в haESCs часто нарушается, ограничивая их плюрипотентность и потенциал для генной инженерии. Для устранения этой трудности используется ранее разработанный той же научной группой подход: удаление трёх импринтированных областей для установления стабильного сперматозоидоподобного паттерна импринтинга в haESCs. Полученные плюрипотентные клетки и использовались для проверки возможности хромосомной инженерии у млекопитающих.
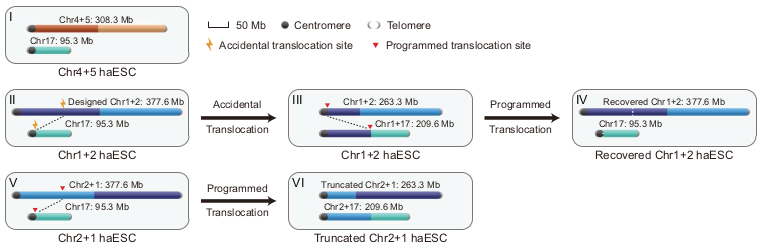
Чтобы добиться лигирования двух негомологичных хромосом мыши с образованием одной, авторы разработали стратегию применения CRISPR–Cas9, сочетающую Rb-слияние и реципрокную транслокацию. Проводилось лигирование двух хромосом мыши среднего размера – 4 и 5 – “голова к хвосту” (Chr4+5) и двух самых больших хромосом мыши - 1 и 2 - в двух противоположных ориентациях (Chr1+2 и Chr2+1). Результаты подтверждались с помощью дифференциальной G-окраски хромосом, сэнгеровского секвенирования выбранных участков соединяемых хромосом, а также FISH (флуоресцентной in situ гибридизации) и методов высокопроизводительного секвенирования (Hi-C и PacBio). Слияния Chr4+5 и Chr2+1 были сразу успешно получены и подтверждены, тогда как для Chr1+2 картина оказалась сложнее. В этом случае спонтанно сформировались две новые хромосомы: первая представляла собой сегмент хромосомы 1, слитый с хромосомой 2, а вторая - оставшуюся часть хромосомы 1, слитую с плечом хромосомы 17. Программируемая перестройка с участием хромосомы 17 была использовала для получения “усеченной” Chr2+1, где лигированные ветви были усечены двумя независимыми транслокациями (“truncated Chr2+1”) (Рис. 1).
Анализ Hi-C выявил усиленные контакты между лигированными хромосомами в сконструированных haESCs, включая контакты между разделившейся Chr1 и хромосомой 17 в Chr1+2 haESCs. Хотя биологическая функция межхромосомных контактов в клетках животных остается слабо изученной, эти данные указывают на то, что такие контакты могут быть усилены путём лигирования хромосом. Все haESCs с лигированными хромосомами экспонировали транскриптомы, аналогичные транскриптомам аналогов дикого типа (WT). Анализ PacBio был применён для идентификации участков лигирования и структурных вариантов в каждой спроектированной линии haESC: оказалось, что Chr1+2 haESCs демонстрируют идентичность участков лигирования, но различные структурные варианты, что подразумевает случайность их появления.
Нормальный ход митоза наблюдался у haESCs WT, а также Chr4+5 и Chr1+2, тогда как часть клеток Chr2+1 полиплоидизировались (наблюдалась остановка на стадии анафазы и повторное слияние дочерних ядер). В haESCs Chr4+5 и Chr1+2 также отмечались локальные задержки расхождения хромосом, однако контрольные точки деления преодолевались успешно.
Авторами были получены жизнеспособные детёныши-носители соответствующих перестроек (Рис. 2). Из нескольких сотен эмбрионов (113 Chr4+5, 355 Chr1+2 и 365 Chr2+1), созданных путём инъекции ооцитов в haESCs и пересаженных в матки суррогатные матерям, было получены 14 и 37 доношенных детенышей Chr4+5 и Chr1+2 соответственно. Масса тела и вес плаценты были в норме. От Chr2+1 эмбрионов, однако, не был получен ни один доношенный мышонок: они показали значительно увеличенный процент полиплоидных клеток и погибали до 13 дня эмбрионального развития. Контрольные эмбрионы WT развивались успешно. Путем переноса 68 эмбрионов, созданных путем инъекции ооцитов в “усеченные” Chr2+1 haESCs, также были получены доношенные живые детёныши, двое.
Детёныши Chr4+5 и Chr1+2 достигли половой зрелости. Мыши Chr4+5 имели нормальные кривые роста, тогда как особи Chr1+2 демонстрировали чрезмерный рост после периода грудного вскармливания. В тесте на тревожность в открытом поле животные Chr4+5 входили в центральную зону с нормальной скоростью, а мыши Chr1+2, как правило, избегали её, что указывает на высокий уровень тревожности. Расстояние и скорость перемещения мышей Chr4+5 были нормальными, тогда как представители Chr1+2 двигались значительно меньше и медленнее. Получить гомозиготное потомство удалось для мышей с лигированными хромосомами 4+5, однако расщепление не соответствовало менделевскому (5,7% Chr4+5 +/+ мышат, 32,1% Chr4+5 –/– мышат и 62,2% Chr4+5 +/– мышат). Авторами были описаны различные типы сегрегации тривалентов Chr4+5-Chr4-Chr5, а также формирование мутантных кариотипов с избыточной хромосомой 5.
Анализ дифференциальной экспрессии генов у мышей со всеми вариантами перестроек выявил, что в клетках всех проанализированных тканей (мозга, легких, сердца, печени, селезенки, почек) понижен уровень экспрессии гена Capn11, который кодирует кальций-зависимую протеазу и расположен на хромосоме 17. Capn11 также подавлялся у мышей со сверхэкспрессией Shank3, известной модели изучения аутизма и шизофрении. Проведя нокаут по данному гену, авторы подтвердили, что пониженная экспрессия Capn11 связана с аномальным поведением мышей Chr1+2.
Таким образом, авторы разработали полноценную модель для получения линий животных с запрограммированными хромосомными перестройками, передающимися по зародышевой линии. Показано, что особи с масштабными хромосомными перестройками могут быть вполне жизнеспособными, хотя некоторые демонстрировали аномальное поведение и избыточный постнатальный рост, в то время как у других наблюдалось снижение плодовитости. Изменения в TADs и межхромосомных контактах у мышей с лигированными хромосами были аналогичны результатам, полученным у диких мышей с Rb-перестройками, что придаёт работе ценность в понимании эволюционных процессов, и – особенно – механизмов хромосомного видообразования. Лигирование двух самых больших ветвей хромосом мыши привело к повторному слиянию дочерних ядер, следовательно, к полиплоидизации клеток и, наконец, к эмбриональной летальности, но все эти эффекты были устранены, когда лигированные ветви были усечены двумя независимыми транслокациями. Это свидетельство говорит о том, что физическое пространство митотического ядра является потенциальным сдерживающим фактором в эволюции кариотипа млекопитающих. Также авторы отмечают, что в результате накопления хромосомных перестроек происходит становление репродуктивной изоляции. Мыши с Chr1+2, несущие две перестройки, не произвели потомства, но мыши с Chr4+5, несущие одну перестановку, произвели, хотя и с ограниченной плодовитостью. Это наглядно демонстрирует, как хромосомные перестройки снижают фертильность гетерозиготных гибридов и, потенциально, приводят к образованию новых видов.
Wang, L.B., Li, Z.K., Wang, L.Y., Xu, K., Ji, T.T., Mao, Y.H., Ma, S.N., Liu, T., Tu, C.F., Zhao, Q. and Fan, X.N., 2022. A sustainable mouse karyotype created by programmed chromosome fusion. Science, 377(6609), pp.967-975.
Coghlan, A., Eichler, E.E., Oliver, S.G., Paterson, A.H. and Stein, L., 2005. Chromosome evolution in eukaryotes: a multi-kingdom perspective. TRENDS in Genetics, 21(12), pp.673-682.
Li, Z.K., Wang, L.Y., Wang, L.B., Feng, G.H., Yuan, X.W., Liu, C., Xu, K., Li, Y.H., Wan, H.F., Zhang, Y. and Li, Y.F., 2018. Generation of bimaternal and bipaternal mice from hypomethylated haploid ESCs with imprinting region deletions. Cell Stem Cell, 23(5), pp.665-676.
Luo, J., Sun, X., Cormack, B.P. et al. Karyotype engineering by chromosome fusion leads to reproductive isolation in yeast. Nature 560, 392–396 (2018). https://doi.org/10.1038/s41586-018-0374-x
Новость подготовила
© Тамбовцева Валентина Георгиевна,
12.12.2022