 © Никишин Денис Александрович,
старший научный сотрудник лаборатории проблем регенерации ИБР РАН, кандидат биологических наук.
© Никишин Денис Александрович,
старший научный сотрудник лаборатории проблем регенерации ИБР РАН, кандидат биологических наук.
Ранние этапы имплантации млекопитающих, во время которых происходят важнейшие события, необходимые для продолжения беременности и формирования полноценной плаценты, являются одним из критических периодов развития, во время которого могут закладываться патологии плаценты, зачастую, приводящие к самопроизвольному прерыванию беременности. По разным оценкам, от 40 до 60% эмбрионов человека не преодолевает этот этап развития. При этом процесс имплантации у человека до сих пор очень слабо изучен, ввиду сильных отличий от большинства модельных организмов, а также этических и методических ограничений.
До сих пор основным источником знаний о первых этапах имплантации человека являются гистологические исследования и сопоставление с исследованиями, выполненными на обезьянах. Известно, что вскоре после прикрепления 6-7-дневной бластоцисты к стенке матки, внезародышевая часть эмбриона (цитотрофобласт, CTB) начинает пролиферировать и формирует синцитий (синцитиотрофобласт, STB), который вытесняет эпителий матки, внедряется в строму эндометрия. Через некоторое время синцитиотрофобласт окружает эмбрион и организует лакуны, заполненные кровью и необходимые для питания зародыша. В то же время, на первых этапах имплантации, трофобласт должен начать секретировать необходимое количество хорионического гонадотропина (ХГЧ), достаточное для замещения активности желтого тела и успешного продолжения беременности. Структуры зрелой ворсинчатой плаценты начинают формироваться только к 12 дню развития, когда пролиферирующие клетки цитотрофобласта (CTB) внедряются в синцитиотрофобласт и формируют первичные ворсины, которые в дальнейшем ветвятся, достигают кровеносных сосудов. В этих ворсинах заново формируется слой синцитиотрофобласта, а судьба STB «первого поколения» остается не вполне ясной. Кроме того, в условиях имплантации in vitro наблюдается появление популяции миграторных клеток (MTB), расползающихся по субстрату, функциональное значение которых на ранних этапах имплантации неизвестно.
Морфологическая картина без дополняющих ее функциональных исследований и данных о динамике изменений не способна дать полного понимания происходящих в норме процессов и механизмов возникающих патологий. На сегодняшний день некоторые механизмы дифференцировки клеток трофобласта человека раскрыты с применением нескольких простых клеточных моделей. Так, дифференцировку плюрипотентных эмбриональных стволовых клеток человека с помощью BMP4 можно направить в сторону трофобласто-подобных клеток. Кроме того, из бластоцист, ворсин плаценты первого триместра беременности, а также из культивируемых органоидов могут быть получены стволовые клетки трофобласта, способные к дифференцировке в его разные подтипы. Однако клеточные модели, являясь очень удобным инструментом в руках исследователя, остаются лишь грубым приближением к процессам, происходящим в норме.
Авторы статьи воспользовались появлением методов имплантации in vitro, позволяющих культивировать эмбрионы человека до 14 дня развития, и применили к последовательным стадиям имплантации подход секвенирования РНК единичных клеток, открывающий принципиально новые возможности анализа дифференцировки в клеточных популяциях (Рис. 1). Витрифицированные и размороженные донорские бластоцисты культивировали in vitro до сроков 8, 10 и 12 дней развития. Эмбрионы обрабатывали трипсином и разбивали на отдельные клетки, после чего сортировали на мелкие одноядерные клетки (CTB) и крупные многоядерные структуры (STB). Миграторные клетки (MTB), выселившиеся и располагающиеся на субстрате вокруг 12-дневных зародышей собирали до обработки трипсином. Стоит отметить, что данное исследование проведено на небольшой выборке, без применения автоматизированных систем, а с помощью вполне классических рутинных подходов к получению проб РНК. Всего из 11 эмбрионов было получено 139 проб РНК единичных клеток и 1,4 млрд. прочтений (около 10 млн. прочтений на одну клетку). После анализа экспрессии маркерных генов из исследования исключены всего 2 пробы, полученные из клеток эпибласта (высокая экспрессия POU5F1, SOX2 и NANOG). После исключения отклоняющихся и низкокачественных проб в анализе осталось 125 транскриптомов клеток, экспрессирующих маркеры трофобласта KRT7 и GATA3.
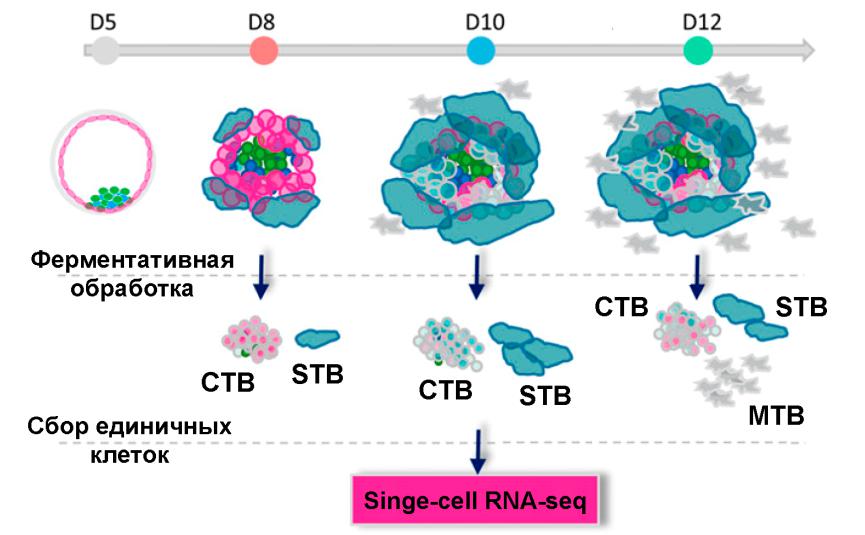
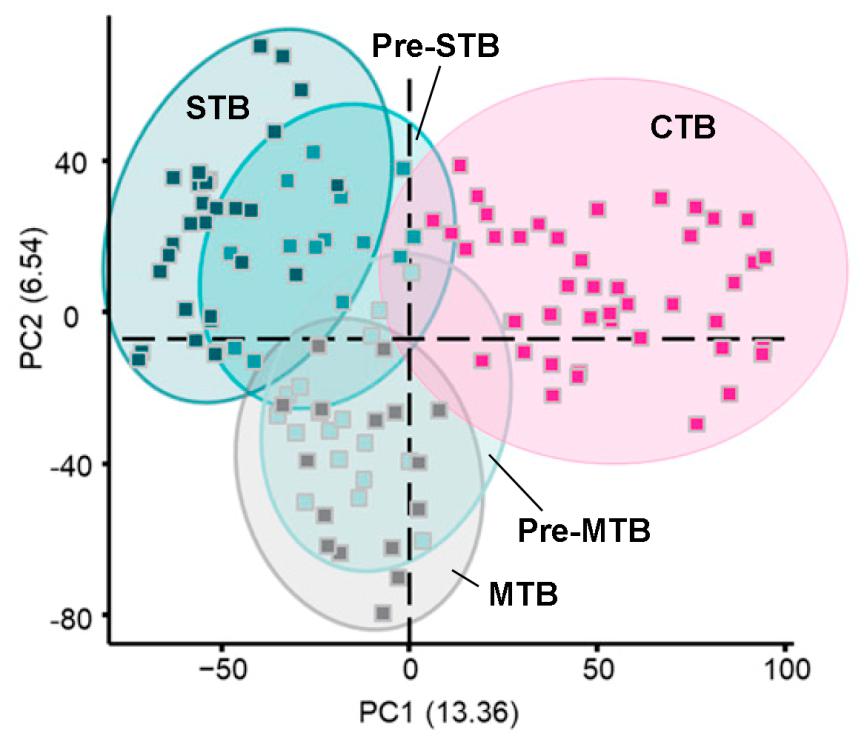
Анализ полученных транскриптомов подтвердил статистически значимые различия трех подтипов клеток трофобласта и выявил набор генов, являющихся маркерами каждой из этих трех популяций. Кроме того, он показал, что небольшая и морфологически гомогенная популяция клеток CTB уже несет в себе признаки дифференцировки и содержит еще митотически активные клетки-предшественники синцитиотрофобласта (pre-STB), уже подготавливающиеся к тому, чтобы слиться и сформировать синцитий, и предшественники миграторных клеток трофобласта (pre-MTB), дифференцирующиеся в соответствующем направлении (Рис. 2). Такое разделение клеточных подтипов появляется уже на 8 день развития, но в большей степени проявляется в дальнейшем развитии. На 10 день развития в ранней плаценте максимальной степени достигает развитие синцитиотрофобласта, что совпадает с достижением максимального значения секреции ХГЧ. К 12 дню развития происходит снижение темпов дифференцировки синцитиотрофобласта, но резко возрастает популяция миграторных клеток, а также начинает увеличиваться популяция недифференцированных митотически активных клеток цитотрофобласта, что свидетельствует о начале формирования зрелой плаценты. Эти результаты говорят о том, что, в отличие от трофэктодермы бластоцисты, ранняя плацента является гетерогенной популяцией клеток, которая за короткий промежуток существования, прежде чем будет вытеснена вновь сформировавшейся зрелой плацентой, проходит последовательные, четко хронометрированные стадии дифференцировки.
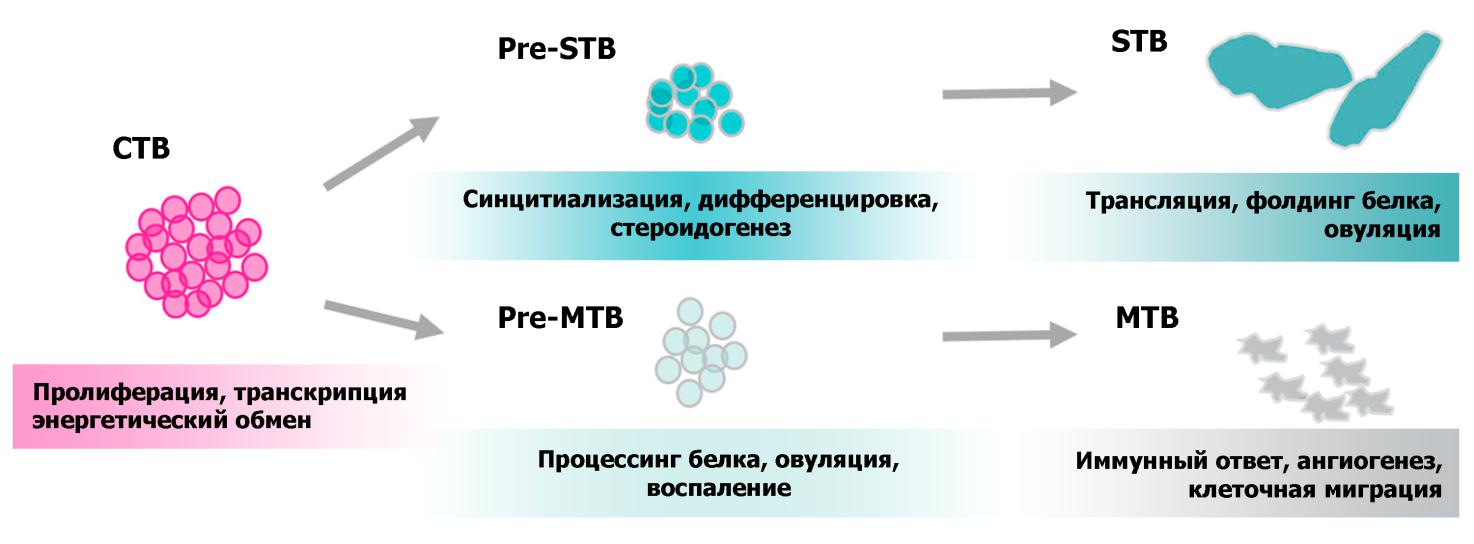
Авторами был проведен анализ генных онтологий (Рис. 3) в полученных транскриптомах, который выявил метаболические пути, ассоциированные с каждым из исследуемых клеточных типов. Для цитотрофобласта оказались характерны метки пролиферации, транскрипции и энергетического обмена, что соответствует роли цитотрофобласта как базового источника других клеточных типов и плаценты в целом. Маркерными для синцитиотрофобласта атрибутами оказались фолдинг белка, транспорт и процессинг гормонов, стероидогенез и миграция, что соответствует известной эндокринной функции синцитиотрофобласта, но также отражает его инвазивные свойства в ранней плаценте. Среди атрибутов, характерных для миграторных клеток, ожидаемо оказались отвечающие за миграцию и инвазию в межклеточный матрикс. Но кроме того, для транскриптомного профиля миграторных клеток трофобласта оказались характерны гены, ассоциированные с интерферонами I и II типа (к ним принадлежит большинство общеизвестных интерферонов, в т.ч. α-, β-, γ-IFN, за исключением λ-IFN), врожденным иммунитетом и процессингом антигенов. Более подробный анализ показал, что для миграторных клеток трофобласта характерна экспрессия рецепторов интерферона и частичная активация его внутриклеточных эффекторов, а также экспрессия компонентов главного коплекса гистосовместимости. Эти результаты могут говорить о том, что у человека интерфероновый ответ в миграторных клетках трофобласта, выселяющихся в эндометрий на первых этапах имплантации, может играть важную роль в определении успеха имплантации.
Стоит оговорить, что в данной работе эмбрионы находились в условиях культуры in vitro, в отсутствие компонентов эндометрия и даже полноценного межклеточного матрикса (в качестве однокомпонентного субстрата использовали фибронектин). Поэтому полученные результаты, разумеется, отражают процесс имплантации не в полной мере. Тем не менее, применение новых методов культивирования и современного подхода к анализу дифференцировки клеток, позволил выявить новые данные о функционировании ранней плаценты, структуры, определяющей успех имплантации. В работе описаны два новых подтипа клеток трофобласта, возникающие на первых этапах имплантации из прогениторных клеток цитотрофобласта: синцитиотрофобласт ранней плаценты, отвечающий за первые этапы имплантации и эндокринную поддержку овариальной секреции прогестерона, и миграторные клетки, колонизирующие эндометрий еще до формирования ворсин плаценты и экспрессирующие гены, ассоциированные с врожденным иммунитетом.
Новость подготовил © Никишин Д.А.
12.11.2019