Область научных интересов: межклеточные взаимодействия в органах в морфогенезе; нейрофизиология
Перинатальная диагностика врожденных аномалий состояния плода необходима для своевременного прогнозирования тяжести патологии и консультирования родителей. Одной из наиболее перспективных моделей для исследования различных подходов персонализированной терапии являются органоиды – клеточные структуры, моделирующие структуру и особенности различных органов, на более высоком уровне сложности и гетерогенности тканей по сравнению с традиционными двумерными моделями клеток. Выделение тканеспецифичных стволовых клеток плода, с целью разработки модели первичных органоидов, ограничено получением клеток из абортивного материала, что исключает перинатальную диагностику заболеваний. Также, получение аутологичных органоидов на основании человеческих эмбриональных стволовых клеток или индуцированных плюрипотентных стволовых клеток ограничено сложными и интенсивными манипуляциями, снижающими лояльность пациентов. Таким образом, разработка аутологичных, персонализированных in vitro моделей представляется актуальной проблемой. Для ее решения в работе Gerli et al., 2024 была разработана модель аутологичных органоидов человека на основании клеток, выделенных из амниотической и трахеальной жидкостей плода, полученных во время перинатальной диагностики во втором и третьем триместре. С помощью метода секвенирования единичных клеток (scRNA-seq), было показано, что амниотическая жидкость плода обладает разнообразным клеточным составом, включая преимущественно эпителиальные клетки различных тканей плода (почки, легкие, желудочно-кишечный тракт) (Рис.1).
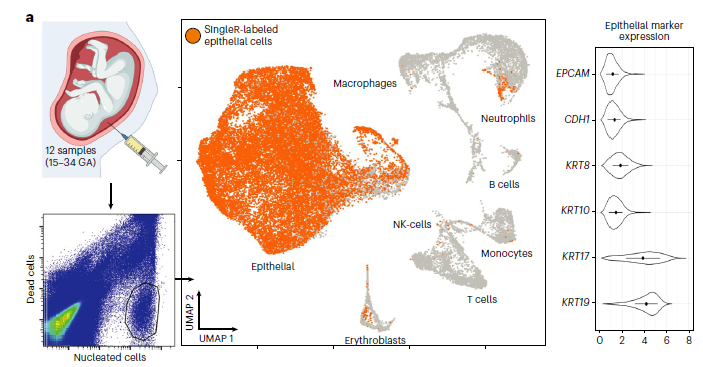
Рис. 1. Схематическое изображение отбора амниотической жидкости плода. FACS для сортинга живых клеток. scRNA-seq. UMAP клеточное содержание амниотической жидкости во 2-м и 3-м триместре. Уровень экспрессии генов эпителия.
С помощью флуоресцентно-активируемого сортинга (FACS) были отобраны живые клетки, выделенные из амниотической жидкости плода, которые затем были ресуспендированы в матригеле и культивировались в течение 2-х недель. Полученные эпителиальные органоиды (Amniotic Fluids organoids, AFO) отличались морфологически, клетки обладали высоким колонии-формирующим потенциалом (CFE), то есть были способны пролиферировать до 20 пассажа (Рис.2). Кроме того, клетки из диссоциированных органоидов были успешно криоконсервированы.
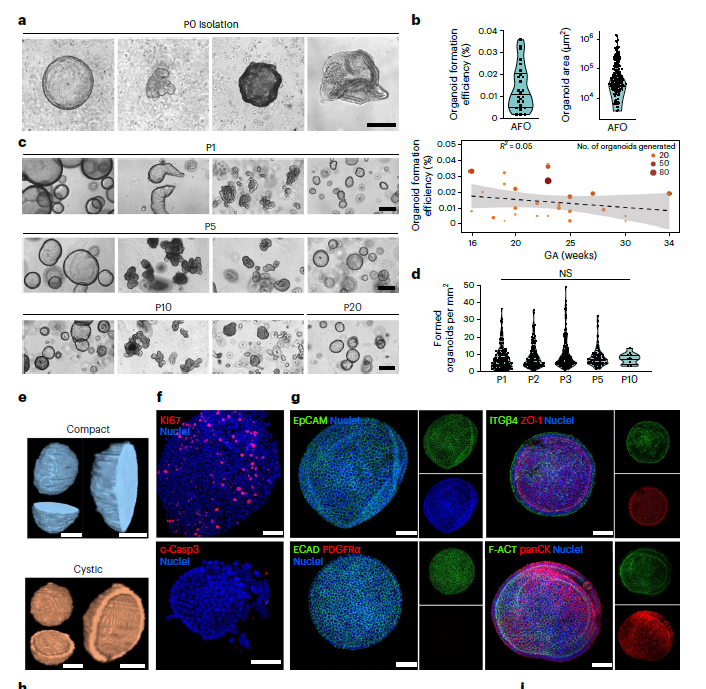
Рис. 2. Полученные из тотальной фракции AF органоиды. a-d AF Органоиды Р0-Р10. CFE AF органоидов. е. фазово-контрастная компьютерная томография (PC-CT) 2-х морфотипов AF органоидов. f, g иммуноцитохимическое окрашивание (ИЦХ) AF органоидов на маркеры эпителия и мезенхимы, межклеточных контактов.
Полное секвенирование РНК (bulk RNAseq) AF органоидов и методы биоинформатического анализа выявили колокализацию 3-х кластеров AFO с клетками контрольных органоидов, полученных из тканей тонкого кишечника, легких и почек плода. Далее AFO из каждого кластера были проанализированы методом scRNA-seq (Рис.3). Было показано, что эпителиальные клетки тонкого кишечника, легких и почек в амниотической жидкости плода могут образовать соответствующего типа органоиды.
Органоиды тонкого кишечника (SiAFOs) были способны к пассированию до 10 пассажей, формируя крипто(лакуно)-подобную структуру. Секвенирование РНК выявило сильную экспрессию эпителиальных маркеров тонкого кишечника (Рис.3).
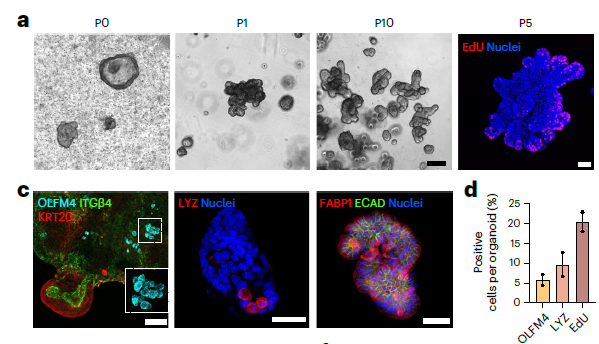
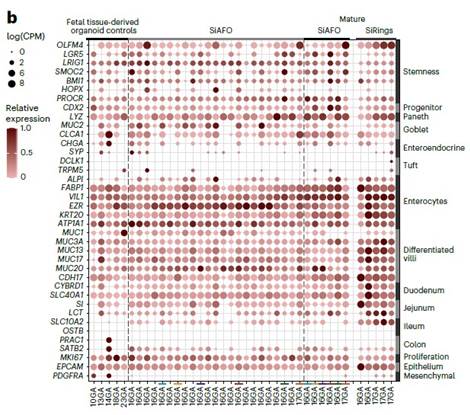
Рис. 3. a. Органоиды тонкого кишечника (SiAFOs) Р0-Р10. c. ИЦХ маркеров стволовых клеток кишечного эпителия. d. Количество клеток, несущих определённый эпителиальный маркер на органоид. b. Экспрессия генов в клетках SiAF органоидов.
Органоиды почечного канальца (KAFOs) отличались по морфотипу от SiAFOs, образуя более мелкие, плотные структуры, были способны к пролиферации до 10 пассажа. Bulk RNAseq KAFOs выявило экспресссию канонических генов развивающегося почечного эпителия и предшественников нефронов, а также экспрессию дистальных и проксимальных генов канальца. scRNA-seq KAFOs подтвердила наличие множественных клеток почечных канальцев (Рис.4).
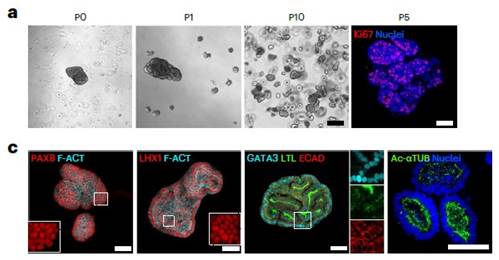
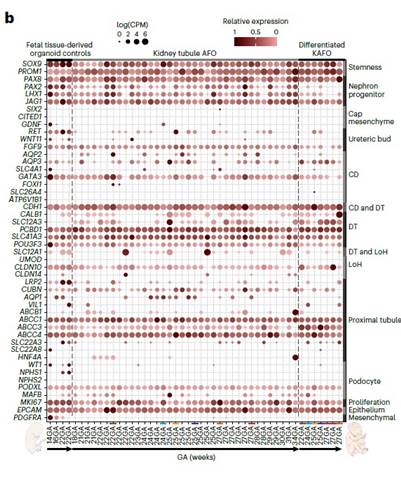
Рис. 4. a. Органоиды почечного канальца (KAFOs) Р0-Р10. c. ИЦХ маркеров стволовых клеток почек. b. Экспрессия генов в клетках KAF органоидов.
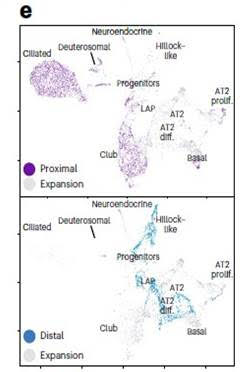
Органоиды легких (LAFOs) поддерживали высокую способность к пролиферации вплоть до 21 пассажа, формируя полые, цисто-подобные структуры. Bulk RNAseq LAFOs выявило высокую экспрессию генов эпителиальных маркеров альвеолоцитов 1го и 2го типа (АТ1, АТ2), а также относительно невысокую экспрессию генов клеток бронхиолярного эпителия. scRNA-seq LAFOs выявило успешную дифференциацию проксимальных отделов дыхательных путей с вновь сформировавшимися кластерами ресничных и дейтеросомных клеток, что связано с увеличением количества секреторных клеток (Рис.5).
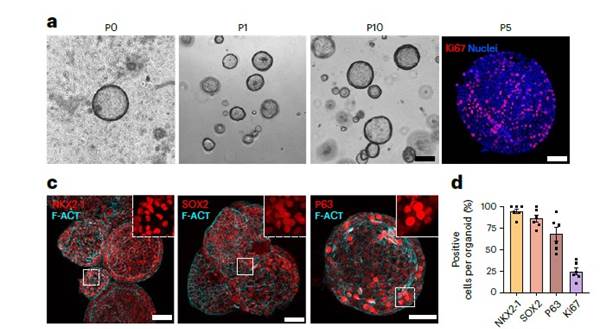
Рис. 5. a. Органоиды легких (LAFOs) Р0-Р10. c. ИЦХ маркеров стволовых клеток легочного эпителия. d. Количество клеток, несущих определённый эпителиальный маркер на органоид. е. Дифференцировка клеточных кластеров на проксимальные и дистальные. b. Экспрессия генов в клетках LAF органоидов.
Для того, чтобы протестировать полученные органоиды на модели патологии, в работе были получены органоиды из амниотической и трахеальной (TF) жидкости плода с врожденной диафрагмальной грыжей (CDH). Полученные CDH AFO и CDH TF органоиды были морфологически схожи с контрольными LAFOs, были пассированы до 10 пассажей. CDH AFO и CDH TF органоиды демонстрировали изменение в экспрессии генов сурфактанта, т.е. изменение соотношения АТ2/АТ1 клеток, являющееся признаком гипоплазии легких и CDH. scRNA-seq анализ выявил повышенную экспрессию генов АТ2 клеток в CDH AFO и CDH TF органоидах (Рис.6).
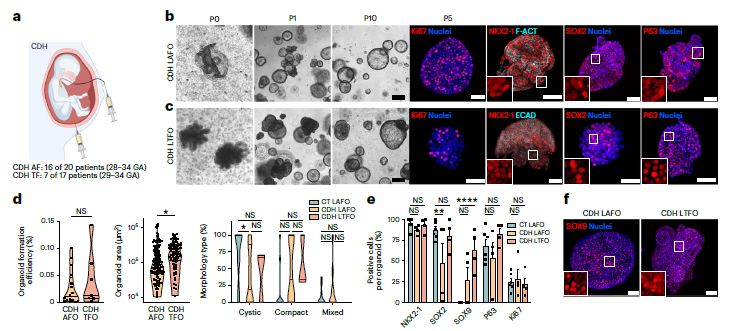
Рис. 6. a. Схематическое изображение отбора амниотической и трахеальной жидкости плода. b. CDH AFO и CDH TF органоиды Р0-Р10. ИЦХ на Ki67и маркеры прогениторов клеток легких. d-e. CFE CDH AFO и CDH TF органоидов.
Таким образом, в работе разработан новый метод получения первичных органоидов легких, почек и тонкого кишечника плода человека, путем минимально инвазивного отбора проб, позволяющий преодолеть этические и юридические ограничения. Вероятно, использование органоидов на основе амниотической и трахеальной жидкостей плода позволит улучшить перинатальную диагностику врожденных патологий и внесет вклад в развитие персонализированной медицины.
Новость подготовила
© И.А. Говорова
12.03.2024