

© Сухинич Кирилл Константинович, научный сотрудник лаборатории проблем регенерации, кандидат биологических наук.
© Александрова Мария Анатольевна, главный научный сотрудник лаборатории проблем регенерации, доктор биологических наук.
Со времен С. Рамон-Кахала известно, что в ЦНС с возрастом нарушаются функции и способности к восстановлению после травмы. Современные исследования предполагают, что старение связано с накоплением эпигенетического «шума», однако неизвестно, лежат ли такие эпигенетические изменения в основе воздействия старения на ЦНС. Авторы статьи, Лу и др., показали, что восстановление уровня метилирования ДНК ганглиозных клеток сетчатки (ГКС) у "старых" мышей до уровня "молодых" может позволить этим клеткам регенерировать после травмы и значительно улучшить зрительную функцию у старых мышей.
Паттерн метилирования ДНК закладывается в процессе эмбриогенеза и определяет типы и функции клеток. Во время старения происходит потеря эпигенетической информации, что в свою очередь приводит к нарушению экспрессии генов, характерной для молодого организма (Sen et al. 2016). Известно, что эктопическая экспрессия четырех факторов транскрипции OCT4, SOX2, KLF4 и MYC (известных как факторы Яманако) может репрограммировать соматические клетки в плюрипотентные стволовые клетки. Этот процесс стирает клеточную идентичность, сбрасывает возраст метилирования ДНК и, вероятно, может также противодействовать нормальному старению (Ocampo et al., 2016). В тоже время непрерывная экспрессия всех четырех факторов у мышей часто вызывает тератомы или приводит к летальному исходу из-за дисплазии тканей. Чтобы избежать этого авторы исключили из экспериментов фактор Myc, имеющий онкогенный профиль (Hofmannet al., 2015), и оставили OCT4, SOX2 и KLF4 (сокращенно OSK). Первая цель авторов состояла в том, чтобы перезагрузить эпигеном, не стирая собственную идентичность клеток. Им удалось показать, что экспрессия OSK в культуре клеток фибробластов от старых мышей повлияла на гены, связанные с возрастом и их мРНК профиль стал таким, как в клетках, полученных от молодых животных, при этом клеточная идентичность не потерялась и клетки не становились плюрипотентными. В дополнение, была проверена долгосрочная безопасность эктопической экспрессии OSK при внутривенном введении in vivo. Чтобы доставить и контролировать экспрессию OSK у мышей был использован аденоассоциированный вирус (adeno-associatedvirus, AAV) под контролем промотора элемента ответа тетрациклина (tetracyclineresponseelement). Добавляя в воду производное тетрациклина ̶ доксициклин вызывали индукцию OSK. После 10-18 месяцев непрерывной индукции OSK, опосредованной доставкой AAV, авторы не наблюдали увеличения опухолеобразования и негативных эффектов на общее состояние здоровья, что указывало на то, что клеточная идентичность сохраняется в OSK-экспрессирующих клетках. Таким образом, исследователи получили эффективный инструмент и перешли к тестированию на моделях повреждения клеток ЦНС.
С возрастом у млекопитающих происходит потеря регенеративного потенциала особенно в ЦНС. В частности, если на эмбриональных стадиях и в неонатальном возрасте регенерация зрительного нерва еще возможна, но далее уже нет. Авторы использовали модель повреждения зрительного нерва для тестирования эффектов опосредованной вирусом эктопической экспрессии OSK в ганглиозных клетках сетчатки (ГКС). Был установлен интересный факт, что вирусная индукция экспрессии OSK в ГКС молодых (4-недельных) или старых (12-месячных) мышей за 2 недели до повреждения зрительного нерва увеличивала выживаемость ГКС (без увеличения пролиферации) и способствовала регенерации аксонов, что было показано с помощью трейсерных красителей (Рис.1). Эффекты были специфичными только при использовании полной комбинации OSK, поскольку экспрессия одного или двух из трех факторов транскрипции не имела такого же эффекта. Лу с коллегами показали, что через 4 дня после повреждения зрительного нерва в ГКС обнаруживаются изменения в паттерне метилирования ДНК, которые сходны с наблюдаемыми при старении, а экспрессия OSK в поврежденных ГКС предотвращает эти изменения. ДНК деметилирование катализируется ферментами семейства ten-eleven translocation methylcytosine dioxygenases (TET). Авторы обнаружили, что экспрессия OSK увеличивает уровни экспрессии TET1 и TET2, и что нокдаун Tet1 или Tet2 блокирует выживание и регенеративные эффекты экспрессии OSK после повреждения зрительного нерва. Эти данные предполагают, что изменения в паттерне метилирования ДНК необходимы для положительного эффекта экспрессии OSK после повреждения. Авторы также показали, что в культивируемых нейронах человека экспрессия OSK предотвращала потерю аксонов после повреждения и защищала от ускоренных (связанных со старением) изменений в метилировании ДНК. Более того, нокдаун Tet2 в этих клетках аналогичным образом блокировал положительные эффекты экспрессии OSK в этой модели, что указывает на то, что эффекты экспрессии OSK схожи у мышей и людей.
Следующим шагом авторов было моделирование широко распространенного заболевания глаза человека, глаукомы. Известно, что при глаукоме повышенное внутриглазное давление приводит к дегенерации ГКС и их аксонов, что вызывает потерю зрения (Behtaj et al., 2020). Лу и др. повышали внутриглазное давление у мышей путем инъекции микрогранул в глаз, что приводило к дегенерации аксонов ГКС и потере остроты зрения (по результатам измерения оптомоторной реакции) через 4 недели. После этого авторы инъецировали вирусную конструкцию в стекловидное тело и индуцировали экспрессию OSK в ГКС в течение 4 недель. Под воздействием OSK восстанавливалась плотность аксонов ГКС до уровней, наблюдаемых в нормальных глазах; восстанавливалась потеря остроты зрения и нормализовалась электрическая активность ГКС (по данным электроретинограммы). Таким образом, экспрессия OSK может восстановить зрение в этой модели глаукомы.
Затем авторы проверили влияние экспрессии OSK на изменение зрения при старении (Рис. 2). Индуцирование экспрессии OSK в течение 4 недель в ГКС у 11-месячных мышей восстановило остроту зрения этих животных до уровня, сопоставимого с таковым у 5-месячных мышей. Секвенирование РНК ГКС от 5-месячных и 12-месячных мышей показало, что транскрипция 464 генов изменяется с возрастом, и что около 90% этих изменений отменяются экспрессией OSK. Авторы использовали машинное обучение, чтобы охарактеризовать признаки метилирования ДНК при старении, и показали, что экспрессия OSK препятствует появлению этих признаков у 12-месячных мышей. Паттерны старения были обогащены сайтами CpG, связанными с генами, которые рекрутируют ферменты TET. Нокдаун Tet1 или Tet2 блокировал эффекты экспрессии OSK и препятствовал восстановлению функции ГКС и зрения у старых мышей. Вместе эти результаты показывают, что экспрессия OSK индуцирует перепрограммирование паттерна метилирования ДНК в старых или поврежденных ГКС в более «молодое» состояние. Отдавая себе отчет в том, что изменение паттернов метилирования далеко не единственный фактор, вовлеченный в процесс старения, Лу с коллегами предполагают, что разработанный подход может способствовать восстановлению тканей и обращению вспять возрастных изменений у людей.
Behtaj S. et al. Retinal Tissue Bioengineering. Materials and Methods for the Treatment of Glaucoma // Tissue Eng Regen Med. 2020. V. 17. №3. P. 253-269
Hofmann J. W. et al. Reduced expression of MYC increases longevity and enhances healthspan // Cell. 2015. V. 160. №3. P. 477–488
Ocampo A. et al. In vivo amelioration of age-associated hallmarks by partial reprogramming // Cell. 2016. V. 167. №7. P. 1719–1733
Sen P. et al. Epigenetic mechanisms of longevity and aging // Cell. 2016. V. 166. №4. P. 822–839
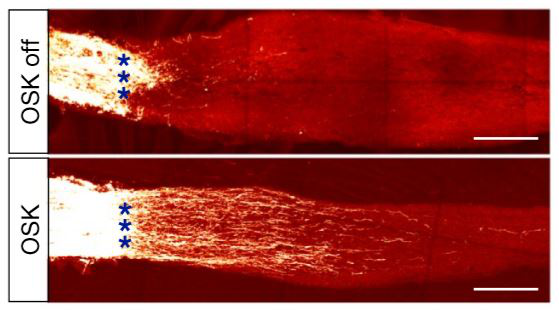
Рис. 1. Регенерация аксонов зрительного нерва "без" и "с" экспрессией OSK.
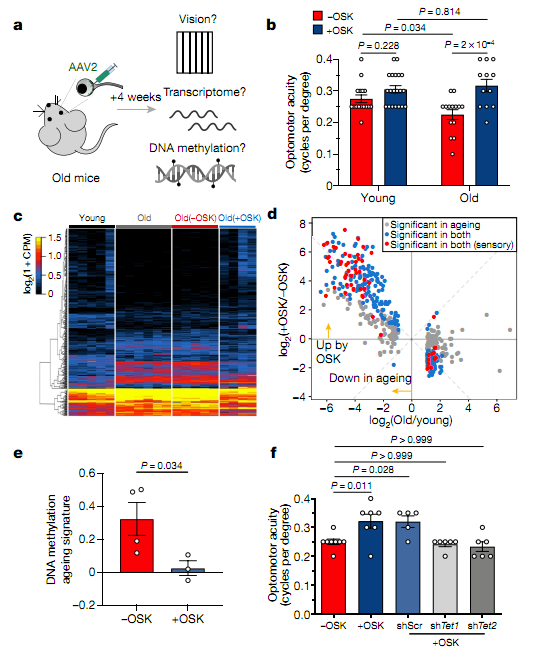
Рис. 2. Восстановление «молодого» зрения, транскриптома и признаков старческогометилирования ДНК у старых мышей:
a - схема эксперимента по проверке эффекта перепрограммирования на старых мышах;
b - острота зрения у молодых (4-месячных) и старых (12-месячных) мышей после 4 недель воздействия -OSK или + OSK;
c, d - иерархическая кластерная тепловая карта (c) и диаграмма рассеяния (d), показывающие уровни мРНК 464 генов, которые по-разному экспрессировалисьв молодых и старых ГКС и эффект OSK. е, признаки старческогометилирования ДНК в ГКС от 12-месячных мышей, инфицированных в течение 4 недель -OSK или + OSK.
Новость подготовили © Сухинич K.K. © Александрова М.А.
12.03.2021