
 © Никишин Денис Александрович, к.б.н. доцент кафедры эмбриологии МГУ им. М.В. Ломоносова, с.н.с. лаборатории проблем регенерации (группа эмбриофизиологии) ИБР РАН.
Область научных интересов: раннее эмбриональное развитие, оогенез, нейробиология развития.
© Никишин Денис Александрович, к.б.н. доцент кафедры эмбриологии МГУ им. М.В. Ломоносова, с.н.с. лаборатории проблем регенерации (группа эмбриофизиологии) ИБР РАН.
Область научных интересов: раннее эмбриональное развитие, оогенез, нейробиология развития.
© Ерюкова Юлия Эдуардовна, магистр кафедры эмбриологии МГУ им. М.В. Ломоносова. Область научных интересов: оогенез, сохранение овариального резерва, синдром преждевременного истощения яичника.
Преждевременная недостаточность яичников (premature ovarian insufficiency, POI) – это серьезная социально значимая медицинская патология, которая проявляется в прекращении функциональной активности яичников и овуляции. Состояние возникает у 3,7% женщин, не достигших возраста 40 лет, и является частой причиной женского бесплодия. Причины возникновения этого заболевания могут быть самыми разными (синдром Шерешевского-Тернера, наличие сопутствующего аутоиммунного заболевания, перенесенная ранее химиотерапия), однако в большинстве случаев POI возникает идиопатически, то есть без очевидных причин. Одной из серьезных проблем диагностики данного состояния является то, что современные клинические методы не позволяют определить предрасположенность к этому заболеванию или обнаружить его на ранних стадиях. В связи с этим, выявление молекулярных основ развития недостаточности яичников и идентификация генетических маркеров, связанных с предрасположенностью к возникновению POI, может помочь своевременно выявить проблему и вовремя предпринять меры по сохранению фертильности.
Несмотря на большое количество исследований в этой области, на данный момент выявлено только 90 генетических маркеров, которые встречаются в очень незначительном количестве случаев заболевания. В новом исследовании, опубликованном в журнале Nature Medicine, китайские исследователи из Шаньдунского университета провели полноэкзомное секвенирование у 1030 пациенток университетской больницы и обнаружили патогенные варианты известных ассоциированных с POI генов и выявили еще 20 новых маркерных генов.
Было проведено крупнейшее на сегодняшний день полноэкзомное секвенирование пациенток с POI и составлен достаточно подробный генетический ландшафт данной патологии. Секвенирование геномных ДНК, извлеченных из образцов периферической крови всех 1030 пациенток с POI, проводилось на платформах NovaSeq (Illumina). По однонуклеотидным полиморфизмам (SNP) и малочастотным аллелям (MAF) были определены генотипы пациенток с точностью 95% и было подтверждено, что все участники исследования не являются ближайшими родственниками друг другу.
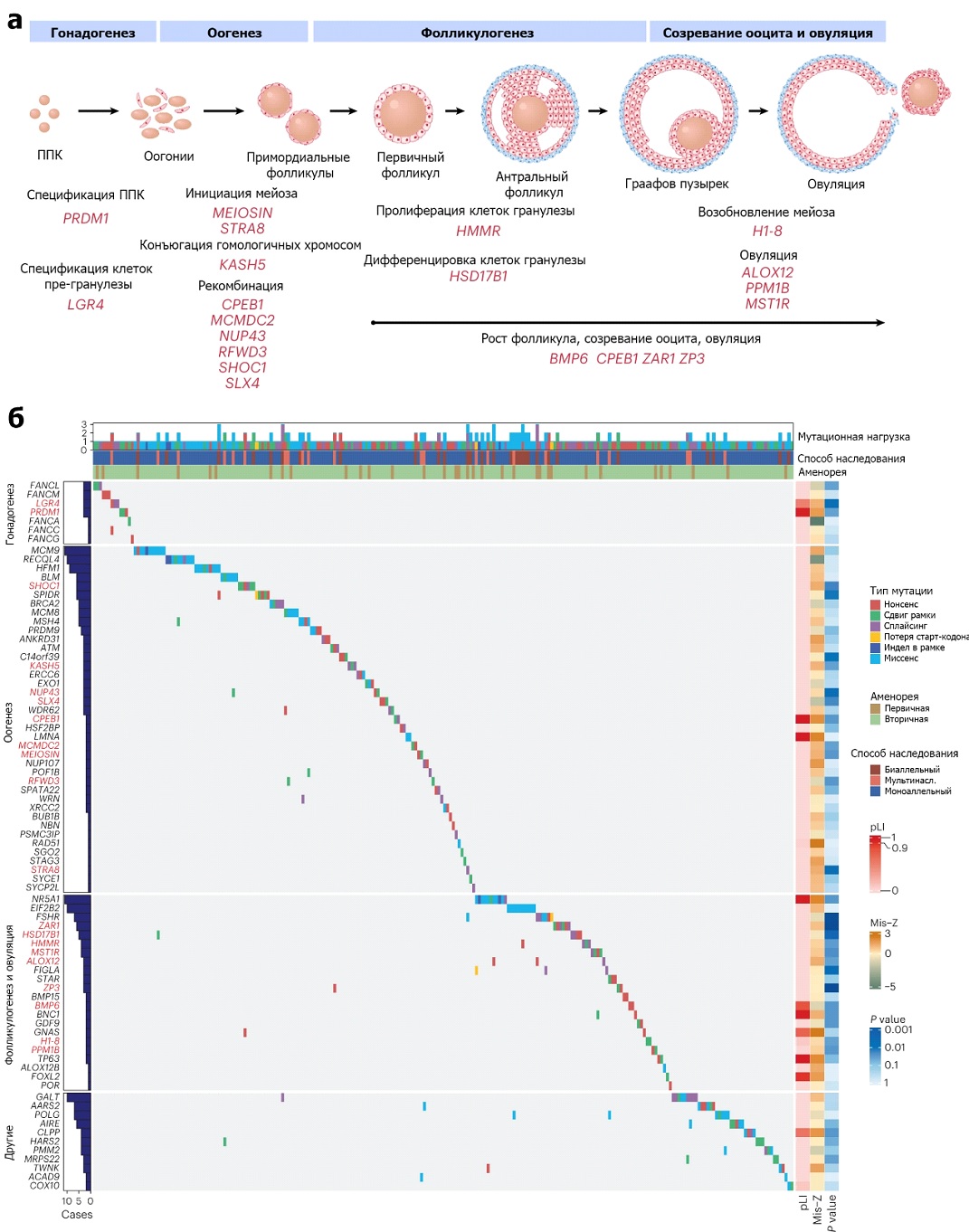
Сначала авторы проанализировали известные генетические маркеры и идентифицировали 195 патогенных и вероятно патогенных вариантов в 59 генах, включая 108 вариантов (55,4%) с потерей функции, 81 миссенс-вариант (41,5%), 4 делеции (2,1%) внутри рамки считывания и 2 варианта (1%) в области, ответственной за сплайсинг (Рисунок 1). Все обнаруженные варианты были подтверждены секвенированием по Сэнгеру и проанализированы по уровню экспрессии белка. В результате варианты этих генов обнаружили у 193 пациенток, то есть их вклад в заболеваемость составляет 18,7%. Чаще всего варианты находили в генах NR5A1 и MCM9, а также в генах, связанных с мейозом, митохондриальной функцией, метаболизмом и аутоиммунной регуляцией, что авторы объясняют плейотропным действием этих генов.
Исследователи сравнили полученные результаты полноэкзомного секвенирования с результатами секвенирования 5000 пациентов без POI (контрольная группа). Кандидатов в ассоциированные с POI гены искали среди тех, чья роль в яичнике известна. Самый сильный вклад в развитие POI, как показали ученые, вносят гены ZAR1 и ZP3. ZAR1 вовлечен в фолликулогенез, овуляцию и эмбриональное развитие. ZP3 обладает плейотропным действием на фолликулогенез и кодирует компоненты блестящей оболочки (zona pellucida), начиная со стадии первичного фолликула. Остальные кандидатные гены участвуют в гонадогенезе (LGR4 и PRDM1), мейозе (CPEB1, KASH5, MCMDC2, MEIOSIN, NUP43, RFWD3, SHOC1, SLX4 и STRA8), фолликулогенезе и овуляции (ALOX12, BMP6, H1-8, HMMR, HSD17B1, MST1R, PPM1B, ZAR1 и ZP3). Как мы видим, генетически детерминированный патогенез POI может определять развитие болезни на самых разных стадиях созревания яйцеклеток и репродуктивной системы в целом (Рисунок 1). Интересно, что мутации в генах SHOC1 и KASH5 ранее были обнаружены у мужчин с необструктивной азооспермией, а в этой работе описаны варианты таких мутаций у женщин с POI. Можно говорить о том, что эти мейотические гены являются общими генетическими детерминантами как в женском, так и в мужском гаметогенезе.
Основной и самый выраженный симптом POI – аменорея, поэтому далее исследователи попытались выяснить, какой вклад вносят эти гены в развитие первичной и вторичной аменореи, то есть соотнести генотип и фенотип. Первичная аменорея – это отсутствие менструации к возрасту 15 лет у пациенток с нормальным ростом и вторичными половыми признаками. Вторичная аменорея – это отсутствие менструаций в течение ≥ 6 месяцев или продолжительностью 3 цикла после установления регулярных менструальных циклов. В данной работе средний возраст пациенток был 22.2 года. Было показано, что ген FSHR наиболее активно участвует в развитии первичной аменореи, а AIRE, BLM и SPIDR – в развитии вторичной аменореи. Благодаря этому передовому исследованию и выявленным генам, в будущем возможна ранняя диагностика синдрома раннего истощения яичников. Исследователи предлагают проводить генетический скрининг женщин с симптомами вторичной аменореи и их родственниц. Также, исходя из генов-маркеров, они делают вывод, что данный синдром может развиваться постепенно и по разным причинам. Возникновение POI может сопровождаться симптомами разной степени тяжести и, соответственно, разными стадиями: нормальный уровень ФСГ с пониженной фертильностью, повышенный уровень ФСГ с регулярными менструациями и нерегулярные менструации.
Таким образом, эта работа дает самую подробную на сегодняшний день характеристику маркерных генов, ассоциированных с POI. Благодаря большому объему выборки и применению современных геномных технологий это исследование может помочь в понимании общих генетических факторов репродуктивного старения. В перспективе результаты этой работы могут лечь в основу генетического консультирования больных и родственников с POI для планирования беременности.
Новость подготовили
© Никишин Д.А. Ерюкова Ю.Э.
11.05.2023