 © Кремнёв Станислав Валерьевич,
кандидат биологических наук, старший научный сотрудник, лаборатория эволюции морфогенезов ИБР РАН.
Научные интересы: морфогенез, эволюция эмбрионального развития.
© Кремнёв Станислав Валерьевич,
кандидат биологических наук, старший научный сотрудник, лаборатория эволюции морфогенезов ИБР РАН.
Научные интересы: морфогенез, эволюция эмбрионального развития. Способность к регенерации утраченных тканей и органов широко распространена во взрослой жизни многих животных, однако одни виды животных имеют более высокую способность к регенерации, чем другие, причем существенные отличия наблюдаются в пределах одного типа. Напротив, способность поддерживать целостность и функциональность тканей при физиологической регенерации (гистостазе) во взрослом возрасте распространена повсеместно. Несмотря на сходство между программами регенерации и роста, большинство животных демонстрируют сильное снижение способности к формированию ткани de novo без заметной потери пролиферативной активности клеток или физиологической регенерации. Примеры этого явления широко встречаются во многих группах многоклеточных животных, например: конечности Xenopus (Slack et al., 2004), дистальные отделы пальцев млекопитающих (Lehoczky et al., 2011), имагинальные диски Drosophila (Harris et al., 2016) и ткань миокарда мышей (Porrello et al., 2011). Таким образом, объяснения, предполагающие потерю регенеративной способности в результате возрастного снижения активности клеточной пролиферации или дифференцировки, являются маловероятными. Альтернативной причиной ослабления способности регенерации может служить потеря системы формирования разметки эмбриональных осей, которая надежно определяет позиционную и масштабирующую информацию на ранних стадиях эмбриогенеза. Как правило, данная система распадается во взрослом состоянии у организмов с низкой регенеративной способностью.
Пресноводные планарии имеют почти неограниченную способность к регенерации и полному и постоянному обновлению тканей посредством гистостаза и используют конститутивную позиционную информацию в качестве системы координат при поддержании разметки тела. Эти животные постоянно экспрессируют молекулы морфогенов, которые определяют главные оси тела и используются для спецификации региональной идентичности при регенерации: сигнальный каскад Wnt и FGFRL для передне-задней оси (AP), компоненты BMP сигнального пути для дорсо-ветральной оси (DV) и Slit / Wnt5 каскад для медиолатеральной оси (ML). Несмотря на то, что экспрессия некоторых факторов индуцируются травмой и функционирует на ранних стадиях регенерации, большинство из них имеет постоянную экспрессию в определенных участках тела у неповрежденных животных в течение всей жизни. Нарушения экспрессии этих факторов могут приводить к дупликации органов и частей тела или изменениям масштаба отдельных его частей относительно всего тела. Такие эффекты наблюдаются как у регенерирующих животных, так и у животных, подверженных РНК-интерференции (RNAi), т.е. ингибированию определенных РНК, в течение длительного периода времени при отсутствии травмы. Например, РНК интерференция гена notum, который является антагонистом Wnt каскада, приводит к формированию дополнительной пары глаз на голове перед уже существующими. В своей статье Hill and Peterson, 2018, использовали эту модель для исследования регенерационных и гомеостатичсеких потенций тканей, вызванных нарушением изначальной молекулярной разметки тела методом РНК интерференции.
Эктопичесике глаза, сформировавшиеся в результате подавления экспрессии гена notum структурно и функционально идентичны глазам, сформировавшимся в ходе нормального развития. Это подтверждается не только на морфологическом уровне, но и на функциональном: животные теряли отрицательный фототаксис только в том случае, если были удалены обе пары глаз, в то время как отрицательный фототаксис сохранялся при наличии только эктопических глаз.
Следующим шагом исследователи решили проверить регенерационные способности предсуществующих и дополнительных глаз. У интактных планарий глаза регенерируют примерно за две недели. Примерно столько же времени необходимо для регенерации дополнительных глаз у животных с подавленной экспрессией гена notum. Однако, восстановления предсуществующих глаз у таких животных не происходило. Важно отметить, что при длительном подавлении гена notum последовательно формируются две пары дополнительных глаз, при этом способностью к регенерации всегда обладают только глаза расположенные наиболее антериорно. Ни предсуществующие глаза, ни первая пара эктопических глаз оказывались не способны к регенерации (Рис. 1). Полученные результаты свидетельствуют о том, что подавление экспрессии гена notum (антагониста wnt сигнального пути) сдвигает зону компетенции к регенерации глаз к антериорному полюсу тела.
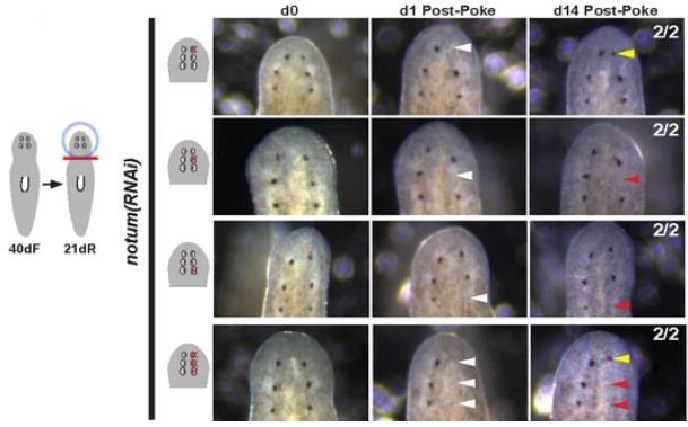
Рис. 1. Длительное подавление экспрессии гена notum приводит к формированию нескольких пар эктопических глаз. Способностью к регенерации обладает только наиболее антериорно расположенная пара глаз.
Основываясь на полученных результатах можно предположить, что нерегенерирующая предсуществующая пара глаз у notum(RNAi) животных должна постепенно исчезнуть в результате нарушения поддержания клеточного гомеостаза ткани. Однако на протяжении более 200 дней наблюдения за четырехглазыми животными не было отмечено нарушения структуры или функции ни у какой пары глаз. Из предыдущих данных известно, что полная смена клеточного состава глаза планарии проходит примерно за 60 дней (Lapan and Reddien, 2012), таким образом, у экспериментальных животных должен был смениться полный клеточный состав каждого глаза как минимум три раза. Продолжительность существования предсуществующих глаз свидетельствует об активном процессе поддержания клеточного гомеостаза ткани при потере способности к регенерации.
Далее исследователи решили проверить, какой вклад вносят дифференцирующиеся необласты в поддержание гистостаза тканей глаз планарий, как эндогенных так и эктопических глаз. Для этого был поставлен эксперимент с подавлением экспрессии гена ovo на фоне подавления гена notum. Ген ovo является мастер-геном направляющем дифференцировку необластов по пути прогенеторных клеток глаза. Оказалось, что при подавлении гена ovo происходит исчезновение глаз, причем исчезновение предсуществующих и эктопических глаз происходит с одинаковой скоростью. Также методом включения метки BrdU в днк пролифферирующих необластов было выяснено, что замена клеток для поддержания структуры обоих типов глаз идет с одинаковой интенсивностью. Полученные результаты свидетельствуют, что изменения паттерна разметки тела путем подавления экспрессии гена notum сдвигает область регенерации, но не область поддержания гомеостаза ткани. Дополнительными экспериментами было подтверждено, что неспособность к регенерации предсуществующих глаз не является следствием нарушения системы быстрого ответа на повреждение.
Далее авторы решили проверить, являются ли полученные результаты следствием подавления именно гена notum или, действительно, выявленный феномен отражает различие механизмов регенерации и поддержания клеточного гомеостаза ткани и зависит от глобальной молекулярной разметки тела. Чтобы выяснить это, они сместили Wnt разметку тела в обратную сторону: постериорно. Для этого были проведены сходные эксперименты, но подавляли экспресиию генов nt11-6/wntA и fzd5/8-4. Во всех случаях формировались дополнительные эктопические глаза, но уже постериорно относительно предсуществующих эндогенных глаз. В данном случае, способность к регенерации проявляли только постериорные эктопические глаза, что свидетельствует в пользу того, что эффект не является ген-специфическим.
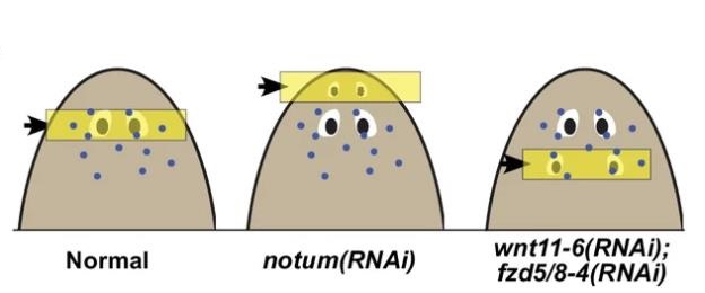
Рис. 2. Модель, показывающая смещение области регенерации глаз у животных с подавленной экспрессией генов notum или wnt11-6 и fzd5/8-4.
Также было показано, что выявленный феномен не является специфическим в случае регенерации глаз, а также наблюдается при регенерации дуплицированной глотки в результате смещения молекулярной разметки тела.
Полученные результаты проливают свет на базовые механизмы регенерации и поддержания клеточного гомеостаза ткани и объясняют, как может происходить потеря регенерационных способностей в эволюции или индивидуальном развитии без утраты механизмов долгосрочного поддержания структуры тканей.
Harris R.E., Setiawan L., Saul J., Hariharan I.K., Localized epigenetic silencing of a damage-activated WNT enhancer limits regeneration in mature Drosophila imaginal discs. Elife. 2016 Feb 3;5. pii: e11588. doi: 10.7554/eLife.11588.
Hill E.M., Petersen C.P. Positional information specifies the site of organ regeneration and not tissue maintenance in planarians. Elife. 2018 Mar 16;7. pii: e33680. doi: 10.7554/eLife.33680.
Lapan S.W., Reddien P.W., Transcriptome analysis of the planarian eye identifies ovo as a specific regulator of eye regeneration. Cell Rep. 2012 Aug 30;2(2):294-307. doi: 10.1016/j.celrep.2012.06.018.
Lehoczky J.A., Robert B., Tabin C.J. Mouse digit tip regeneration is mediated by fate-restricted progenitor cells. Proc Natl Acad Sci U S A. 2011 Dec 20;108(51):20609-14. doi: 10.1073/pnas.1118017108
Slack J.M., Beck C.W., Gargioli C., Christen B. Cellular and molecular mechanisms of regeneration in Xenopus. Philos Trans R Soc Lond B Biol Sci. 2004 May 29;359(1445):745-51.
Porrello E.R., Mahmoud A.I., Simpson E., Hill J.A., Richardson J.A., Olson E.N., Sadek H.A., Transient regenerative potential of the neonatal mouse heart. Science. 2011 Feb 25;331(6020):1078-80. doi: 10.1126/science.1200708.
Новость подготовил © КРЕМНЁВ С.В.
10.12.2018