 © Дашинимаев Эрдем Баирович
научный сотрудник лаборатории клеточной биологии, кандидат биологических наук.
© Дашинимаев Эрдем Баирович
научный сотрудник лаборатории клеточной биологии, кандидат биологических наук.
Система редактирования генома на основе CRISPR/Cas9 является перспективным орудием в арсенале регенеративной биомедицины. При помощи нее можно осуществлять различные манипуляции с выбранными участками генов, изменяя последовательности генетического кода по своему желанию. Основной инструмент для такого рода манипуляций является гомологичная репарация при помощи ДНК-Донора (ГРДД), когда после осуществления разреза (либо обоих цепей в одном месте, либо разнесенных «ник»-разрезов) происходит репарация разрыва геномной ДНК, используя в качестве матрицы ДНК-Донор с гомологичными «плечами». Однако, эффективность ГРДД обычно довольно низкая, что накладывает ограничение на ее использование только в делящихся культурах клеток, когда после трансфекции исследователь может клонировать культуру клеток, найти тот самый желаемый клон (из десятков или сотен других вариантов) и использовать его. Также не маловажным фактором является то, что в делящихся клетках хроматин испытывает циклы «разрыхления/сжатия», хотя бы во время репликации гДНК, что позволяет Cas9 теоретически достигнуть любого участка генома, тогда как в стабильных пост-митотических клетках этот участок может быть плотно упакован. Таким образом встает вопрос – а возможно ли эффективно осуществлять редактирование генома in situ, во взрослом организме? Ведь существует множество заболеваний, при которых выделение и последующие трансплантации клеток бессмысленны, но при этом изменение генома клеток больного органа in situ могло бы вылечить пациента.
В рассматриваемой работе, опубликованной в журнале «Neuron» 18 октября 2017 года, авторы показывают, что на самом деле ГРДД можно осуществлять эффективно как в делящихся, так и в неделящихся терминально-дифференцированных клетках, выбрав для этого достаточно актуальный и релевантный модельный объект – нейроны головного мозга. Работа была выполнена в коллаборации института нейронаук Макса Планка во Флориде, США (Max Planck Florida Institute for Neuroscience) и японского агентства науки и технологии (Japan Science and Technology Agency).
В первой части статьи, для доказательства работоспособности дизайна эксперимента, исследователи разработали систему, когда при помощи Cas9 и ДНК-Донора они могут «пришивать» к выбранным эндогенам (b-Actin и CaMKIIa) либо небольшие маркерные белковые последовательности (HA-домен), либо флуоресцентный белок EGFP. Для этого в выбранную зону генома при помощи ГРДД вставляются соответствующие ДНК-последовательности. Для доставки использовали конструкт на основе адено-ассоциированных вирусов (AAV) в котором сразу находилась кассета для экспрессии гидовой РНК и ДНК-Донор (Рис.1). Для «облегчения» задачи на первом этапе, использовали трансгенных мышей с постоянной экспрессией белка Cas9 и заколку вируса в мозг эмбрионам (E10-16) in utero. Далее, через 14 дней после рождения, мозг фиксировали и на криосрезах определяли клетки в геном которых произошло встраивание маркерных последовательностей ДНК. В результате было убедительно показано, со всеми необходимыми контролями, что встраивание происходит в большом количестве, во всех отделах головного мозга и связанных с ним структурах (обонятельная луковица, сетчатка, кора головного мозга, гиппокамп, стриатум, таламус, гипоталамус, мозжечок, средний мозг и спинной мозг). Тщательно проанализировав срезы, авторы пришли к выводу, что редактирование генома и ГРДД происходило не только в делящихся клетках, но также и в пост-митотических клетках. Отталкиваясь от этих результатов, далее исследователи провели серию аналогичных экспериментов in vitro уже на органотипических культурах срезов головного мозга постнатальных мышей (P5-6, также Cas9+), которые уже почти не содержали делящихся клеток. Было показано, что доля отредактированных неделящихся нейронов весьма высока, порядка 15-30% и зависела от выбранного гена (редактировали CaMKIIa и ERK2). Повторив эксперименты на диссоциированных культурах нейронов из гиппокампа, авторы пронаблюдали схожие результаты.
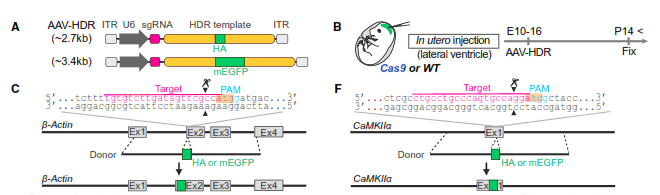
Рис.1. Дизайн эксперимента. Были созданы конструкты на основе аденоассоциированных вирусов, которые несут как кассету с соответствующей гидовой РНК (U6 sgRNA), так и ДНК-донор (HDR Template) (А). Конструкты закалывали в мозг эмбрионам мышей с трансгеном Cas9 (B), в качестве контроля брали мышь дикого типа. ДНК-доноры были организованы таким образом, что вставляли HA-последовательность или ген EGFP плотную к 5’-концу ORF последовательности целевого гена – bActin или CaMKIIa, получая таким образом на выходе химерный белок (C, F).
Для реализации замысла по редактированию генома нейронов мозга обычной мыши, без трансгена Cas9, исследователи собрали второй генетический конструкт на основе AAV, содержащий Cas9 белок. На самом деле, это представляет собой определенную трудность, т.к. максимальный размер всей пакуемой кассеты в AAV не превышает 4,9 килобазы (а размер ORF одного только белка Cas9 – 4,3 кб). Поэтому для этого пришлось воспользоваться минимальными промотером (0,25 кб) и сигналом полиаденилирования (48 п.н.). Работоспособность системы с котрансфекцией двух AAV конструктов была проверена на моделях in vitro (диссоциированные культуры нейронов и органотипические культуры срезов мозга, причем двух разных животных – мыши и крысы), где в конце было подтверждено, что необходимая вставка в результате ГРДД также происходит в пост-митотических нейронах, хотя и с меньшей эффективностью (порядка 6%).
В конце концов, авторы провели серию финальных экспериментов, в которых они закололи провалидированные AAV конструкты в мозг взрослых мышей (P34-54), использовав в качестве мишеней разные отделы мозга (кора головного мозга, гиппокамп, миндалевидное тело и стриатум) (Рис.2). В результате были получены данные о встраивании маркеров при помощи ГРДД в значительную долю нейронов (10-15%, в зависимости от места укола). Также исследователи провели эксперимент с взрослыми мышами (P354) c моделью болезни Альцгеймера (линия J20, с введенным мутантным геном APP), на которых при помощи своей системы показали специфическое уменьшение размеров вторичных дендритных отростков нейронов в больных мышах по сравнению со здоровым контролем.
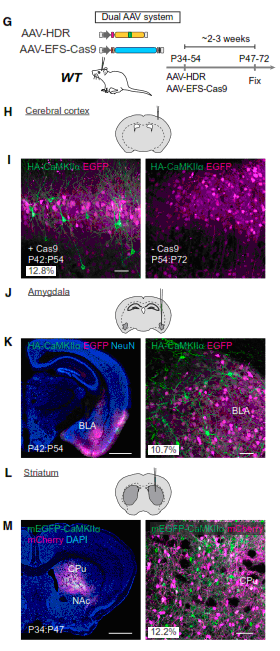
Рис.2. Дизайн эксперимента на взрослых мышах (G). H,I,J,K – При встраивании маркерной последовательности HA в ген CaMKIIa, далее ее можно обнаружить при помощи специфических антител (показано зеленым). Ген EGFP вводился в клетки также при помощи AAV, для контроля эффективности трансфекции. L,M – Здесь в ген CaMKIIa встраивался уже EGFP (зеленым), а белок Cherry служил контролем.
Таким образом, суммируя все полученные результаты, можно сказать, что авторами было убедительно показана возможность редактирования генома в неделящихся клетках in situ, как минимум в нейронах головного мозга. Разработанный подход можно использовать при лечении различных нейродегенеративных заболеваний, имеющих наследственную генетическую этиологию.
Новость подготовил © Дашинимаев Э.Б.
10.11.2017