https://doi.org/10.3390/ijms26031193

Область научных интересов: стратегии регенерации, молекулярно-генетические механизмы репрограммирования клеток пигментного эпителия сетчатки, нейродегенеративные патологии глаза, эпителиально-мезенхимальный переход, эндогенные системы защиты клеток.

Область научных интересов: молекулярно-генетические механизмы регенерации тканей глаза; эндогенные системы защиты клеток от стресса, регенеративная медицина.
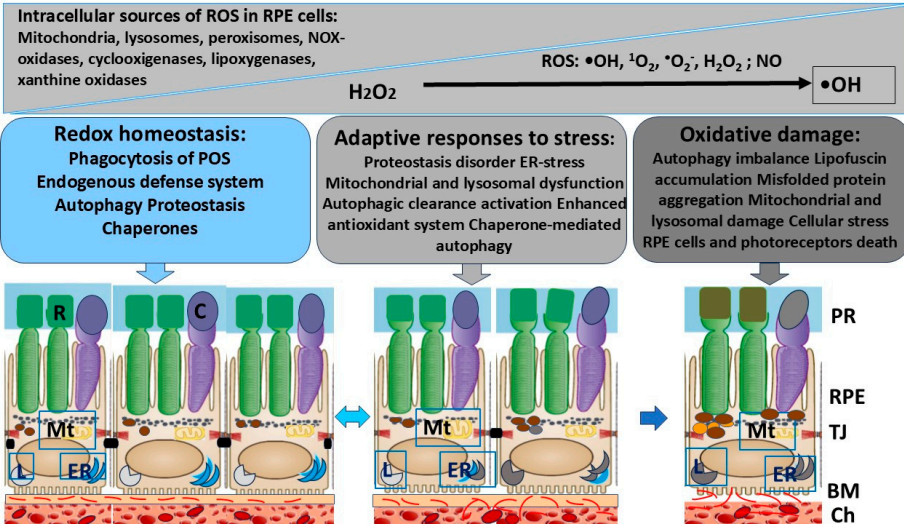
Поддержание редокс-гомеостаза является критическим условием жизнеспособности и функций клеток. Высоко интенсивный метаболизм в клетках ретинального пигментного эпителия (РПЭ) и фоторецепторах сетчатки создает риск развития в них окислительного стресса (ОС). Важное место механизмах регуляции жизнедеятельности клеток принадлежит молекулярным шаперонам, таким как белки теплового шока (БТШ, HSPs) (Zhao et al., 2020). HSPs активируются в ответ на внутренние и внешние стрессоры (ОС, гипоксия, гипергликемия и др.), выступая в качестве центра адаптивного ответа (Balchin et al., 2020). В обзоре мы провели анализ текущего состояния исследований эндогенной системы защиты в РПЭ, с акцентом на аутофагию и HSPs, подчеркнув их значимость как потенциальных мишеней для терапии связанных с РПЭ дегенеративных патологий сетчатки.
Основные функции РПЭ. РПЭ обеспечивает барьерную функцию, постоянное обновление дисков наружных сегментов фоторецепторов за счет их фагоцитоза (Lakkaraju et al., 2020). Дефекты в процессе фагоцитоза приводят к нарушению функции сетчатки (Mazzoni et al., 2014). Ключевая физиологическая функция РПЭ связана с защитой фоторецепторов от избыточного света и активных форм кислорода (АФК) посредством эндогенных защитных систем. РПЭ поддерживает функции нейронов сетчатки и сосудистой оболочки глаза (George et al., 2021), благодаря скоординированному действия компонентов эндогенной системы защиты. Дисфункция клеток РПЭ связана с нарушениями ключевых компонентов эндогенной системы защиты РПЭ и способствует развитию заболеваний сетчатки, таких как возрастная макулярная дегенерация (ВМД), диабетическая ретинопатия (ДР), пролиферативная витреоретинопатия (ПВР) (Kim et al., 2021).
Ключевые эндогенные защитные системы РПЭ обеспечивают окислительно-восстановительный гомеостаз и антиоксидантную защиту клеток, способствуют восстановлению поврежденных белков или их деградации посредством аутофагии и убиквитин-протеасомной системы (Kaarniranta et al., 2019). Аутофагия это эволюционно консервативный механизм прижизненной утилизации (деградации с помощью лизосом) внутриклеточного материала, ненужных клеточных структур для поддержания клеточного гомеостаза, необходимый для запрограммированного выживания клеток. Процесс аутофагии играет важную роль в адаптации к стрессу, иммунных реакциях и регуляции воспалительных процессов. Эндогенные защитные системы клеток РПЭ включают систему шаперонов, связывающую антиоксидантную систему (АОС) и различные формы аутофагии (Рисунок 1). В АОС входят ферменты супероксиддисмутазу (СОД), каталазу, цитохром P450 монооксигеназа), неферментативные молекулы (тиоредоксин, глутатион-аскорбат и β-каротин). В РПЭ ключевыми компонентами АОС являются меланосомы и меланин, которые выполняют функции экранирующих светофильтров (Dontsov et al., 2024). Меланин снижает фотоокисление липофусцина (ЛФ), защищая РПЭ от вредного воздействия яркого света, удаляет избыток АФК, тем самым защищая клетки от ОС (Hu et al., 2008).
Рисунок 1. Эндогенная система защиты, поддерживающая редокс-гомеостаз клеток РПЭ. Сокращения: TJ – плотные контакты; BM – мембрана Бруха; Ch – хориоидея; PR – фоторецепторы; R – палочки; C – колбочки; ER – эндоплазматический ретикулум; Mt – митохондрии; L – лизосомы; POS – наружные сегменты фоторецепторов; ROS – активные формы кислорода.
Основные межклеточные и молекулярные события, способствующие окислительному повреждению клеток РПЭ. В клетках сетчатки АФК продуцируются лизосомами (фагосомами), пероксисомами, меланосомами и внутриклеточными мембраносвязанными НАДФН-оксидазами (Kaemmerer et al., 2007; Markitantova, Simirskii, 2020). Разрушительное влияние АФК проявляется в окислении белков и мембранных липидов, повреждении ДНК (Sies et al., 2017). В условиях ОС митохондрии усиливают продукцию АФК, что может привести к апоптозу клеток (Kaarniranta et al., 2019). Слабо окисленные формы белков подвергаются разрушению лизосомами, и могут служить субстратами для протеасом. Высоко окисленные белки, вероятно, образуют стабильные агрегаты с окисленными липидами, образуя гранулы ЛФ. Избыточное накопление агрегированных белков способствует стрессу эндоплазматического ретикулума (ЭР), увеличивает ОС, что приводит к повреждению лизосом и воспалению (Zhang et al., 2014). Процесс образования ЛФ в РПЭ сопровождается ингибированием активности протеасом в РПЭ и снижением интенсивности аутофагии (Lakkaraju et al., 2007). В свою очередь, нарушение лизосомальной деградации, вызвано избыточным накоплением ЛФ (Brandstetter et al., 2016). Структурно-метаболические и генетические нарушения клеток РПЭ и соседних тканевых структур (сосудистой оболочки, мембраны Бруха, фоторецепторов) приводят к накоплению токсичных компонентов, что создает риск нарушения окислительно-восстановительного баланса (Godley et al., 2005). Окислительно-восстановительное равновесие в клетках РПЭ во многом зависит от аутофагического клиренса, который является основой защиты от окислительного повреждения и от накопления дефектных белков (Mitter et al., 2012). В условиях ОС, воспаления и гипоксии в клетках РПЭ происходит нарушение регуляции между процессами образования аутофагосом и деградацией их содержимого в лизосомах.
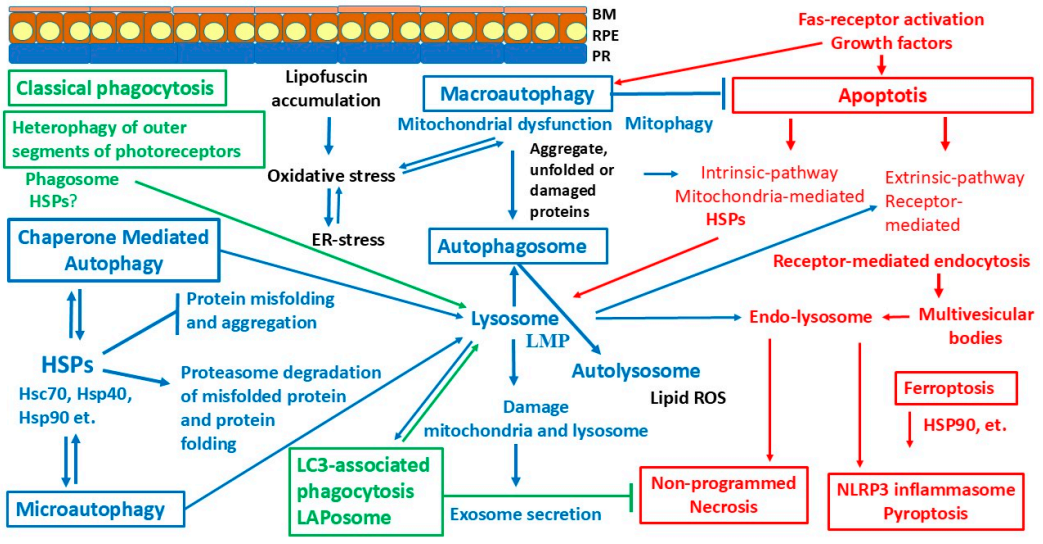
Система защиты шаперонов, белков теплового шока в РПЭ. Белки теплового шока (БТШ) являются наиболее распространённой и изученной группой шаперонов. Клетки конститутивно экспрессируют многие типы БТШ. Они подразделяются на несколько семейств, в зависимости от их молекулярного размера, структуры и функций: малые БТШ (HSPB), HSP40 (DNAJ), HSP60/HSP10 (HSPD/E), HSP70 (HSPA), HSP90 (HSPC) и HSP100/110 (HSPH) (Kampinga et al., 2009). HSPs выполняют широкий спектр функций, участвуют в поддержании клеточного гомеостаза, дифференцировке (Szyller et al., 2021), стабилизации клеточных структур, фолдинге вновь синтезированных пептидов в зрелую форму белка, ре-фолдинге неправильно свернутых белков (Amirkavei et al., 2022), транспорте белков в субклеточные компартменты (Penke et al., 2018). ОС в РПЭ вызывает активацию редокс-зависимых антиоксидантов, шаперонов DJ-1 и альфа-1-микроглобулина. Последний может напрямую связывать и нейтрализовать АФК (Bergwik et al., 2021). αA-кристаллин через сигнальный путь PI3K/Akt обеспечивает устойчивость клеток РПЭ к действию ОС. αB-кристаллин регулирует экспрессию Atg7, медиатора биогенеза аутофагосом (Pattison, Robbins, 2011). αB-кристаллин защищает белки от агрегации и конформационных изменений, а также стимулирует продукцию фактора роста эндотелия сосудов (VEGF), в ответ на воспаление. Hsp110 и Hsp70 выполняют функции цитопротекторов. HSP110 участвует в протеолизе α-синуклеина и/или предотвращении связанной с ним нейродегенерации (Polier et al., 2008). HSP90 необходим для восстановления функций неправильно свёрнутых и денатурированных белков, транспорта дефектных белков для протеолитической деградации (Prodromou, 2016). HSP27 взаимодействует с актиновыми филаментами, участвует в программируемой клеточной смерти (апоптозе) и важен для выживания клеток в условиях стресса (Zou et al., 2023). Схематичное изображение путей деградации в клетках РПЭ и участие БТШ в фагоцитозе, разных типах аутофагии и клеточной гибели представлено на рисунке 2.
Рисунок 2. Пути деградации в клетках РПЭ и связанные с ними процессы обозначены стрелками с соответствующими цветами: типы фагоцитоза (зеленый), типы аутофагии (синий) и формы клеточной смерти (красный). Сокращения: RPE – ретинальный пигментный эпителий; ROS – активные формы кислорода; ER – эндоплазматический ретикулум; LMP – пермеабилизация мембраны лизосом; LAP – LC3-ассоциированный фагоцитоз; HSPs – белки теплового шока
Система аутофагии и протеолиза. В клетках эукариот хорошо скоординированные системы отвечают за деградацию дефектных или избыточных белков: (1) убиквитин-протеасомная система (UPS), которая расщепляет большинство нормальных и аномальных внутриклеточных белков; (2) митохондриальные протеазы, которые расщепляют митохондриальные белки; (3) кальций-активируемые кальпаины и некоторые мембрана-ассоциированные ферменты, которые расщепляют белки цитоскелета и мембранные белки; (4) лизосомальная аутофагия, с помощью которой расщепляются клеточные органеллы, мембранные белки и эндоцитозные белки. Эти системы контролируют качество митохондрий и продукцию АФК в условиях нормального функционирования и обеспечивают антиоксидантную защиту клеток РПЭ в условиях ОС (Klaips et al., 2018).
Фагоцитоз. В клетках РПЭ кристаллин CRYBA1/βA3/A1 находится в лизосомах, где он влияет на активность V-АТФазы лизосом, взаимодействие которых с mTORC1 необходимо для регуляции аутофагии (Valapala et al., 2014). Шаперонин-содержащий комплекс TCP-1 (CCT), необходим для эффективной сборки актиновых миофиламентов. Связывание АТФ, с субъединицей CCT5 необходимо для эффективного сворачивания белков актина, биогенеза лизосом через актиновый цитоскелет. Шаперон Mesdc2 локализованный в ЭР облегчает сворачивание белков, связанных с рецепторами липопротеинов низкой плотности (LRP). Mesd может высвобождаться при слущивании фрагментов НСФ и стимулировать их фагоцитоз путем связывания клеток РПЭ с фагосомами (Chen et al., 2016).
LC3-ассоциированный фагоцитоз. В РПЭ описан тип фагоцитоза наружных сегментов фоторецепторов (гетерофагия), ассоциированный с микротрубочками белка 1 LC3B и макроаутофагией. Этот гибридный путь деградации фагоцитированных фрагментов НСФ, сочетающий аутофагию и фагоцитоз, называется фагоцитозом, ассоциированным с LC3 (LAP) (Frost et al., 2015). Процесс происходит с формированием аутофагосом, и включает фазы инициации и элонгации, во время которых формируется изолирующая мембрана аутофагосомы. Дальше происходит слияние аутофагосомы с лизосомами, во время фазы деградации захваченного материала. Все этапы процесса, от инициации до формирования аутофагосомы и её слияния с лизосомой, регулируются белками семейства ATG, участвующими в процессе аутофагии (Ktistakis et al., 2016). LAP поддерживает метаболизм ретиноидов и зрительный цикл, регулирует липидный гомеостаз и синтез противовоспалительных липидов (Dhingra et al., 2018). В этом процессе принимают участие специфические адаптерные белки, которые связывают LC3 и направляют материал, подлежащий деградации, в лизосомы. Одним из таких белков является меланорегулин, специфичный для фагосом. LAP и макроаутофагия зависят от липидизации LC3 до LC3II, что обеспечивает его мембранную связь с двух мембранными аутофагосомами при аутофагии, или одно мембранными фагосомами при LAP. Фермент, подобный E3, обеспечивает перенос фосфатидилэтаноламина (PE) в LC3. Липидизация LC3 включает взаимодействие с комплексом Atg5-12 и Atg16L и белком Beclin1. Комплекс необходим для связывания липидированной формы LC3 с фагосомой, транспортировки НСФ в лизосомальный компартмент для деградации. Значительная часть белков НСФ убиквитинирована и, как следствие, может быть включена в фагосомы, имеющие рецепторы LC3B, меланорегулин или SQSTM1. При этом, только часть POS в фагосоме деградирует под действием LAP. Однако, состав комплекса PI3K, состоящего из субъединиц, участвующих в LAP, отличается от состава комплекса, участвующего в аутофагии. Комплекс LAP содержит белок RUN-домена Rubicon, взаимодействующий с Beclin 1 (Martinez et al., 2015). Клетки РПЭ используют Rubicon, подобно макрофагам, для стимуляции LAP и эффективной деградации фагоцитированного материала клетки. В условиях ОС, в клетках РПЭ снижается LAP фагоцитарная деградация и активируется аутофагия, где ведущую роль принадлежит Atg14 (Muniz-Feliciano et al., 2017).
Аутофагия. В соответствии с современными данными, аутофагия подразделяется на три типа: микроаутофагия, макроаутофагия и шаперон-зависимая аутофагия. У млекопитающих эти три основных пути аутофагии используют механизмы лизосомальной деградации субстратов. Макроаутофагия включает образование аутофагосом – двух мембранных везикул – для транспортировки субстратов в лизосомы для деградации. При шаперон-опосредованной аутофагии деградация субстрата в лизосомах регулируется взаимодействием мембранного рецептора лизосом LAMP2 и шаперона Hsc70 (Morel et al., 1017).
Аутофагия, опосредованная шаперонами (Chaperone-Mediated Autophagy, CMA). CMA активируется при ОС, длительном недостатке питательных веществ или воздействии токсичных веществ, и не требует формирования везикул или серьезной реорганизации лизосомальной мембраны. Эта форма аутофагии обеспечивает направленный транспорт частично денатурировавших белков из цитоплазмы в лизосомы, при участии цитоплазматических белков-шаперонов семейства hsp-70 (heat shock protein 70), вспомогательных белков и LAMP-2 (lysosome-associated membrane protein type 2A). В CMA участвует комплекс белков шаперонов (Hsp70, Hsp40, Hsp90), которые связывают в цитозоле субстратные белки, имеющие специфическую метку KFERQ and транспортируют их через канал, сформированный трансмембранными белками LAMP-2A в полость лизосомы, где они расщепляются ферментами лизосом (Majeski et al., 2004). Существует группа белков-шаперонов, которые взаимодействуют с HSC70 и регулируют его активность, а также могут сами выступать в качестве шаперонов. К ним относятся белок теплового шока 40 (HSP40), стимулирующий АТФазную активность HSC70; белок, взаимодействующий с HSC70 (HIP), стимулирующий сборку комплекса; организующий белок HSC70–HSP90 (HOP), связывающий шапероны HSC70–HSP90. Первая точка регуляции CMA образована целевыми белками, которые становятся более доступными после окисления. Это отчасти связано с тем, что окисленные белки легче разворачиваются, что необходимо для их транспортировки через лизосомальную мембрану. Другой точкой регуляции CMA является LAMP2A. Окисление субстратных белков повышает активность лизосом в CMA за счёт повышения уровня LAMP-2A в лизосомальной мембране и HSC70 в просвете лизосом (Kiffin et al., 2004). Лизосомальная форма Hsp90 (Lys-Hsp90) участвует в поддержании стабильности LAMP2A, в то время как Lys-Hsc70 индуцирует разборку и сборку LAMP2A для нового цикла. CMA при воздействии ОС опосредована генерацией АФК митохондриями и активацией антиоксидантного фактора транскрипции Nrf2. У млекопитающих NRF2 выполняет роль позитивного регулятора CMA, посредством связывания с регуляторными элементами гена LAMP2 и усиления его транскрипции (Pajares et al., 2018). В то же время, передача сигналов, опосредованная RARα (рецепторы ретиноевой кислоты-α), негативно регулирует транскрипцию компонентов CMA, включая LAMP2A (Anguiano et al., 2013). Регуляция активности CMA, динамика сборки и разборки транслокационного комплекса CMA на мембране лизосом осуществляется под контролем сигнальных путей, с участием киназ Akt и TORC2. Выявлена роль лизосома-ассоциированной формы GFAP (глиального фибриллярного кислого белка) в стабилизации данного мультимерного транслокационного комплекса, в ответ на ОС (Arias et al., 2010).
Микроаутофагия — это катаболический процесс, при котором дисфункциональные или избыточно продуцируемые белки и органеллы доставляются непосредственно в эндосомы или лизосомы (Fleming et al., 2022). Все пути микроаутофагии у млекопитающих в конечном итоге направляют субстратные белки в эндосомы/мультивезикулярные тельца (LE/MVB) (Krause, Cuervo, 2021). Этот процесс во многом зависит от комплексов сортировки эндосом, систем транспорта (ESCRT) I и III, и белка-шаперона hsc70. Деградация цитозольных белков в LE/MVB во время эндосомальной микроаутофагии, как и в случае CMA, может потребовать распознавания специфичного мотива, подобного KFERQ белками шаперонами HSC70 (Kirchner et al., 2019). HSC70 связывается с фосфатидилсерином на мембране LE/MVB, запуская интернализацию субстрата в просвет эндосомы, путем инвагинации мембраны, ESCRT-зависимым образом. Деградация белка-субстрата может происходить в полости LE/MVB, хотя деградация основной части белка-субстрата происходит после слияния LE/MVB с лизосомой (Morozova et al., 2016).
Программируемая клеточная гибель и шапероны. Регуляция выживания клеток и их гибели находится под строгим контролем в процессе развития эукариот и гомеостаза тканей. В нормальных физиологических условиях эндогенные защитные системы поддерживают клеточный гомеостаз, а в условиях стресса они могут активировать разные типы запрограммированной клеточной гибели (Рисунок 2; таблица 1). Регулируемая гибель клеток (ПГК) включает множество субпрограмм, выполнение которых приводит к различным морфологическим изменениям. Гибель клеток РПЭ происходит путем апоптоза, некроза, пироптоза и ферроптоза в условиях клеточного стресса, процессе старения и патологии (Newton et al., 2024).
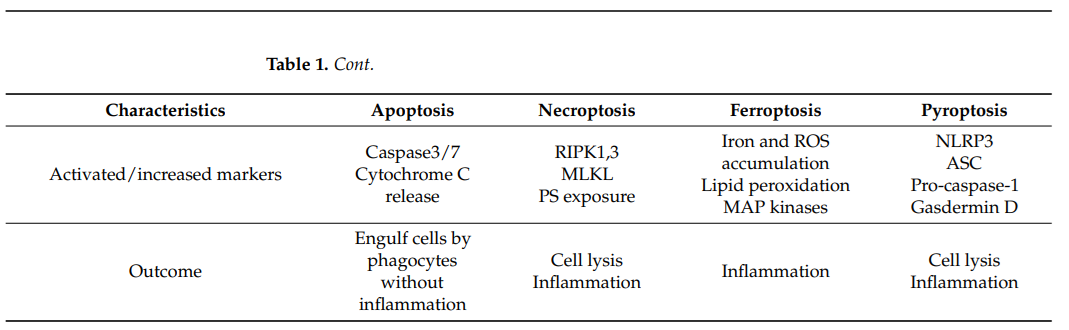
Сокращения: ASC – апоптоз-ассоциированный Speck-подобный белок, содержащий С-концевой домен рекрутирования каспазы, CARD; MLKL – киназный домен смешанной линии, подобный псевдокиназе; NLRP3 – инфламмасома (криопирин); PS – фосфатидилсерин; RIPK – Рецептор-взаимодействующая серин/треонин-протеинкиназа 1
Апоптоз. Развитие апоптоза связано с подавлением роста и деления клетки, что приводит к контролируемой гибели клетки без утечки её содержимого в окружающую среду. Повреждение клеток активирует инициаторные каспазы (каспазы 8 и 9), которые запускают эффекторные каспазы (каспазы 3, 6 и 7). Апоптоз приводит к фрагментации ДНК и ядра, разрушению цитоскелета и образованию апоптотических телец. Этот процесс может запускаться как внутренними, так и внешними сигнальными путями. Внутренний путь, зависящий от ОС, связан с дисфункцией митохондрий и зависит от факторов, секретируемых митохондриями (Elmore, 2007). Внешний путь апоптоза активируется после связывания TNF1 с Fas-рецепторами смерти. Цепочка реакций затем активирует каспазу-8, которая индуцирует апоптоз, управляемый каспазой-3. Транслокация Bax в митохондрии опосредована сигналами от N-концевых киназ c-Jun и митоген-активируемой протеинкиназы p38 в OS (Gomez-Lazaro et al., 2007). Члены семейства sHSP αA- и αB-кристаллинов, конститутивно экспрессирующиеся в клетках РПЭ, могут функционировать как антиапоптотические белки, индуцируемые во время ОС. αB-кристаллин напрямую взаимодействует с проапоптотическими факторами, членами семейства Bax и Bcl-XS и P53, при этом секвестрация этих белков предотвращает их транслокацию в митохондрии и, следовательно, подавляет апоптоз, либо ингибирует активацию каспазы-3. Известно, что p53 участвует в инициации кальций-активируемого сигнального пути апоптоза RAF/MEK/ERK, который может быть подавлен αB-кристаллином путем ингибирования RAS (Li et al, 2005). В условиях ОС в клетках РПЭ активируется АТФ-независимый шаперон HspB1, одна из функций которого заключаются в блокировании сигнальных путей, запускающих каспазо-зависимый апоптоз. Эти события сопровождаются блокированием внешнего рецептор-зависимого пути клеточной гибели, опосредованного рецепторами фактора некроза опухоли, и внутреннего митохондриального сигнального пути. Затем, после частичного восстановления клеток РПЭ, активируется АТФ-зависимый шаперон HSP70 (O’Reilly et al., 2010). Hsp70 ингибирует образование функциональной апоптосомы, взаимодействуя с Apaf-1. Hsp70 защищает от форсированного деструктивного действия каспазы-3 и предотвращает транслокацию Bax из цитоплазмы в митохондрии (Ryhanen et al., 2010). Hsp90 может предотвращать образование комплекса апоптосомы, ингибируя олигомеризацию Apaf-1. Низкомолекулярный шаперон Hsp27 способен поддерживать стабильность митохондрий и окислительно-восстановительный гомеостаз клеток, взаимодействуя с апоптотическими сигнальными путями на многих этапах. Его активация приводит к блокированию апоптоза, подавляя каспазу-3 и предотвращая высвобождение в цитоплазму цитохрома C из Bcl-xS. HSP27 также стабилизирует активность Akt (RAC-alpha serine/threonine-protein kinase), участвующей в сигнальном пути I3KAktmTOR, блокирующем аутофагию (Nahomi et al., 2014). Ингибирование пути PI3K–Akt–mTOR, является одним из терапевтических подходов активации аутофагии и антиоксидантной защиты в клетках РПЭ человека. Помимо БТШ известны их ко-шапероны с антиапоптотическими функциями, такие как представители семейств антаногенов (BAG) и кластеринов (Clu), ассоциированных с Bcl-2. Так, для белков BAG доказана цитопротекторная функция, связанная с индукцией аутофагии (Gureev et al., 2020).
Некроптоз (регулируемый некроз). В РПЭ основными характеристиками некроза в условиях ОС являются истощение АТФ, агрегация протеинкиназы RIPK3 (Receptor Interacting Serine Threonine Kinase 3 (RIPK3), набухание клеток и потеря целостности клеточной мембраны. Некроз активируется избыточной продукцией провоспалительных факторов, что приводит к возрастанию проницаемости клеток и разрушению клеточной мембраны. Некротический путь инициируется связыванием TNF (tumor necrosis factor) с рецепторами смерти на клеточной мембране, что контролируется RIP (рецептор-взаимодействующими протеинкиназами). Некроптоз рассматривается как регулируемый некроз, зависящий от белков RIPK3 и MLKL (домен киназы смешанного типа, Mixed Lineage Kinase Domain Like Pseudokinase). Аутофосфорилирование RIPK1 и RIPK3 приводит к образованию некросом, ассоциированных с дисфункцией митохондрий, что приводит к гибели клетки (Hanus et al., 2013). Интересно, что некроптоз, опосредованный RIP, становится преобладающей формой клеточной смерти после ингибирования каспазы 8 и FADD (Fas-associated Protein via Death Domain). Активность каспазы-8 может подавлять этот тип клеточной гибели, расщепляя RIPK1 и RIPK3 (Fritsch et al., 2019). Предполагается, что при патологиях сетчатки некроптоз может служить резервным механизмом, наряду с апоптозом. Ингибирование HSP90 CDDO (синтетическим тритерпеноидом, 2-циано-3,12-диоксоолеан-1,9-диен-28-овой кислотой) ингибирует активность киназы RIPK1 и блокирует некроптоз (Wu et al., 2019).
Пироптоз — это воспалительная форма клеточной гибели, связанная с дестабилизацией лизосом, осуществляемая газдерминами (GSDM), семейством трансмембранных порообразующих белков, активируемых инфламмасома зависимыми или инфламмасома независимыми путями. Инфламмасома NLRP3 является центральным регулятором воспаления, и ее активация связана с несколькими возрастными заболеваниями, такими как ВМД, ДР, увеит и другие (Sun et al., 2024). Инфламмасомы содержат пириновые домены семейства NOD-подобных рецепторов, которые участвуют в инициации гибели иммунных клеток путем активации путей апоптоза или пироптоза (caspase-1-dependent pathway) в клетках РПЭ (Liao et al., 2019). Процесс инициируется связыванием инфламмасом с белками семейства NOD-рецепторов (NLPR1, NLPR3, NLPR4), что приводит к активации каспазы-1, которая расщепляет гасдермин D, с образованием N-концевого фрагмента, индуцирующего гибель клетки. В результате происходит активация апоптоз-ассоциированного адаптерного белка ASC (PYCARD), необходимого для сборки инфламмасомы. Пироптоз также может активироваться независимо от каспазы-1. В этом случае, в РПЭ у человека активируется каспаза-4/5, а у мыши каспаза-11, которые расщепляют гасдермин D, активируя путь пироптоза. HSP90 через P2X7 действует как стабилизатор (Zuo et al., 2018), а HSP70 – как негативный регулятор формирования инфламмасомы NLRP3 (Martine et al., 2019).
Ферроптоз. Основными метаболическими механизмами ферроптоза являются перекисное окисление липидов (LPO) и нарушение гомеостаза железа. Эта форма гибели характерна для клеток РПЭ благодаря их активному участию в фагоцитозе НСФ, которые являются основным источником внутриклеточных АФК и полиненасыщенных жирных кислот. Ферроптоз – основной процесс гибели клеток РПЭ, при дегенеративных патологиях, опосредованных ОС, таких как ВМД, ДР (Malaviya et al., 2024). Аутофагия регулирует ферроптоз, поддерживая клеточный гомеостаз железа и ингибируя продукцию АФК в клетках. В последнее время широко изучается участие шаперонов в индукции и регуляции ферроптоза (Liu et al.,2022). Семейство HSP90 опосредует деградацию Gpx4, подавляя активность GPX4 (глутатионпероксидазы 4). HSP90 через путь GSH/GPX4 ингибирует LPO, тем самым подавляя ферроптоз. Шаперон HSPA5 также через регуляцию активности GPX4 нейтрализует LPO, индуцированное DHA (docosahexaenoic acid), защищая клетки от ферроптоза (Chen et al., 2021). Другой член семейства шаперонов, HSPB1, является негативным регулятором накопления и поглощения железа, повышающим чувствительность клеток к ферроптозу (Chen et al., 2006).
Внеклеточные везикулы и шапероны. Внеклеточные везикулы (ВВ) играют важную роль во взаимодействии РПЭ с соседними тканями. Они представляют собой гетерогенную группу внеклеточных частиц, ограниченных липидным бислоем. Существует ряд подтипов ВВ (в частности, экзосомы, которые являются разновидностью малых ВВ). Совокупность данных, представленных в недавнем обзоре, подчеркивает ключевую роль ВВ в возникновении и прогрессировании дегенеративных заболеваний сетчатки (ВМД, ДР) (Martins et al., 2024). Внеклеточные микрочастицы в условиях ОС могут способствовать клеточному старению, нарушают фагоцитарную активность РПЭ, что приводит к дегенерации клеток РПЭ и сетчатки. ВВ несут РНК, липиды и белки теплового шока (Welsh et al., 2024). Экзосомы также могут играть нейропротекторную роль для фоторецепторов, подавлять нейровоспалительные реакции (Knickelbein et al., 2016). В экзосомах, высвобождаемых с апикальной поверхности клеток РПЭ, обнаружены αB-кристаллины, которые обеспечивают нейропротекцию фоторецепторных клеток, ингибируют образования β-амилоидных фибрилл. Предполагается, что αB-кристаллины контролируют слияние мультивезикулярных телец с плазматической мембраной и высвобождение содержимого экзосом (Gangalum et al., 2016).
Заключение. Современный арсенал стратегий нейропротекции включает антиоксидантную и противовоспалительную терапию, направленную на снижение в клетках РПЭ ОС, обычно сопровождающегося воспалительными процессами, и его последствий. Эти стратегии направлены на предотвращение гибели клеток, регуляцию аутофагии, активацию в РПЭ фагоцитоза, антиоксидантной защиты и уменьшение как ОС, так и митохондриальной и лизосомальной дисфункции, которые являются основными причинами дисфункции РПЭ, приводящей к гибели клеток сетчатки (Viiri et al., 2013; Terluk et al., 2015; Markitantova, Simirskii, 2023). К примеру, с применением фотобиомодуляторов, удается разрушать друзы при ВМД, активируя фагоцитоз РПЭ. Анализ данных, накопленных на модели РПЭ, показывает, что аутофагия включает множество механизмов, которые используют различные пути для поддержания клеточного гомеостаза и адаптации к условиям стресса, для регуляции иммунных и воспалительных процессов. Эти данные демонстрируют гораздо более специфичную эндогенную селективность аутофагии в отношении внутриклеточной деградации и удаления разрушенных компонентов, таких как митохондрии (митофагия), эндоплазматический ретикулум (ЭР-фагия), пероксисомы (пексофагия), липосомы (липофагия) и агрегированные белки (агрегофагия). Важно подчеркнуть, что клеточная гибель в РПЭ и фоторецепторах сетчатки может встречаться как в «чистой» форме, так и в смешанных вариантах, в которых возможна реализация различных летальных субпрограмм, действующих параллельно, либо по типу иерархического каскада. Обсуждается роль аутофагии, как переключателя между запрограммированной и незапрограммированной клеточной гибелью. Несмотря на перспективность терапевтических подходов, направленных на модуляцию процессов аутофагии при заболеваниях, связанных с дегенерацией РПЭ (Fernandez-Albarral et al., 2021), фармакологические препараты, воздействующие на разные звенья аутофагии, характеризуются низкой эффективностью, в виду участия молекулярных мишеней во множественных сигнальных путях. В связи с вышесказанным, воздействие на молекулярные мишени аутофагии, путем блокирования продукции АФК или активации компонентов эндогенной защиты, в частности, белков шаперонов, требует знания того, как нужно точно настроить их участие в регуляции жизненно важных функций РПЭ, что ставит задачи более детального изучения механизмов клеточного гомеостаза.
Новость подготовили
Ю.В. Маркитантова, В.Н. Симирский
10.08.2025