 © Михайлов Виктор Сергеевич,
лаборатория биохимии процессов онтогенеза, доктор биологических наук, профессор, главный научный сотрудник ИБР РАН
© Михайлов Виктор Сергеевич,
лаборатория биохимии процессов онтогенеза, доктор биологических наук, профессор, главный научный сотрудник ИБР РАН
Область научных интересов: репликация ДНК, регуляция протеома клеток, макромолекулярные синтезы в раннем развитии, репродукция вирусов.
Острая лейкемия является неизлечимым злокачественным заболеванием клеток крови, быстро приводящим к смерти пациентов в случае наиболее агрессивных форм (выживание не превышает 27% в течение 5-летнего периода). Различают острую лимфобластическую лейкемию (ALL) и острую миелоидную лейкемию (AML). Известно, что болезнь вызывается хромосомными транслокациями, в результате которых ген MLL (метилтрансфераза гистона Н3К4) сливается с одним из более сотни рекомбинационных партнеров, наиболее частыми из которых являются гены MLLT1-ENL, MLLT2-AFF1-AF4, and MLLT3-AF9, которые совместно образуют в геноме MLL рекомбином. Транслокационные события внутри MLL рекомбинома обуславливают геномную нестабильность лейкемических клеток, приводящую к злокачественной трансформации. В статье многочисленной группы исследователей (всего 29 соавторов) из 13 научных организаций в Австралии показано, в геномных перестройках в MLL рекомбиноме ключевую роль играют кольцевые РНК (circRNA), диаминазы семейства APOBEC, факторы гомологичной рекомбинации и протеасомы. Кольцевые РНК (кРНК) представляют собой молекулы однонитевой ковалентно замкнутой РНК, которые образуются в ходе транскрипции в результате неканонического сплайсинга пре-мРНК и формируют в геномной ДНК петлю смещения кР-петлю (circR-loop) (Рис. 1).
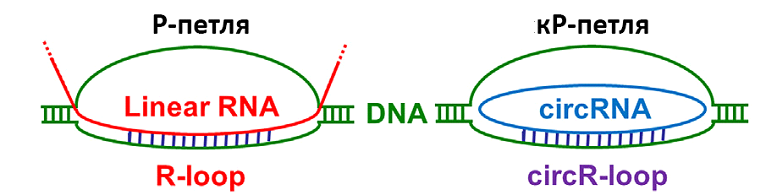
Рис. 1. Схематическое изображение петель в геноме с линейной РНК (Р-петля) и кольцевой РНК (кР-петля).
Р-петли смещения с линейным фрагментом мРНК в геноме являются обычным интермедиатом в процессе транскрипции. Они могут быть зафиксированы в случае остановки транскрипции на участках ДНК-матрицы с препятствиями или модификациями, но время существования петель с линейной РНК относительно невелико. Они удаляются из генома в среднем за 10-20 мин. Петли с кРНК существенно более стабильны, т.к. кольцевая РНК устойчива к действию экзонуклеаз, гидролизующих РНК с 5’- или 3’-концов, и оказывают большее влияние на структурные перестройки в геноме. В клетках лейкемии кР-петли составляют около 6% от общего числа Р-петель. Особенностью этих клеток является значительно увеличенное число кР-петель в МLL локусах. Это согласуется с повышенным уровнем экспрессии кРНК в MLL рекомбиноме. Значительным онкогенным потенциалом обладает кРНК, образованная слиянием экзонов 9 и 10 гена МLL - circMLL(9,10). Эта кРНК экспрессируется более чем на 2 порядка сильнее в лейкемических клетках, чем в контрольных (рис. 2).
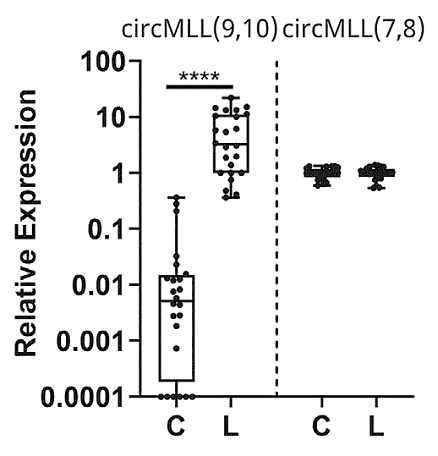
Рис. 2. Повышенная экспрессия кРНК circMLL(9,10) в клетках больных лейкемией (L) по сравнению с здоровыми донорами (С). circMLL(7,8) использована в качестве контроля. Представлены результаты qRT-PCR.
Стабильная кР-петля является эффективным блокатором элонгации мРНК в ходе транскрипции, вызывая «паузирование» (торможение) транскрипционного комплекса с РНК-полимеразой II в месте петли. Процесс удаления «замороженных» транскрипционных комплексов из генома довольно сложен и приводит в конечном счете к появлению двухнитевых разрывов в геномной ДНК и активации репарации генома по механизму гомологичной рекомбинации. В формировании двухнитевого разрыва участвуют в том числе диаминазы семейства APOBEC, которые превращают цитозины в урацилы и активируют гидролитическую активность ферментов типа РНКазы Н (RNase H). Ключевую роль в удалении «замороженных» транскрипционных комплексов из генома играют компоненты убиквитин-протеасомной системы гидролиза белков и сами протеасомы, которые рекрутируются к местам двухнитевых разрывов. 26S и 20S протеасомы являются мультисубъединичными протеазами, которые ответственны за гидролиз большей части клеточных белков и осуществляют количественный и качественный контроль клеточного протеома. Активность протеасом регулируется многочисленными факторами убиквитин-протеасомной системы, обеспечивающими выбор и маркировку (убиквитинирование) белков для гидролиза, доставку белков к протеасомам (сегрегазы, транспортные факторы и пр.) и протеолитическую активность самих протесом. Неожиданным и важным наблюдением авторов статьи является демонстрация того, что группа кРНК из MLL рекомбинома участвует в регуляции протеолитической активности протеасом. С помощью иммунопреципитации и масс-спектрометрии показано, что молекулы кРНК MML(9,10) связываются с различными некаталитическими субъединицами протеасом и регулируют протеолитическую активность протеасом. 20S протеасома самостоятельно осуществляет гидролиз белков, а также является каталитическим ядром комплекса 26S. На рис. 3 схематически показана структура 20S протеасомы и выделены красным цветом субъединицы, с которыми взаимодействуют кРНК MML(9,10).
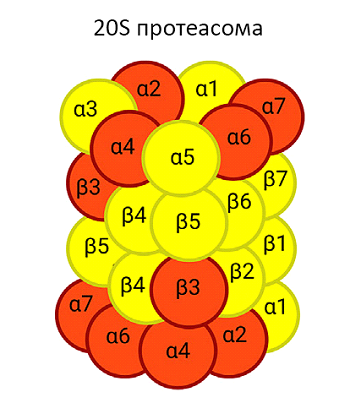
Рис. 3. Схематическое изображение 20S протеасомы с указанием α- и β-субъединиц, связывающих кРНК MML(9,10) (красный цвет).
Оказалось, что связывание кРНК MML(9,10) специфично подавляет химотрипсин-подобную активность протеасомы, и не влияет на каспаза-подобную и трипсин-подобную активность. Важно, что ингибирующий эффект оказался специфичным для кРНК MML(9,10), т.к. контрольные кРНК не связываются с протеасомой и не ингибируют ее активность. Таким образом, экспрессия кРНК MML приводит к пониженной протеасомной активности в злокачественных клетках больных острой лейкемией. На первый взгляд этот результат выглядит парадоксальным и противоречащим литературным данным. Известно, что протеасомная активность снижается в стареющих клетках, однако ее высокий уровень важен для подавления избыточного мутагенеза в злокачественных клетках и обеспечения их длительной пролиферации. Авторы полагают, что в незлокачественных клетках «замороженные» транскрипционные комплексы удаляются из генома с участием протеасомной системы довольно эффективно без значительной индукции двухнитевых разрывов и последующей активации репарации путем гомологичной рекомбинации. Пониженная протеасомная активность в клетках больных лейкемией в сочетании с высокой частотой кРНК-петель в пределах MLL рекомбинома проявляется в неэффективном удалении «замороженных» транскрипционных комплексов в местах связывания кРНК MML, и как следствие, в повышенной индукции двухнитевых разрывов в геноме и повышенном уровне гомологичной рекомбинации. Известно, что гомологичная рекомбинация, индуцированная в участках генома богатых повторами, сопровождается многочисленными хромосомными транслокациями. Такой же механизм, по-видимому, обуславливает нестабильность генома и частые транслокации в пределах MLL рекомбинома в клетках больных острой лейкемией. В подтверждение своих представлений авторы ссылаются на литературные данные, показавшие двукратное снижение экспрессии протеасомных субъединиц у больных с лейкемией прежде проявления симптомов болезни, и плохой прогноз для выживания пациентов с низким уровнем протеасомной активности. В заключение авторы представили прямые доказательства патогенных качеств кРНК из MLL рекомбинома. Опыт по ксенотрансплантации в мышей клеток экспрессирующих кРНК из MLL рекомбинома показал появление в них гистологических признаков развития лейкозов и значительное сокращение продолжительности жизни мышей из опытных групп по сравнению с контрольной группой (Рис. 4).
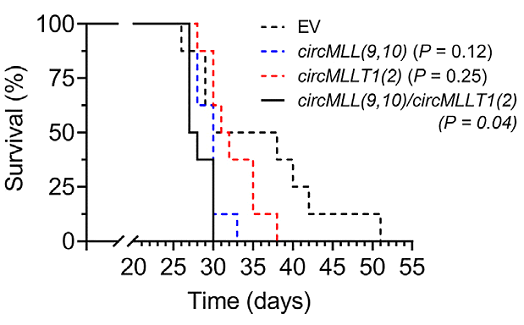
Рис. 4. Продолжительность жизни мышей после ксенотрансплантации клеток HL-60, экспрессирующих кРНК из MLL рекомбинома: EV – пустой вектор, вектор circMLL(9,10), вектор circMLLТ1(2) и вектор circMLL(9,10) + circMLLТ1(2). Группы мышей по 8 особей. Результаты представлены в виде Kaplan-Meier плота.
Таким образом, коллективу ученых из Австралии удалось выяснить молекулярный механизм возникновения острых лейкозов у человека и впервые показать важную роль кольцевых РНК и протеасом в генных транслокациях и хромосомных перестройках, приводящих к этим патологиям. В ближайшие годы следует ожидать появление работ с детальным описанием отдельных этапов в развитии этих патологий и долгожданным появлением терапевтических возможностей для борьбы с острыми лейкозами. Мир РНК структурно и функционально разнообразен. Линейные некодирующие и миниРНК вносят значительный вклад в регуляцию внутриклеточных процессов. Кольцевые РНК существенно повышают регуляторный потенциал РНК.
Новость подготовил
© Михайлов В.C.
10.07.2023