 © Дашинимаев Эрдем Баирович
научный сотрудник лаборатории клеточной биологии, кандидат биологических наук.
© Дашинимаев Эрдем Баирович
научный сотрудник лаборатории клеточной биологии, кандидат биологических наук.
В апреле 2016 г в журнале Assist Reprod Genet была опубликована электронная версия статьи «Introducing precise genetic modifications into human 3PN embryos by CRISPR/Cas-mediated genome editing» группы исследователей под руководством Yong Fan, и выполненной в медицинском университете города Guangzhou, в Китае.
Данная статья является уже второй опубликованной научной работой по редактированию генома, выполненной на человеческих эмбрионах с тремя пронуклеусами (3PN-эмбрионы). Напомню, что такие эмбрионы получаются чаще всего в результате одновременного проникновения двух сперматозоидов в яйцеклетку, содержат три набора хромосом вместо двух, и отбраковываются в клиниках искусственного оплодотворения, поскольку неспособны дать начало живому организму. Обычно такие эмбрионы делятся 3-5 дней, доходя до стадии морулы и на этом их путь прекращается. Читатели, следящие за данной тематикой, отлично помнят первую нашумевшую статью такого рода, выполненную другой группой китайских исследователей. (Liang P, Xu Y, Zhang X et al. CRISPR/Cas9-mediated gene editing in human tripronuclear zygotes. Protein Cell. 2015 May; 6(5):363-72.). Тогда, авторы исследования пришли к общему выводу о том, что несмотря на то, что система CRISPR-Cas9 в целом работает на геноме человеческого эмбриона, однако ее эффективность и существующие методы не позволяют редактировать геном с необходимой степенью точности и предсказуемости. Исследователи отметили низкую эффективность нужных вставок, высокую вероятность нежелательных мутаций и значительную нецелевую активность cистемы (off-target effects).
В рассматриваемой сейчас работе коллектив под руководством Young Fan решил также проверить «proof-of-principle» эффективность системы CRISPR-Cas9 на человеческих эмбрионах. В качестве экспериментального материала были выбраны также 3PN эмбрионы, полученные в результате in vitro фертилизации, но, содержащие три пронуклеуса вместо двух. Объектом сосредоточения усилий исследования стал ген CCR5, а именно его 4-й экзон, в котором иногда встречается редкая мутация, называемая CCR5Δ32 аллель и заключающаяся в делеции 32 нуклеотидов, что ведет к сдвигу рамки считывания и нокауту гена CCR5. Люди гомозиготные по CCR5Δ32 аллели резистентны к вирусу иммунодефицита человека, поскольку белок CCR5 является рецептором связывания ВИЧ к Т-лимфоциту. Предполагается, что данная мутация возникла 2,5 тысячи лет назад где-то в Северной Европе, поскольку наибольший процент встречаемости этой аллели наблюдается среди народов Скандинавского полуострова и севера европейской части России. Среди других этносов и рас, данной аллели выявлено не было, соответственно исследователи в Китае предположили, что работают с материалом, заведомо содержащим CCR5 «дикого типа».
Young Fan с коллегами решил проверить – а возможно ли, при помощи CRISPR-Cas9 внести необходимую мутацию CCR5Δ32 в человеческий геном, чтобы в перспективе получить организм резистентный к ВИЧ? Для этого ученые провели ряд экспериментов по инъекции в 3PN эмбрионы различных комбинаций генетических конструктов, с двумя видами гидовых РНК (написанных таким образом, чтобы фланкировать нужную делецию) (Рис.1А) и с тремя видами ДНК-доноров, которые при помощи гомологичной рекомбинации могли бы встроиться в геном и обеспечить нужную делецию. В дальнейшем эмбрионы культивировали до стадии 8-16 клеток (Рис.1B) и затем раздельно изучали каждый эмбрион при помощи сиквенса исследуемого участка гена CCR5, а также анализа сиквенсов участков с потенциальной off-target активностью. Исследователи пришли к следующим результатам:
- Сама система CRISPR-Cas9 почти не токсична для эмбрионов (64% инъецированных эмбрионов дошли до стадии 8-16 клеток, против 72% в случае инъекции воды). В данном случае, самой травматичной являлась сама процедура инъекции при помощи микрокапилляров.
- В результате работы CRISPR-Cas9 возникают множество мутаций в исследуемом участке гена (эффективность от 47 до 63%), чаще всего заключающиеся в делеции нескольких нуклеотидов (от 1 до 25), либо инсерции 1-2 нуклеотидов. Однако желаемая CCR5Δ32 делеция получается весьма редко (эффективность от 0 до 15%). В целом, авторам удалось получить только 6 таких эмбрионов из 171 проколотых эмбрионов, в которых они рассчитывали получить такую делецию. Лучшей стратегией оказалось использование одновременно двух гидовых РНК (gRNA1 и gRNA2, см. Рис.1А), без дополнительных донорских конструкций. Используя данную стратегию, удалось получить 4 нужных эмбриона из 26 дошедших до стадии 8-16 клеток.
- Из-за неспособности CRISPR-Cas9 работать на неактивном хроматине, в данной модели необходимые делеции и вставки могут происходить только в короткий циклически повторяющийся промежуток времени - во время участка репликации ДНК клеточного цикла. Это приводит к тому, что во всех 8-16 клеточных эмбрионах наблюдается сильный мозаицизм – в полученных шести эмбрионах, нужная делеция наблюдалась только в некоторых аллелях (от 17% до 76%). В остальных аллелях встречались как ненужные мутации (до 38%), так и нативные аллели «дикого типа» (до 73%).
- Авторы статьи проанализировали 28 локусов потенциальной off-target активности двух гидовых РНК системы CRISPR-Cas9 и не обнаружили ни одного случая нецелевого воздействия.
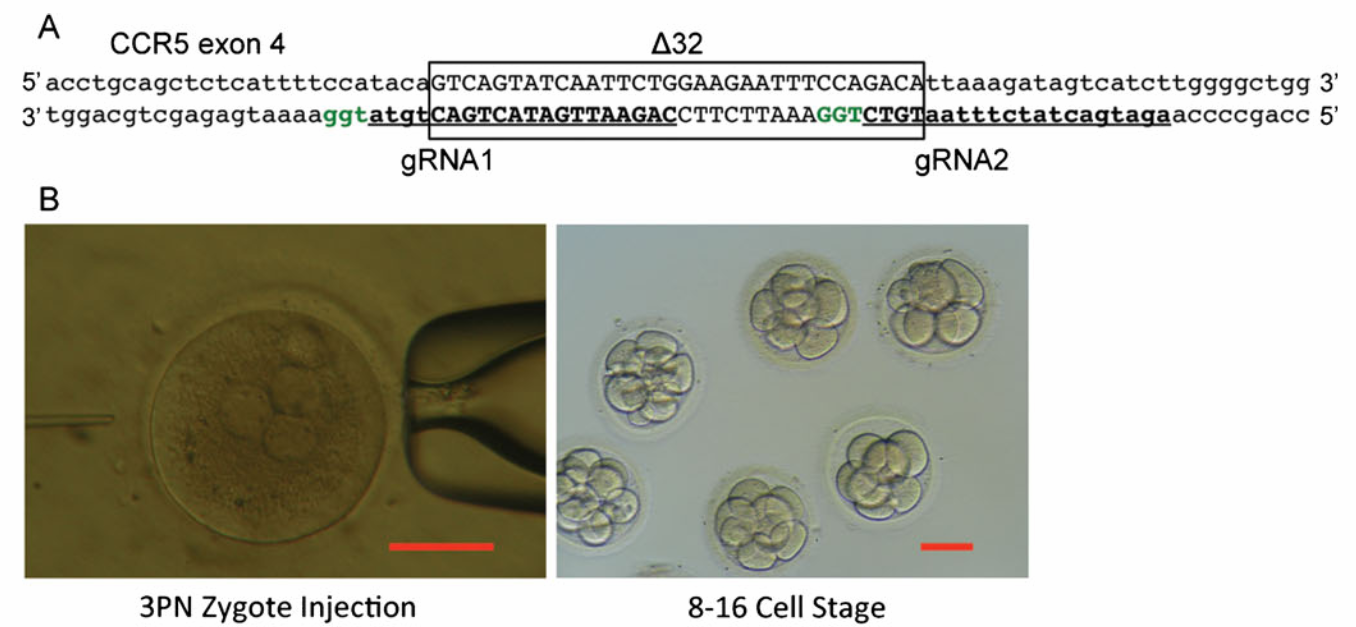 |
Рис.1
А – Схема редактирования участка экзона 4 гена CCR5. Делеция CCR5Δ32 выделена рамкой. Последовательности комплементарные гидовым РНК – выделены подчеркиванием. PAM-мотивы (GGT) – выделены зеленым цветом.
B – Репрезентативные фотографии инъекций в 3PN эмбрионы, и стадия развития таких эмбрионов в 8-16 клеток. Длина шкалы 100мкм.
Авторы делают вывод о том, что существующая в настоящий момент система редактирования генома CRISPR-Cas9, несмотря на все перспективность и удобство работы с ней, пока еще не в состоянии обеспечить необходимую степень точности при работе на эмбрионах человека.Среди самых больших препятствий можно назвать два: 1) большая вероятность нежелательных делеций и инсерций при двухцепочечном разрыве ДНК; 2) большая вероятность возникновения мозаицизма в эмбрионах. На сегодняшний день пока еще нет четкого понимания, каким образом можно решить данные проблемы. В связи с этим авторы исследования призывают к строгому запрещению манипуляций по редактированию генома человеческих эмбрионов (которые приведут к рождению генно-модифицированного ребенка).
Учитывая все вышесказанное, можно предположить, что будущее технологий редактирования генома лежит в области создания высокоточных химерных систем на основе Cas-белков, обходящихся без разрезания ДНК, но обладающих способностью предсказуемо и точно заменять одни известные нуклеотиды на другие. Уже существуют работы, показывающие принципиальную состоятельность такого подхода (см. Alexis C. Komor, Yongjoo B. Kim, Michael S. Packer, John A. Zuris & David R. Liu. Programmable editing of a target base in genomic DNA without double-stranded DNA cleavage. Nature (2016) doi:10.1038/nature17946). Но это уже тема для другого обзора.
Новость подготовил © 2016 Дашинимаев Э.Б.
25.04.2016