© Краус Юлия Александровна, доктор биологических наук, руководитель лаборатории эволюции морфогенезов ИБР РАН.
© Краус Юлия Александровна, доктор биологических наук, руководитель лаборатории эволюции морфогенезов ИБР РАН.
Представленное здесь исследование (Gao et al., 2022) посвящено детальному изучению работы "глобальных активаторов" зиготического генома - транскрипционных факторов pou5f3 и Soxb19 - у эмбриона костистой рыбы Danio rerio. Оно выполнено на высоком методическом и технологическом уровне международным коллективом авторов под руководством Дарьи Викторовны Онищук, сотрудника ИБР РАН.
Гипотеза о том, что ядро зиготы и ядра ранних бластомеров не особенно нужны для начальных этапов развития эмбриона, появилась ещё начале XX века. Она основывалась на результатах экспериментов по активации безъядерных яйцеклеток иглокожих спермой другого вида (а иногда и класса) (Boveri, 1918). Изучение роли ядра и цитоплазмы в раннем развитии продолжил А.А. Нейфах, работавший на костистой рыбе Misgurnus fossilis (вьюн). Воздействуя радиацией на икринки разных стадий, Нейфах обнаружил, что ядра не влияют на развитие в период от оплодотворения до ранней бластулы (Neyfakh, 1959; 1964). Он впервые показал, что начало активности ядер связано со стадией средней бластулы. Эти и многие другие работы легли в основу концепции и термина Midblastula Transition (MBT) (Gerhart, 1980). MBT часто связано сразу с несколькими событиями: рассинхронизацией митозов, удлинением S-фазы и появлением G2-фазы клеточного цикла, деградацией материнских мРНК и началом транскрипции собственных генов эмбриона (ZGA, Zygotic Gene Activation). Однако у некоторых животных (например, иглокожие, млекопитающие) ZGA и деградация материнских транскриптов происходят уже на стадиях 1й - 2х клеток. Чтобы объединить всех Metazoa в рамках общей концепции, используется более широкий термин Maternal to Zygotic Transition (MZT). Подробнее на эту тему можно почитать в обзорах (Корж, Минин, 2010; Онищук, Воронина, 2015; Vastenhouw et al., 2019).
Считается, что таймером, определяющим начало ZGA, является либо изменение отношения ядро - цитоплазма, либо изменение концентрации в клетках эмбриона материнских детерминант (транскрипционных репрессоров или активаторов). За счёт каких молекулярных механизмов происходит ZGA? В первую очередь, это активность белков, модифицирующих гистоны и ремоделирующих хроматин, делая его доступным для транскрипции (Eckersley-Maslin et al., 2018). Кроме того, "разбудить" геном эмбриона помогают "глобальные активаторы" - материнские транскрипционные факторы (ТФ). У костистой рыбы Danio rerio в их число входят pou5f3, члены семейства SoxB1, и Nanog - гомологи факторов плюрипотентности млекопитающих (Lee et al., 2013).
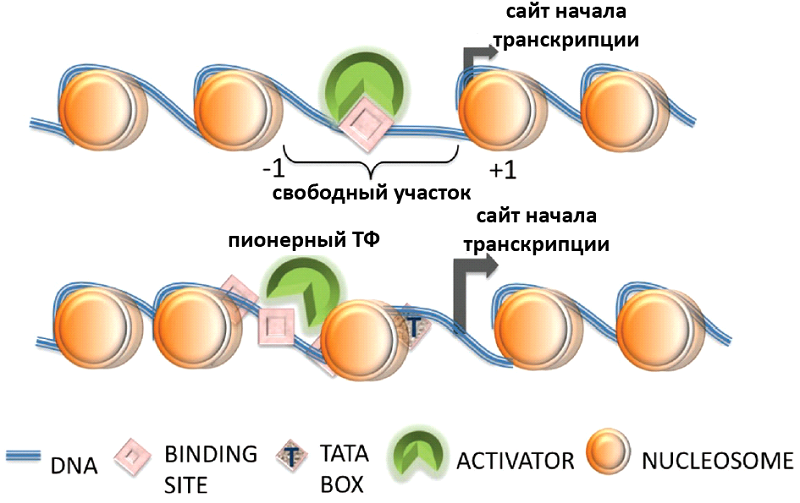
Вероятно, они работают как пионерные ТФ, которые связываются с нуклеосомами и позиционируют их так, чтобы другие ТФ могли связаться со специфическими для них регуляторными участками генов (рис. 1) (Schulz, Harrison, 2018).
Интересно, что концентрация пионерных ТФ в ядрах бластомеров Danio возрастает в 50 - 100 раз между стадиями 32х и 512ти клеток, тогда как их концентрация в клетке (ядро + цитоплазма) возрастает всего в 1.2 - 1.9 раз. Недавнее исследование (Shen et al., 2022) показало, что молекулярным таймером ZGA Danio может служить созревание комплекса ядерной поры (nuclear pore complex, NPC). Увеличение его размера и сложности приводит к увеличению ядерного транспорта материнских ТФ. В результате концентрация ТФ в ядрах достигает пороговых значений, инициирующих ZGA (Shen et al., 2022).
Однако до сих пор нет детальной информации о том, как именно работают пионерные ТФ, как они взаимодействуют друг с другом, и какие ещё функции в регуляции развития (кроме глобальной активации генома) они выполняют. Представленное здесь исследование (Gao et al., 2022), как раз и посвящено детальному изучению работы пионерных ТФ у эмбриона Danio rerio.
В исследовании использовались рыбки Danio дикого типа, а также линии с мутантными генами pou5f3 и sox19b (один из генов семейства SoxB1). За счёт разнообразных скрещиваний получали следующие варианты эмбрионов: MZsox19b (отсутствуют материнский и зиготический sox19b); Msox19b, (отсутствует только материнский sox19b); MZsox19bspg ("двойные мутанты", лишенные материнских и зиготических pou5f3 и sox19b); Msox19bspg (отсутствуют только материнские pou5f3 и sox19b).
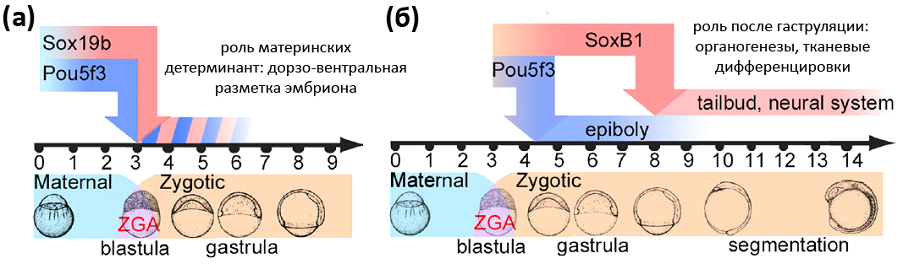
Отсутствие sox19b не оказывало серьезного влияния на раннее развитие. Но sox19b - только один из белков семейства SoxB1. Введение мутантным эмбрионам MZsox19b синтетических олигонуклеотидов морфолино, нарушающих трансляцию других белков этого семейства (Sox3, Sox19a и Sox2), приводило к нарушениям в формировании хвостовой почки, удлинении передне - задней оси и развитии нервной системы. Авторы пришли к выводу, что активность белков Sox2/3/19a/19b становится критичной на поздних стадиях развития, когда гаструляция уже заканчивается.
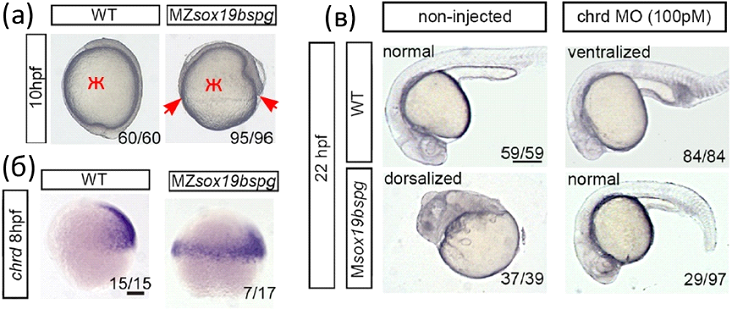
У эмбрионов, не имеющих pou5f3, была серьезно нарушена эпиболия - одно из основных морфогенетических движений костистых рыб, обеспечивающее обрастание желтка бластодермой. Кроме того, эти эмбрионы были слегка дорсализованы. А вот "двойные мутанты" - эмбрионы MZsox19bspg и Msox19bspg - демонстрировали как нарушения эпиболии, так и сильно выраженную дорсализацию (рис. 2а, в). В частности, у них расширялись домены экспрессии маркеров дорсальной стороны - Noggin и Chordin (рис. 2б). У позвоночных Chordin является антагонистом BMP, то есть не даёт молекулам BMP распространяться на дорсальную сторону эмбриона. Снижение уровня экспрессии Chordin с помощью морфолино оказалось достаточным для восстановления нормального фенотипа эмбрионов (рис. 2в).
Авторы предположили, что эти результаты свидетельствует об аддитивном действии материнских pou5f3 и sox19b, которые регулируют экспрессию "вентральных" и/или "дорзальных" генов. Размер домена экспрессии Chordin поддерживается за счёт работы генной регуляторной сети (ГРС), обладающей высокой устойчивостью и способностью к саморегуляции. Отсутствие у эмбриона продукта одного из двух генов может быть скомпенсировано, но одновременное отсутствие pou5f3 и sox19b перекрывает порог устойчивости ГРС.
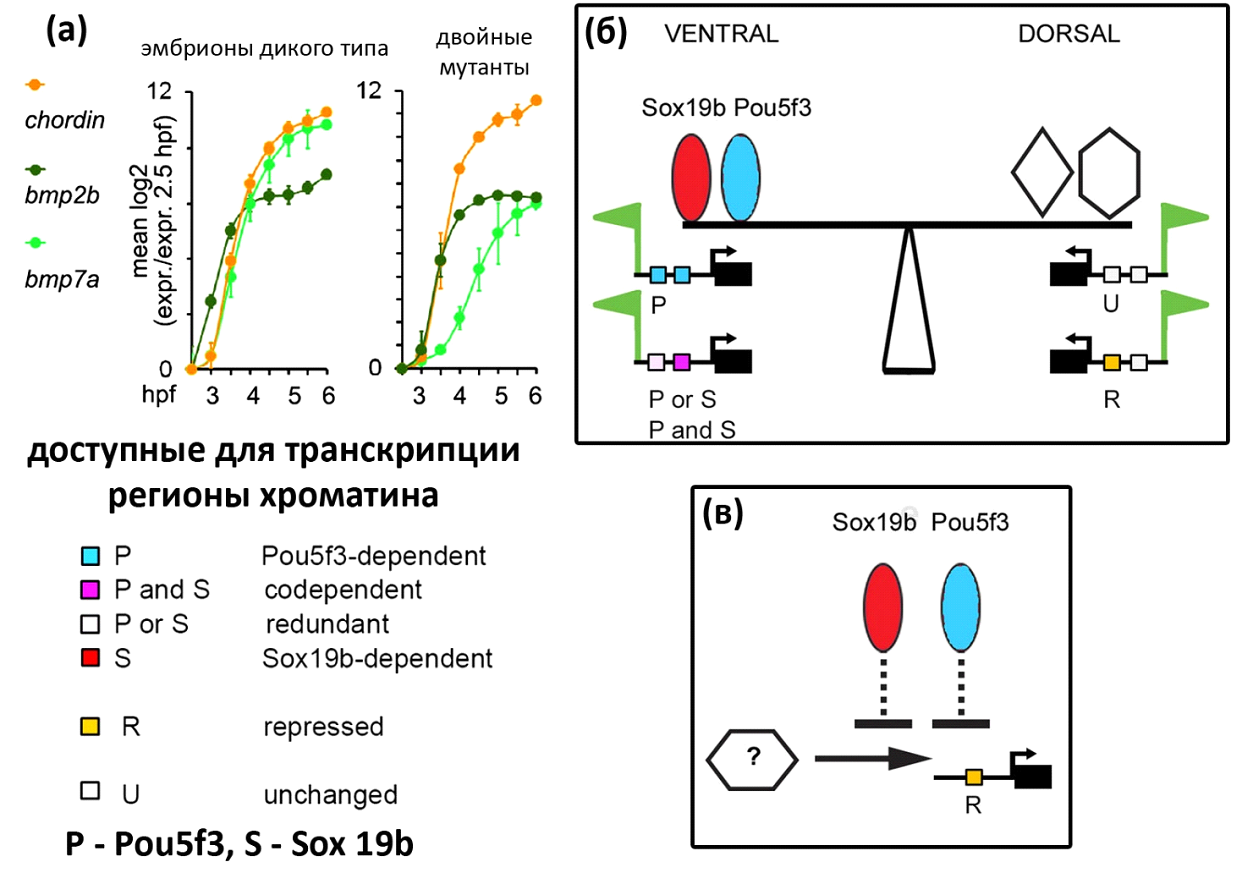
Авторы выполнили сравнительный анализ транскриптомов эмбрионов дикого типа и мутантов. Оказалось, что pou5f3 и/или sox19b активируют транскрипцию 24% зиготических генов. Интересно, что активность этих ТФ регион-специфична (рис. 3). У эмбрионов дикого типа интенсивнее всего транскрибируются гены, экспрессия которых специфична для вентральной стороны. Напротив, у двойного мутанта экспрессия "дорзальных" транскриптов выше, чем "вентральных" (рис. 3а). Учитывая, что размер дорзального домена определяется соотношением концентраций Chordin и компонентов каскада BMP, именно транскрипционный дисбаланс между вентральной и дорзальной стороной приводит к фенотипической дорсализации эмбрионов MZsox19bspg. Таким образом, ZGA зависит от pou5f3 и sox19b на вентральной стороне эмбриона, но не зависит от этих ТФ на дорсальной стороне (рис. 3б).
Один из самых интересных результатов исследования - pou5f3 и sox19b не просто активируют геном, но и контролируют "расписание" транскрипции зиготических генов. В транскриптоме двойных мутантов MZsox19bspg на стадии гаструлы обнаружился высокий уровень иРНК генов, которые в норме экспрессируются у поздних эмбрионов. Это, в первую очередь, транскрипционные факторы (pax8, dlx5a, nkx6. 3, tbx1, tbx2b, tbx3a, tbx6, tbx16l, tbx18, tbx20, tbxtb), регулирующие тканевые дифференцировки. Ещё А.А. Нейфах предположил, что существует две "временные" группы зиготических генов. Первая состоит из генов, продукты которых необходимы для нормального хода гаструляции. Эти гены экспрессируются с середины и до конца стадии бластулы. Во вторую группу входят гены, экспрессирующиеся с середины гаструляции, "подготавливая" органогенезы и тканевые дифференцировки. Авторы исследования Gao et al., 2022 продемонстрировали, что работа пионерных ТФ pou5f3 и sox19b обеспечивает надёжный временной разрыв между экспрессией генов первой и второй временной группы (рис. 3в; 4а, б).
И так, pou5f3 и sox19b необходимы для активации генов, экспрессия которых специфична для вентральной стороны эмбриона. Более того, pou5f3 и sox19b нужны для предотвращения преждевременного "включения" поздних генов. Как они выполняют свои функции? Чтобы ответить на этот вопрос, авторы объединили результаты, полученные несколькими методами: анализом геномов/транскриптомов, ATAC-Seq и ChIP-seq.
Метод ATAC-Seq (Assay for Transposase-Accessible Chromatin with high-throughput sequencing) позволяет выявлять участки открытого хроматина, доступного для транскрипции, а также картировать положение нуклеосом. Он основан на добавлении адаптера для NGS (next-generation sequencing) к живым ядрам с помощью гиперактивной Tn5 транпозазы. Этот фермент преимущественно садится именно на открытые участки хроматина, которые потом можно амплифицировать и секвенировать. Карту участков открытого хроматина сопоставляли с данными, полученными методом ChIP-seq (иммунопреципитация хроматина с последующим секвенированием), который используется для изучения взаимодействий ДНК с белками, в первую очередь, с ТФ. И, конечно, авторы сравнили данные, полученные для эмбрионов дикого типа и для мутантных эмбрионов.
Авторы показали, что оба ТФ - sox19b и pou5f3 - нужны для того, чтобы на стадии бластулы резко возрастало число доступных для транскрипции участков хроматина. pou5f3 и sox19b вытесняют нуклеосомы из специфичных для них участков хроматина - мотивов sox, sox:pou и pou. Оказалось, что sox19b и pou5f3 - независимые пионерные факторы, хотя в многих случаях действуют аддитивно. sox19b обеспечивает доступность хроматина, связываясь с sox-мотивами. Однако, в отсутствии pou5f3, sox19b либо не может связаться с sox:pou-мотивами, либо его одного недостаточно для того, чтобы "открыть" хроматин. При этом pou5f3 "открывает" хроматин, связываясь как с pou, так и с sox:pou мотивами.
Судя по данным сравнительного анализа транскриптомов, sox19b и pou5f3 могут не только обеспечивать транскрипцию открытых участков хроматина, но и репрессировать её. Авторы разделили участки хроматина, доступные для транскрипции у эмбрионов дикого типа, на три группы:
"down" - доступность региона снижается у двойных мутантов;
"unchanged" - доступность региона у двойных мутантов такая же, как у дикого типа;
"up" - доступность региона повышается у двойных мутантов.
Затем участки "down" и "up" проверили на присутствие мотивов связывания, специфичных для pou5f3, sox19b или других ТФ. Оказалось, что мотивы sox:pou, sox и pou перепредставлены на участках "down". Следовательно, непосредственное связывание pou5f3 и/или sox19b с регуляторными регионами генов способствует повышению доступности хроматина. Напротив, в составе участков "up" мотивы sox:pou, sox и pou встречались реже, чем в среднем по геному. Таким образом, роль pou5f3 и sox19b в репрессии транскрипции должна быть опосредована какими-то другими молекулами (рис. 3в).
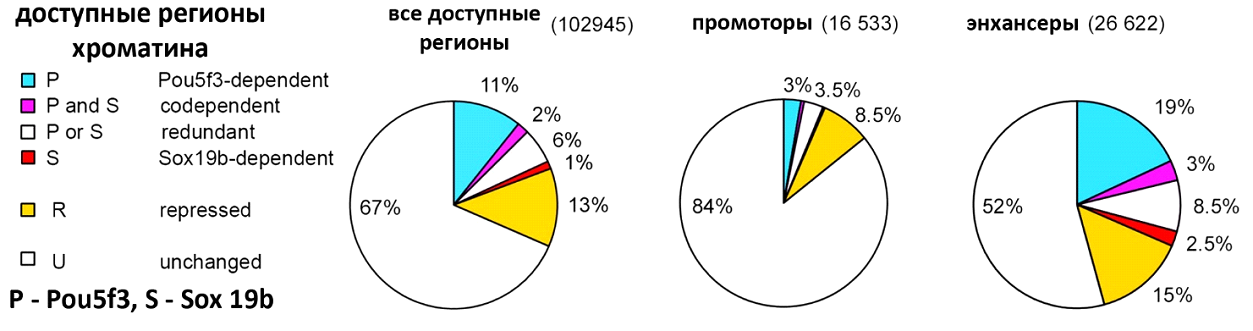
С какими именно регуляторными последовательностями связываются pou5f3 и sox19b? В ходе ZGA гистон H3 модифицируется: происходит ацетилирование остатка лизина в 27 позиции от N-конца. Эта эпигенетическая метка - H3K27ac - характерна для активных энхансеров. Авторы картировали метку H3K27ac в геноме эмбрионов с помощью метода ChIP-seq. После этого они сравнили изменения H3K27ac вокруг участков открытого хроматина (выявленных методом ATAC-Seq) у эмбрионов дикого типа и у мутантов. Появление метки H3K27ac хорошо коррелировало с повышением доступности хроматина. Оказалось, что 33% всех доступных для считывания регионов, 16% промоторов и целых 48% энхансеров напрямую или косвенно регулируются pou5f3 или sox19b (рис. 5). При этом pou5f3 подавляет активацию sox19b-зависимых энхансеров, принадлежащих генам, экспрессирующимися во время органогенеза (например, в нервной системе). Кроме того, pou5f3 и sox19b косвенно репрессируют регуляторные регионы ТФ, вовлеченных в дифференцировку тканей на стадиях после гаструляции.
Авторы завершают статью упоминанием крайне интересного факта: можно провести чёткую параллель между ролью pou5f3 and sox19b в эмбриогенезе и в репрограммировании соматических клеток in vitro. У эмбриона Pou5f1 и Sox2 обеспечивают баланс между активностью "ранней" и "поздней" групп генов. При репрограммировании мышиных фибробластов, Pou5f1 and Sox2 точно так же "выключают" гены, экспрессия которых характерна для соматических клеток и активируют гены, экспрессирующиеся на ранних стадиях эмбриогенеза (Chronis et al., 2017). К сожалению, о механизмах работы этих ТФ при репрограммировании соматических клеток пока очень мало известно. Будем ждать новых публикаций, посвященных "глобальным активаторам", способным разбудить геном не только эмбриона, но и соматической клетки!
Корж В. П., Минин А. А. 2010. Краткая история вьюна, или зачем помнить о морфогенетической функции ядер. Онтогенез. т. 41. с. 150–158.
Онищук Д. В., Воронина А. С. 2015. Активация генома зародыша и регуляция плюрипотентности клеток. Успехи биологической химии. т. 55. с. 197–222
Arya G., Maitra A., Grigoryev S. A. 2010. A Structural Perspective on the Where, How, Why, and What of Nucleosome Positioning. Journal of Biomolecular Structure and Dynamics. v. 27(6). pp. 803-820.
Chronis C. et al. 2017. Cooperative binding of transcription factors orchestrates reprogramming. Cell. v. 168. pp. 442–459.
Eckersley-Maslin M. A., Alda-Catalinas C., Reik W. 2018. Dynamics of the epigenetic landscape during the maternal-to-zygotic transition. Nature Reviews Molecular Cell Biology. v. 19(7). pp. 436-450.
Gerhart J. 1980. Mechanisms regulating pattern formation in the amphibian egg and early embryo., in: Goldberg, R. (Ed.), Biological Regulation and Development. Plenum Press, New York, pp. 133–315.
Lee M. T. et al. 2013. Nanog, Pou5f1 and SoxB1 activate zygotic gene expression during the maternal-to-zygotic transition. Nature. v. 503. pp. 360–364.
Neyfakh A.A. 1959. Xray inactivation of nuclei as method for studying their function in the early development of fishes. J. Embryol. Exp. Morphol. v. 7. pp. 173–192.
Neyfakh A.A. 1964. Radiation Investigation of Nucleo Cytoplasmic Interrelations in Morphogenesis and Biochemical Differentiation. Nature. v. 201. pp. 880–884.
Schulz K. N., Harrison M. M. 2018. Mechanisms regulating zygotic genome activation. Nat. Rev. Genet. v. 20(4). pp. 221-234.
Shen W. W., Gong B., Xing C., Deng H., Wu X., MengShen A. 2022. Comprehensive maturity of nuclear pore complexes regulates zygotic genome activation. Cell. v. 185. pp. 4954–4970.
Vastenhouw N. L., Cao W. X., Lipshitz H. D. 2019. The maternal-to-zygotic transition revisited. Development. v. 146(11). p.dev161471.
Новость подготовила
© Краус Ю.А.
10.04.2023